在A549细胞中靶向p66Shc shRNA的沉默效应
陈 娜 ,王晓洋 ,杜 玮 ,孙亚楠 ,李西川 ,马振毅 ,刘 喆 ,3
(天津医科大学1.基础医学研究中心,天津市医学表观遗传学重点实验室;2.生物化学与分子生物学教研室;3.免疫学教研室,天津300070)
在哺乳动物中已发现3种Shc基因:ShcA、ShcB、ShcC[1]。ShcA蛋白家族共有3个成员,分别是p46Shc,p52Shc,p66Shc[2],他们都有一个 SH2 结构域,一个中心脯氨酸丰富区(CH1)和一个磷酸酪氨酸结合结构域(PTB),但p66Shc还含有一个独特的N-端结构域(CH2),位于该结构域的第36位丝氨酸是p66Shc活化的关键调控位点[3],p66Shc正是通过此位点发挥抑制胰岛素样生长因子-I的功能[4]。越来越多的实验证实p66Shc与肿瘤发生和转移密切相关,p66Shc很可能是评价前列腺癌和冠状动脉疾病预后好坏的有价值的生物标志物之一[5-6],但详细的作用机制仍需深入研究。如果在表达p66Shc的癌细胞中运用RNA干扰技术把p66Shc的表达水平下调,细胞会出现什么样的生物学变化,此为进一步研究p66Shc蛋白的生物学功能进而深入探讨肿瘤发生与转移机制提供了又一研究工具。
1 材料与方法
1.1 主要仪器和试剂 CO2培养箱(Thermo),蛋白质电泳仪器(Bio-Rad),倒置荧光显微镜(上海长方光学仪器厂),低温高速离心机(Eppendorf),酶联免疫检测仪(Thermo)。人非小细胞肺癌细胞株A549、Phoenix-293细胞来自本实验室,培养条件:细胞在37℃、5%CO2、饱和湿度下用含有10%胎牛血清的RPMI 1640培养基培养。质粒pSuper.retro.puro(pSRP)和慢病毒包装系统来自本实验室,限制性内切酶来自NEB,E.coli DH5α和质粒提取试剂盒购于原平皓试剂有限公司,RPMI1640培养液、胎牛血清和胰蛋白酶购于Hyclone,Trizol试剂、逆转录试剂盒和引物购自Invitrogen,Cell proliferation ELISA BrdU购自Roche,抗beta-actin和p66Shc抗体分别BD Biosciences Millipore抗鼠二抗购自Jackson Lab,底物Chemiluminescent HRPsubstrate购自Millipore。
1.2 pSRP-ip66Shc质粒的构建及其鉴定 根据哺乳动物真核细胞shRNA的Tuschl AA-19nt的设计原则,从p66Shc基因的mRNA序列中筛选1条shRNA靶序列,并合成相应的正义和反义DNA模板。利用Ambion shRNA在线软件设计了针对p66Shc的shRNA:5′-GATCCCCCGGAATGAGTCTCTGTCATCGTTCAAGAGACGATGACAGAGACTCATTCCGTTTTTA-3′,3′-GGGGCCTTACTCAGAGACAGTAGCAGTTCTCTGCTACTGTCTCTGAGTAAGGCAAAAATTCGA-5′,用荧光素酶基因的shRNA-iluc作对照。将引物10000×g离心10min,加入水稀释到3mg/mL,然后在25μL体系(TEpH8.0buffer)中,加入各1.5μL的引物,95℃3min,37℃退火1 h,最终至室温。连接反应:用Bgl II和Hin d III酶切pSRP载体,割胶回收后的pSRP载体片段2μL,退火的DNA片段6μL,加入1μL 10×连接Buffer和 1μLT4 DNA Ligase,连接2 h,转化入E.coli DH5α细胞中,得到转化子pSRP-ip66Shc。质粒的鉴定:用Eco RI和Xho I酶切鉴定。
1.3 277-ip66Shc质粒的构建及其鉴定 用Eco RI酶切质粒pSRP-ip66Shc,再用T4 DNA polymerase补平缺口,纯化后用Xho I酶切DNA片段,回收该DNA片段。用Eco RV和Xho I酶切277载体,割胶回收后备用。连接反应:回收的277载体片段2μL,DNA片段6μL,加入1μL 10×连接Buffer和1μL T4DNA Ligase,连接过夜。之后转化入E.coli DH5α细胞中,得到转化子277-ip66Shc。质粒的鉴定:用Bam HI和Xho I酶切鉴定。
1.5 A549细胞的感染 感染当天,A549细胞密度为60%~70%,弃去细胞液,加入含有polybrene(6 μg/mL)的病毒,12 h后观察细胞状态,如果没有明显的细胞毒性作用,48 h以后更换为正常培养基。如果有明显的细胞毒性作用,马上换为正常培养基;感染3 d后首先观察GFP的表达情况,收集总蛋白进入后续Western Blot实验。
1.6 半定量RT-PCR检测p66ShcmRNA水平 总RNA抽取根据Invitrogen公司的Trizol操作说明书进行,均为RNase-free操作。在转染后的35mm细胞培养板中加入1mL的Trizol,室温放置5min,加入200μL氯仿,用力震荡1min,室温放置5min;4℃,12 000×g,20min离心;从每管中吸取上清至另一1.5mLEppendorf管,加入1/2体积-20℃预冷的异丙醇,混匀后-20℃沉淀20min;4℃,13 000×g离心20min后,去上清;加入1mL 4℃预冷的75%乙醇,洗涤沉淀及离心管壁;4℃,13 000×g离心5min,弃上清;加入50μLRNase-free水,至完全溶解。反转录反应:用反转录试剂盒将mRNA转录为cDNA。p66Shc引物F:CAGCCATGCCAGACTCAGGC,R:CACACACCAGACTGATGGCCT。GAPDH 引物 F:GGTGGTCTCCTCTGACTTCAACA,R:GTTGCTGTAGCCAAATTCGTTGT,检测p66Shc-shRNA在mRNA水平上的变化。
1.7 Western blot检测p66Shc蛋白的表达水平 弃去细胞培养液,加入适量的预冷Laemmli sample buffer(62.5mmol/LTris-HCl,pH 6.8,25%glycerol,2%SDS,5%β-mercaptoethanoland 0.01%BromophenolBlue);冰上裂解细胞10min,用预冷的刮刀将细胞刮下;超声破碎细胞(200W共4次,每次3 s,间隔 3 s);4℃,12 000×g,离心 5min;100℃加热变性10min;SDS-PAGE:根据目的蛋白大小,采用Bio-Rad电泳装置将总蛋白进行SDS-PAGE分离;电转移:在4℃,200mA恒流条件下电转移80min,将蛋白样品转移到NC膜上;封闭:用TBST(TBS+0.1%Tween-20)含5%脱脂牛奶室温封闭1 h;一抗孵育:用含有5%牛奶的TBST分别稀释内参β-Actin一抗(1∶5 000)和 p66Shc一抗(1∶2 000),室温下与封闭好的NC膜孵育2 h或4℃过夜;洗膜:TBST洗膜3次,每次5min;二抗孵育:用含有5%牛奶的TBST稀释与一抗相应的辣根过氧化物酶偶联的羊抗鼠二抗(1∶2 000),于室温下孵育 1 h;洗膜:TBST 洗膜3次,每次10min;显色反应:用Chemiluminescent HRPsubstrate作用在膜上3min,于暗房中曝光于X线底片上。
1.8 BrdU标记细胞增殖 以每孔1×103细胞数接种于96孔培养皿中,培养1 d,加入BrdU(终浓度为10μmol/L),37℃,孵育 4 h;弃培养液,加入Fix Denat 200μL,室温摇床孵育30min;弃上清,加入抗BrdU抗体(工作浓度1∶100),室温摇床孵育1.5 h;弃上清,PBS洗涤3次;加底物反应5 min,再加入1mol/L H2SO4每孔25μL终止反应;用酶标仪检测在波长为450nm、690nm(参考波长)的吸光度,重复10个孔。
2 结果
2.1 pSRP-ip66Shc和277-ip66Shc质粒的构建及其鉴定 将合成的shRNA引物退火后与Bgl II和Hin dⅢ酶切回收后的pSRP载体连接后做转化;用Eco RI和Xho I酶切质粒pSRP-ip66Shc,经1%的琼脂糖凝胶电泳,得到320bp的条带,空载体得到250bp的条带(图1)。用Eco RI酶切质粒pSRP-ip66Shc,再用T4 DNA polymerase补平,纯化后用Xho I酶切DNA片段,得到320bp条带,然后回收该320bp的条带。用Eco RV和Xho I酶切277载体,割胶回收后备用。连接277载体与回收的DNA片段,得到的质粒再用Bam HI和Xho I酶切,得到1条850bp的条带,空载体得到1条530bp的条带(图2)。
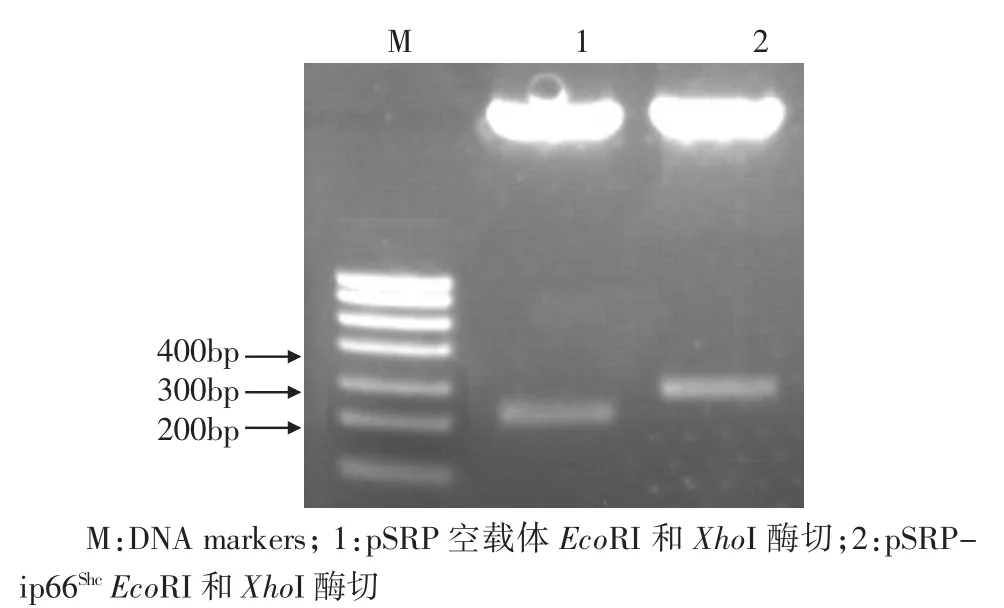
图1 pSRP-ip66Shc质粒的酶切鉴定Fig 1 Restriction enzym edigestion of pSRP-ip66Shc plasm id
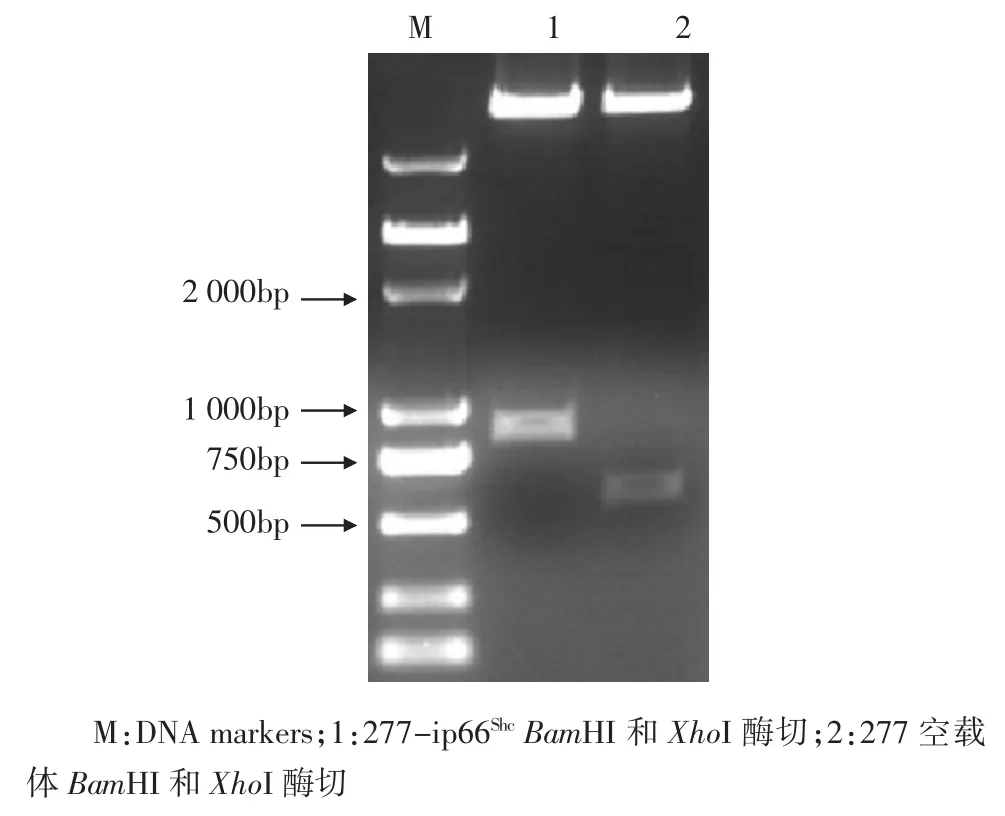
图2 277-ip66Shc质粒的酶切鉴定Fig 2 Restriction enzym edigestion of 277-ip66Shc plasm id
2.2 p66Shc的沉默效应
2.2.1 半定量RT-PCR检测p66Shc的mRNA水平的变化 将转染过病毒的对照组和shRNA病毒的细胞提取RNA,进行反转录,然后用p66Shc的引物和GAPDH引物做半定量PCR,实验组的p66Shc的mRNA表达量比对照组明显降低,而GAPDH表达没有变化。多次重复实验中,p66Shc-shRNA慢病毒对目标基因p66Shc在mRNA水平有明显下调作用(图3)。

图3 半定量RT-PCR检测p66Shc的mRNA水平Fig 3 Sem i-q RT-PCR detection of p66Shc mRNA level
2.2.2 Westernblot检测p66Shc蛋白表达变化 Western blot检测转染后A549细胞的p66Shc的表达发现,加shRNA病毒的细胞比对照细胞表达p66Shc蛋白明显减少,几乎就没有再表达p66Shc(图4)。
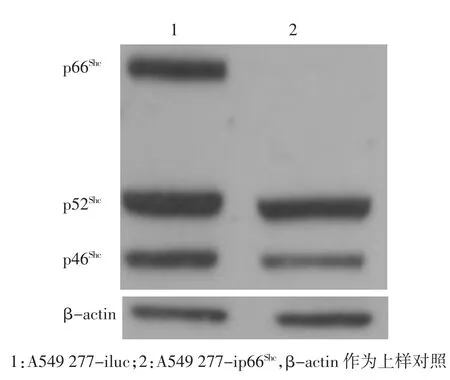
图4 Western blot检测p66Shc蛋白表达Fig 4 W estern blot detection of p66Shc protein level
2.3 下调p66Shc之后影响细胞增殖 根据吸光值(450 nm吸光值减690 nm吸光值)分析细胞增殖结果。发现对A549细胞下调p66Shc之后细胞增殖明显减少(图5)。转染277-ip66Shc的实验组细胞增殖情况与转染277-iluc对照组细胞相比,t=18.7,P<0.001。

图5 BrdU实验检测细胞增殖Fig 5 BrdU detection of cellproliferation
3 讨论
由于信号衔接蛋白ShcA对细胞的增殖、分化和凋亡起重要的调控作用,近年来引起了广泛的关注。在小鼠中将p66Shc基因敲除可使小鼠减少糖尿病诱导的氧化应激反应从而抑制糖尿病肾病的发生[7],提示p66Shc是一个氧化还原状态的决定因子:在基因敲除p66Shc的小鼠中,巨噬细胞中的氧化物是减少的[8]。近年来也有研究发现p66Shc分布在粘着斑中,一旦细胞失去贴附的胞外基质,通过激活RhoA来介导失巢凋亡(一种特异的细胞脱离生长基质后而启动的细胞凋亡)[9]。失巢凋亡对机体的正常发育至关重要,它可以确保脱离生长基质的细胞死亡,而耐受失巢凋亡的则是肿瘤细胞发生转移的生物学基础之一[10]。p66Shc可以通过降低Ras的活性来抑制癌细胞的转移[11]。本研究通过构建针对p66Shc靶向的shRNA慢病毒载体,转染到A549细胞中,从细胞的形态学、细胞的增殖、mRNA水平以及蛋白表达水平等几个方面进行干扰前后的检测对比,证实p66ShcRNA干扰后导致p66Shc的mRNA表达下调,同时抑制了p66Shc蛋白表达,进而减少了细胞的增殖,这说明细胞的增殖与细胞中p66Shc蛋白表达及其mRNA水平密切相关,同时也说明p66Shc参与的细胞信号传递途径对肿瘤细胞的增殖起到重要的作用。本研究对进一步研究p66Shc功能及其信号传递途径提供了有效的基因沉默研究工具,相关研究工作正在进行中。
[1]Terui E,Matsunaga T,Yoshida H,et al.Shc family expression in neuroblastoma:high expression of shcC is associated with a poor prognosis in advanced neuroblastoma[J].Clin Cancer Res,2005,11(9):3280
[2]Tomilov A A,Ramsey JJ,Hagopian K,et al.The shc locus regulates insulin signaling and adiposity in mammals[J].Aging Cell,2011,10(1):55
[3]PelicciG,Dente L,De Giuseppe A,etal.A family of shc related proteinswith conserved PTB,CH1 and SH2 regions[J].Oncogene,1996,13(3):633
[4]XiG,Shen X,Clemmons D R.p66Shcinhibits insulin-like growth factor-Isignaling via directbinding to Src through its polyproline and Src homology 2 domains,resulting in impairmentof Src kinase activation[J].JBiolChem,2010,285(10):6937
[5]Noda Y,YamagishiS,MatsuiT,etal.The p66Shcgeneexpression in peripheral bloodmonocytes is increased in patientswith coronary artery disease[J].Clin Cardiol,2010,33(9):548
[6]CapitaniN,LucheriniOM,Sozzi E,etal.p66Shc-a longevity redox protein in human prostate cancer progression andmetastasis:p66Shcin cancer progression andmetastasis[J].Blood,2010,115(18):3726
[7]MeniniS,Amadio L,OddiG,etal.Deletion ofp66Shclongevity gene protects against experimental diabetic glomerulopathy by prevent ing diabetes-induced oxidative stress[J].Diabetes,2006,55(6):1642
[8]Tomilov A A,Bicocca V,Schoenfeld R A,et al.Decreased superoxide production in macrophages of long-lived p66Shcknock-out mice[J].JBiolChem,2010,285(2):1153
[9]Ma Z,Myers D P,Wu R F,et al.p66Shcmediates anoikis through RhoA[J].JCellBiol,2007,179(1):23
[10]Liu SG,Wang B S,Jiang Y Y,et al.Atypocal protein kinase Cι(PKCι)promotesmetastasisofesophagealsquamous cell carcinoma by enhancing resistance to Anoikisvia PKCι-SKP2-AKT pathway[J].MolCancer Res,2011,9(4):390
[11]Ma Z,Liu Z,Wu R F,etal.p66(shc)restrainsRashyperactivation and suppressesmetastaticbehavior[J].Oncogene,2010,29(41):5559

