NS-398对人胃癌细胞系SGC-7901增殖、凋亡和COX-2表达的影响
余 涛,李良庆,王家兴,于锡阳,栗大伟
(福建医科大学附属第一医院胃肠外科一区,福建福州350004)
胃癌是世界上最常见的消化道恶性肿瘤之一,尤其是在东亚和东南亚,包括中国在内[1]。每年我国因胃癌死亡的人数占各种恶性肿瘤之首,传统手术及术后化疗对进展期胃癌的治疗仍不理想,近年来,随着对肿瘤分子生物学研究的不断深入,针对肿瘤细胞增殖、凋亡、细胞周期等的研究逐渐成为抗肿瘤治疗的重点和热点。环氧合酶-2(cyclooxygenase-2,COX-2)作为新型肿瘤标志物,在多种人类肿瘤中过度表达,在肿瘤的进展中,COX-2参与了许多病理生理过程,包括细胞的增殖、凋亡、调节免疫和血管生成[2-3]。近年来选择性COX-2抑制剂,在抗肿瘤通路中受到国内外学者的广泛关注,本实验通过MTT、免疫组化、ELISA、流式细胞仪观察选择性COX-2抑制剂NS-398在体外对胃癌细胞增殖、凋亡的影响。
1 材料和方法
1.1 主要材料及试剂 人胃癌SGC-7901细胞株购自南京凯基生物技术有限公司。NS-398购自美国Sigma公司;四甲基偶氮唑蓝(MTT)购自美国Sigma公司;胰蛋白酶、RMPI-1640培养基、胎牛血清购自美国Gibco公司;前列腺素-E2(prostaglandin E2,PGE2)酶联免疫测定试剂购自江苏碧云天生物技术研究所;Alexa Fluor 488Annxin V/PI试剂盒购自Invitrogen公司。COX-2免疫组织化学试剂盒购自北京中杉金桥生物公司。
1.2 方法
1.2.1 细胞培养 SGC-7901细胞置于37℃,体积分数5%CO2恒温培养箱内培养,培养液为含体积分数10%灭活胎牛血清的RMPI-1640培养基,当细胞呈对数增殖并覆盖培养瓶瓶底80%面积时可用于传代或实验。
1.2.2 MTT法测定NS-398对SGC-7901细胞的抑制率 取对数期生长的SGC-7901细胞,制备单细胞悬液,以每孔1.0×104个细胞接种于96孔板培养24 h后。换 NS-398 浓度分别为 50、100、200 μmol·L-1的含体积分数10%胎牛血清的RMPI-1640培养基,其中设空白对照组,即未加药的培养基,每种浓度设6个复孔,分别培养 24、48、72 h后,再向每孔加 MTT(5 g·L-1)20 μL,继续培养 4 h,吸去原培养液,每孔加入DMSO 150 μL,振荡 10 min;用酶标仪(波长 490 nm)测定每个孔的吸光度(OD)值,按下列公式计算细胞抑制率,抑制率=(1-实验组OD值)/对照组OD值×100%。
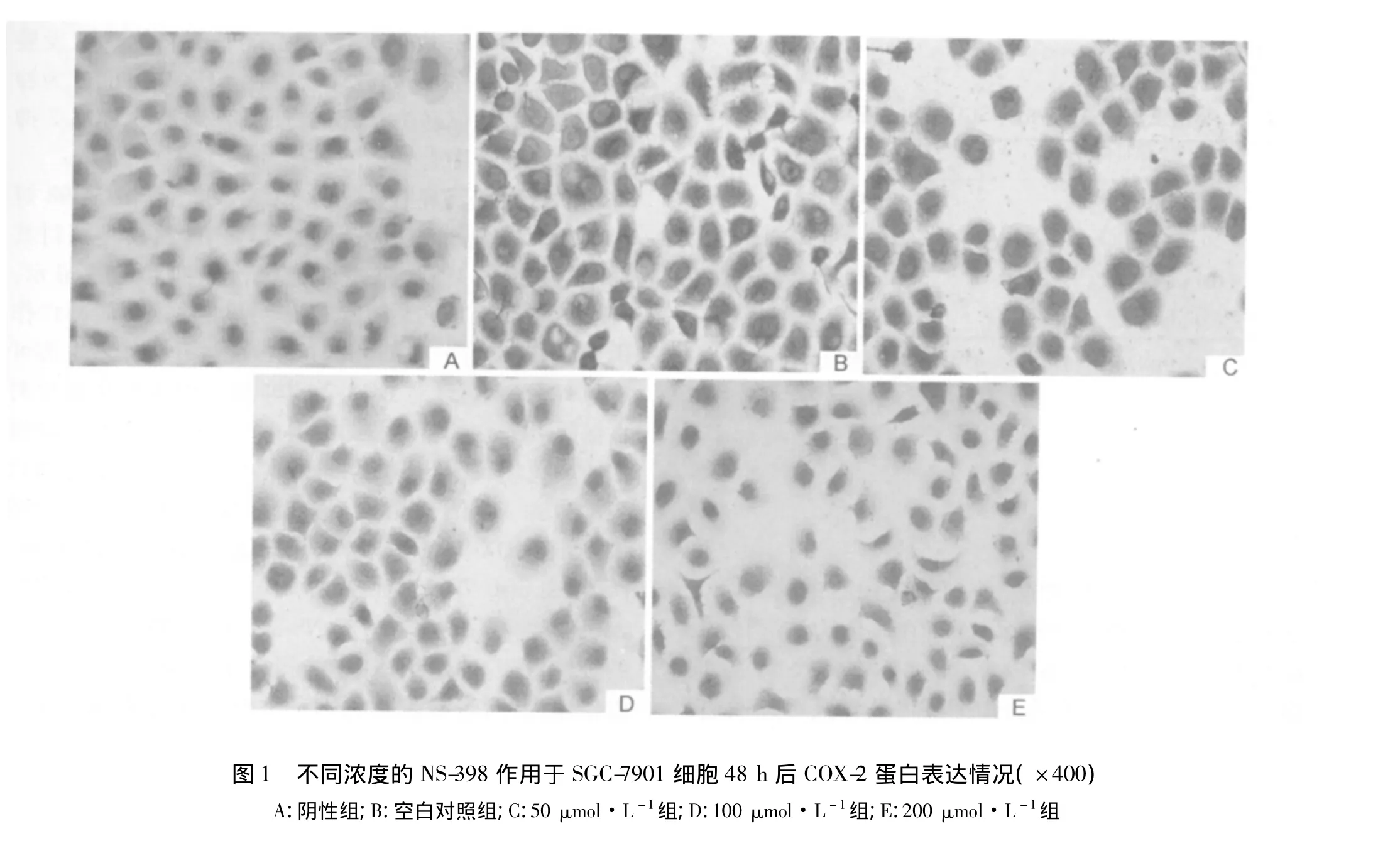
1.2.3 免疫组化方法检测COX-2蛋白的表达 取对数生长期的SGC-7901细胞接种于含盖玻片的6孔板内,常规培养24 h后,换NS-398浓度分别为50、100、200 μmol·L-1的含体积分数 10%胎牛血清 RMPI-1640培养基并设实验空白对照组,即不含NS-398的培养基继续培养48 h,取出玻片,PBS冲洗数次,体积分数4%的多聚甲醛固定。COX-2免疫细胞化学染色,操作按试剂盒说明书进行。用PBS代替一抗作为阴性对照组,用无NS-398干预组作为阳性对照组。判断标准:将不同浓度处理组重复40次,每张玻片置于光学显微镜下,随机计数1 000个细胞(独立高倍视野)中的阳性细胞数,用 Gatalica等[4]的半定量分析法,即对每张切片的阳性细胞率及阳性细胞着色强度分别进行分级计分,然后根据2项乘积确定其阳性强度。将染色强度分为4级:无染色为0分,弱染色1分,中等染色2分,强染色3分,阳性细胞百分率:<5%为0分,5% ~25%为1分,26% ~75%为2分,>75%为3分;然后进行组织评分(H)=染色强度计分(I)×阳性细胞百分率计分(P),0~1分为阴性(-),2~3分为弱阳性(+),4~6分为阳性(++),>6分为强阳性(+++)。本研究以阳性及强阳性记为阳性数据,以阴性及弱阳性记为阴性数据。
1.2.4 ELISA法测定SGC-7901细胞释放的 PGE2将呈对数生长期的SGC-7901细胞制成单细胞悬液,以每孔1×105个的密度接种于24孔板,每孔1 mL。常规培养24 h后弃去培养液分组加药物。实验组NS-398 浓度分别为 50、100、200 μmol·L-1,对照组加培养液。培养48 h后分别收集上清,存于-20℃中备用。取上述细胞培养上清液,按ELISA试剂盒说明书进行测定PGE2。
1.2.5 流式细胞仪检测细胞凋亡率 选对数生长期的SGC-7901细胞,2.5 g·L-1胰蛋白酶消化成单细胞悬液后,用培养液调整细胞浓度为每孔1×105个,接种于6孔培养板,每孔1.5 mL。细胞贴壁后弃去培养液分组加药物。实验组NS-398浓度分别为50、100、200 μmol·L-1,对照组加培养液。培养 48 h 后分别收集每孔细胞,再经预冷的PBS洗3次,按Alexa Fluor 488Annxin V/PI试剂盒提供的方法依次加入结合缓冲液、Alexa Fluor 488Annxin V和PI,常温避光15~30 min后经流式细胞仪检测并读取细胞凋亡率。
1.2.6 统计学处理 采用SPSS 17.0处理数据。计量资料以±s表示。对符合正态分布的计量资料采用方差分析,多组间指标的比较均采用单因素方差分析,LSD-t及SNK-q检验。细胞染色结果比较采用χ2检验。检验水准α=0.05。
2 结果
2.1 NS-398对SGC-7901细胞生长抑制曲线 NS-398以时间剂量依赖性方式抑制SGC-7901细胞的生长,差异有统计学意义(P<0.05),不同浓度的NS-398作用24、48、72 h后细胞抑制率均逐渐上升(P<0.05)。见表1。

表1 不同浓度NS-398在不同时间对SGC-7901细胞的抑制率 %
2.2 NS-398对SGC-7901细胞COX-2蛋白的表达COX-2免疫阳性染色在光镜下表现为胞浆和胞核呈棕黄色颗粒,阴性细胞表现为胞浆和胞核未见明显棕黄色染色颗粒。结果显示:COX-2在SGC-7901细胞的胞浆及胞核中成高表达,阳性表达率为95.03%;经50、100、200 μmol·L-1的 NS-398 作用 48 h 后的 SGC-7901细胞COX-2蛋白表达明显减弱,与对照组比较,差异有统计学意义(P<0.05);随着NS-398浓度的增加,COX-2蛋白表达呈下降趋势,且实验组间差异有统计学意义(P <0.05)。见表2、3,图1。
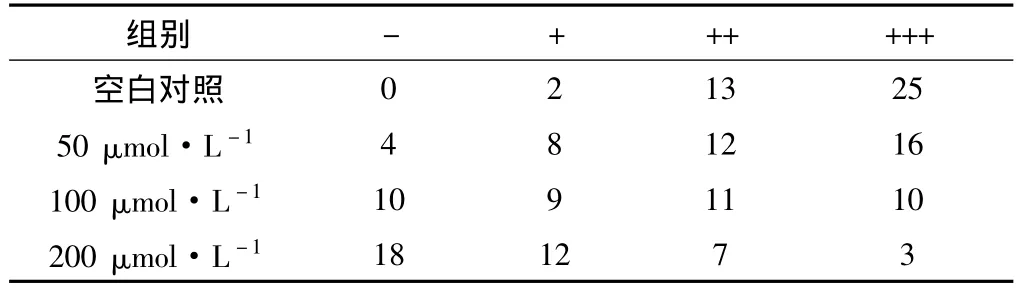
表2 不同浓度NS-398作用于SGC-7901细胞48 h后COX-2蛋白的表达

表3 不同浓度NS-398作用于SGC-7901细胞48 h后的COX-2蛋白表达率
2.3 NS-398作用SGC-7901细胞后PGE2的检测结果 NS-398可明显抑制PGE2的释放,且呈剂量依赖效应,0、50、100、200 μmol·L-1的 NS-398 作用 SGC-7901细胞48 h后,PGE2的释放量呈下调趋势,实验组与空白对照组比较差异有统计学意义(P<0.05),各实验组之间比较差异有统计学意义(P<0.05)。见表4。
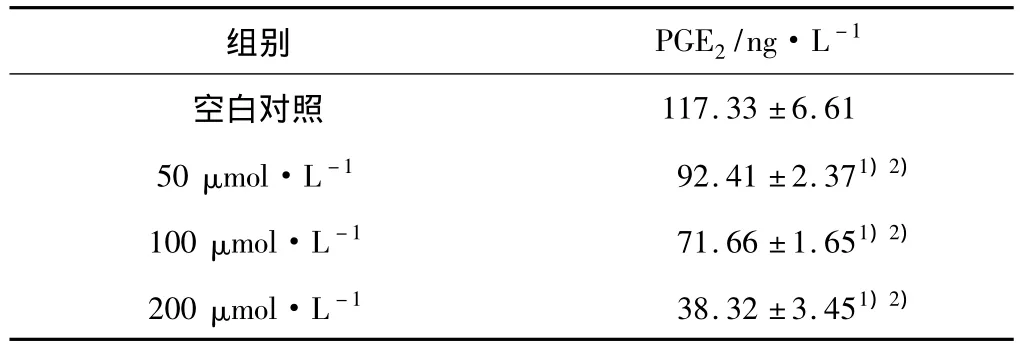
表4 不同浓度的NS-398作用于SGC-7901细胞后PGE2表达
2.4 细胞凋亡率检测 0、50、100、200 μmol·L-1的NS-398作用SGC-7901细胞48 h后,SGC-7901细胞的凋亡率明显高于对照组,差异有统计学意义(P<0.05)。随着药物浓度的增加,凋亡率呈上调趋势,且各实验组之间比较差异有统计学意义(P<0.05)。见表5。

表5 不同浓度的NS-398对SGC-7901细胞凋亡的影响
3 讨论
COX-2是花生四烯酸/前列腺素代谢中的一个关键限速酶,与COX-1不同,COX-2在人体为诱导性酶,在生理状态下静息组织内不表达,而在致炎因子、损伤、生长因子、致瘤因子等作用下可诱导其迅速表达。近年来,越来越多研究[5-6]发现 COX-2在肿瘤发生、发展中产生重要作用,许多恶性肿瘤内都能检测到COX-2的高表达,如乳腺癌、肺癌、大肠癌和鼻咽癌等。研究表明,在胃癌细胞中COX-2也存在高表达,且其表达程度与胃癌预后密切相关[7]。本实验研究也证明COX-2在胃癌细胞中存在高表达,提示,COX-2可能与胃癌的发生存在相关性,研究发现COX-2的高表达不仅代表肿瘤的早期事件,且与肿瘤的浸润程度、淋巴结转移、TNM分期及患者的预后密切相关[8-9]。目前认为COX-2的致肿瘤机制包括:诱导肿瘤血管生成、抑制肿瘤凋亡、增加肿瘤发生和侵袭的能力、免疫抑制等[10-11]。
前列腺素作为第二信使,与其受体结合,可发挥多种生物学效应。如促进细胞的增殖、诱导血管的生成、刺激肿瘤细胞的生长、抑制肿瘤细胞的凋亡等。COX-2的高表达增加了PGE2的合成,PGE2可抑制树突状细胞成熟,抑制CD8+T细胞的活性,抑制人白细胞抗原Ⅰ和Ⅱ的表达,从而减少机体免疫系统对突变细胞的免疫监视作用[12],此外,PGE2可诱导Bcl-2的表达,后者参与了内源性凋亡途径(线粒体凋亡途径),可阻止细胞色素C从线粒体向胞浆释放,而该环节位于半胱氨酸蛋白酶caspase级联反应上游[13],因此阻断了内源性凋亡途径,导致细胞在增殖与凋亡中失衡,从而导致肿瘤的产生。理论上可通过抑制COX-2的表达而使PGE2的产生减少,从而诱导肿瘤细胞凋亡。
由于COX-2致癌途径成为了许多肿瘤发生、发展及抗凋亡重要途径,因此作者推测COX-2可能成为肿瘤靶向治疗的很好位点,这促使研究选择性COX-2抑制剂抑制肿瘤细胞生长的可能性。
本研究主要观察选择性COX-2抑制剂NS-398对SGC-7901细胞株的增殖、凋亡的影响,并初步探讨其可能的机制。MTT、流式细胞仪检测实验结果显示,NS-398对SGC-7901细胞具有明显的抑制、促凋亡作用,并呈现良好的时间和剂量双效依赖性,作者推测可能与NS-398通过对COX-2的抑制作用而活化诱导凋亡信号caspase-3活性、抑制Bcl-2的表达、提升介导凋亡的转化生长因子TGFβ2受体水平以及抑制抗凋亡关键激酶Akt活性相关。免疫组化、ELISA法检测结果显示,COX-2在SGC-7901细胞株中呈现高表达,PGE2在SGC-7901存在高释放量,这与国内外许多学者研究结果一致[14-15],经 NS-398作用48 h后 COX-2的表达量明显减少、PGE2的释放呈下调趋势,并呈剂量依赖性,同时细胞凋亡水平上升。作者推测可能与抑制COX-2-PGE2依赖途径,抑制Bcl-2的表达,阻断内源性凋亡途径相关。因此本研究结果证实选择性COX-2抑制剂NS-398在体外可通过COX-2依赖途径,诱导胃癌细胞凋亡,抑制胃癌细胞增殖,这为COX-2抑制剂有可能用于胃癌的预防和治疗提供了一定的实验理论依据。
[1]Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics,2002[J].CA Cancer J Clin,2005,55(2):74 -108.
[2]Rudnick DA,Perlmutter DH,Muglia LJ.Prostaglandins are required for CREB activation and cellular proliferation during liver regeneration[J].Proc Natl Acad Sci U S A,2001,98(15):8885-8890.
[3]Ozuysal S,Bilgin T,Ozgur T,et al.Expression of cyclooxygenase-2 in ovarian serous carcinoma:correlation with angiogenesis,nm23 expression and survival[J].Eur J Gynaecol Oncol,2009,30(6):640-645.
[4]Gatalica Z,Lele SM,Rampy BA,et al.The expression of Fhit protein is related inversely to disease progression in patients with breast carcinoma[J].Cancer,2000,88(6):1378 -1383.
[5]Greenhough A,Smartt HJ,Moore AE,et al.The COX-2/PGE2 pathway:key roles in the hallmarks of cancer and adaptation to the tumour microenvironment[J].Carcinogenesis,2009,30(3):377-386.
[6]Ghosh N,Chaki R,Mandal V,et al.COX-2 as a target for cancer chemotherapy[J].Pharmacol Rep,2010,62(2):233 - 244.
[7]Shin VY,Jin HC,Ng EK,et al.Nicotine and 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone induce cyclooxygenase-2 activity in human gastric cancer cells:Involvement of nicotinic acetylcholine receptor(nAChR)and beta-adrenergic receptor signaling pathways[J].Toxicol Appl Pharmacol,2008 ,233(2):254 -261.
[8]蔡凤林,周士福,马兆生 ,等.乳腺浸润性导管癌中COX-2、MMP-2的表达及其相关性[J].实用癌症杂志,2008,23(1):44-47.
[9]Pan J,Kong L,Lin S,et al.The clinical significance of coexpression of cyclooxygenases-2,vascular endothelial growth factors,and epidermal growth factor receptor in nasopharyngeal carcinoma[J].Laryngoscope,2008,118(11):1970 -1975.
[10]Legan M,Luzar B,Ferlan-Marolt V,et al.Cyclooxygenase-2 expression determines neo-angiogenesis in gallbladder carcinomas[J].Bosn J Basic Med Sci,2006,6(4):58 -63.
[11]Lang S,Picu A,Hofmann T,et al.COX-inhibitors relieve the immunosuppressive effect of tumor cells and improve functions of immune effectors[J].Int J Immunopathol Pharmacol,2006,19(2):409-419.
[12]Chen TH,Fukuhara K,Mandai M,et al.Increased cyclooxygenase-2 expression is correlated with suppressed antitumor immunity in cervical adenocarcinomas[J].Int J Gynecol Cancer,2006,16(2):772-779.
[13]Fosslien E.Molecular pathology of cyclooxygenase-2 in neoplasia[J].Ann Clin Lab Sci,2000,30(1):3 -21.
[14]Kuo CH,Hu HM,Tsai PY,et al.Short-term celecoxib intervention is a safe and effective chemopreventive for gastric carcinogenesis based on a mongolian gerbil model short-term celecoxib intervention is a safe and effective chemopreventive for gastric carcinogenesis based on a Mongolian gerbil model[J].World J Gastroenterol,2009 ,15(39):4907-4914.
[15]Wei M,Morimura K,Wanibuchi H,et al.Chemopreventive effect of JTE-522,a selective cyclooxygenase-2 inhibitor,on 1,2-dimethylhydrazine-induced rat colon carcinogenesis[J].Cancer Lett,2003,202(1):11-16.

