奥曲肽联合奥美拉唑体外对胃癌细胞株SGC-7901生长的影响
李春雷,李志浩,刘 菁,李 鹏,郑 芳,朱雪松
胃癌的发生发展与其生理位置有密切关系。首先,胃癌细胞的微环境(胞外低pH值、低氧浓度、高葡萄糖吸收等),尤其是酸性微环境对胃癌细胞的侵袭和转移、胃癌细胞对放化疗的敏感性有着重要影响[1]。其次,人胃肠道正常组织分泌的生长激素释放抑制素(Somatostatin,SST,生长抑素)的含量变化可能与胃癌的发生发展有关[2],而且SST在体内外实验中显示出抗肿瘤作用[3-4]。在肿瘤微酸环境的重要调节因子中,V型ATP酶发挥了重要作用,而质子泵抑制剂可显著抑制V型ATP酶,发挥抗肿瘤作用[1]。同时,质子泵抑制剂还可通过降低V型ATP酶的活性而减弱肿瘤的酸化,从而逆转肿瘤多药耐药的发生[5]。奥曲肽(Octreotide,OCT)是体外合成的生长抑素八肽类似物,具有比天然SST血浆半衰期长、作用更强大、耐受性好等优点[6-7],与胃部肿瘤相关生长抑素受体有很好的亲和力。本文选择不同抗肿瘤机制的非细胞毒药物-奥曲肽和质子泵抑制剂-奥美拉唑共同作用于胃癌细胞,研究联合用药对胃癌细胞的影响,探讨其抗肿瘤效应,以期为临床胃癌化疗中的联合用药提供依据。
1 材料与方法
1.1 材料
1.1.1 细胞 人胃癌细胞株SGC-7901细胞,我院肝病分子实验中心保存。
1.1.2 主要试剂 RPM11640培养基;胎牛血清(标准级)和0.25%胰蛋白酶(BOSTER公司);奥美拉唑(鲁南制药),奥曲肽(诺华制药),碘化丙啶和MTT(Sigma公司),小牛血清(杭州四季青生物材料研究所)。
1.1.3 主要设备 二氧化碳恒温箱、超净台、倒置显微镜、酶标仪、96孔板,流式细胞分析仪。
1.2 方法
1.2.1 细胞培养 人胃癌细胞株SGC-7901细胞置含有5%胎牛血清 RPM11640培养基中,在37℃、5%CO2的饱和湿度下培养,1~2d换1次液,3d左右传代,取对数生长期细胞试验。
1.2.2 奥曲肽和奥美拉唑对人胃癌细胞SGC-7901生长的影响 选择对数生长期胃癌SGC-7901细胞,常规消化后制成单细胞混悬液,计数调整细胞浓度为1×107/L,接种于96孔培养板中,200 μL/孔,37 ℃、5%CO2的饱和湿度下培养24 h后,换为无血清的 RPMI164O液培养,孵育24 h后将细胞分为6组。空白组:无细胞,只有培养液;对照组:培养液不加药物;奥曲肽组:不同浓度奥曲肽;奥美拉唑组:不同浓度奥美拉唑;联合用药组:不同浓度奥曲肽+奥美拉唑。其中奥曲肽和奥美拉唑设5个浓度段,每个浓度3个复孔。上述各组培养24 h后加入MTT继续孵育4 h,弃上清液,每孔加入DMSO,振荡溶解,于酶联免疫检测仪570 nm处测定各孔吸光度值(A),计算抑制率。抑制率(%)=(对照组A值-实验组A值)/对照组A值×100%。
1.2.3 采用中效原理判断奥曲肽与奥美拉唑联合用药的作用效果 抑制率(fa)=1-(实验组平均A值/对照组平均A值)。根据中效方程式fa/fu=(D/Dm)m(fu为肿瘤细胞存活率,fu=1-fa;D为药物浓度;Dm为中效浓度,即fa达到0.5效应时的药物浓度),方程两边取对数:log(fa/fu)=mlogD-mlogDm。设 y=log(fa/fu),x=logD,a=-mlogDm(m为斜率,设m=b),得直线方程:y=bx+a。计算出两种药物单用及合用时各自的中效浓度Dm(logDm=-a/b),然后计算两药合用时在各种效应时的合用指数(CI)=D1/Dx1+D2/Dx2+αD1D2/Dx1Dx2,D1、D2为合用时产生 X 效应时两药各自所需的浓度,Dx1、Dx2为两药单用时产生X效应时各自的浓度(α=1表示两种药物为相互非排斥性药物,α=0表示两种药物为相互排斥性药物)。CI<1为协同,CI=1为相加,CI>1为拮抗。
1.2.4 奥曲肽和奥美拉唑对人胃癌SGC-7901细胞周期的影响 选择对数生长期细胞,常规胰酶消化计数后,以RPMI1640培养基调整细胞悬液浓度为107/L,接种6孔培养板中,每孔 2 mL,于37℃、5%CO2的恒温箱内培养24 h后更换培养液,分组给药。选择上述MTT实验中的中效浓度作为实验终浓度,单独和联合作用于SGC-7901细胞,培养48 h后常规收集各组细胞,离心,去上清,加70%的预冷乙醇(4℃),于4℃冰箱固定过夜,PBS洗涤2次,再离心去PBS后加入1 mL碘化吡啶,避光30 min,200目滤网过滤后,流式细胞仪检测。
1.2.5 流式细胞仪检测Bcl和Bax蛋白 选择对数生长期胃癌SGC-7901细胞,常规消化后制成单细胞混悬液,调整细胞浓度后以2×107/L接种于小培养瓶中,在37℃、5%CO2含10%小牛血清的RPMI1640培养基中培养,待细胞生长旺盛贴壁后,去掉原培养液。分4组:对照组、奥曲肽组、奥美拉唑组、奥曲肽+奥美拉唑组,实验重复3次,每次加入含药血清培养液继续培养48 h,胰酶消化,计数,离心,PBS液洗涤2次。加入1∶100稀释的一抗100 μL,37℃恒温水浴温育30 min,PBS液洗2次。加1∶20稀释的 FITC标记的二抗100 μL,37 ℃温育30 min,PBS 液洗2 次,离心,除去未结合的多余荧光抗体。加PBS液1.0 mL,用400目滤网过滤后上流式细胞仪检测,测试前用鸡红细胞标准品调整仪器的变异系数值在5%以内。
1.3 统计学分析 应用SPSS 11.5统计软件,计量资料以表示,方差齐性检验或正态检验后进行方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 奥曲肽和奥美拉唑单用及合用对SGC-7901细胞生长的影响 随着不同浓度的奥曲肽与奥美拉唑的浓度升高,药物对SGC-7901细胞的增殖抑制作用逐渐增强,效应逐渐增加,联合用药的抑制率较相应单用药组显著增强,结果见表1。
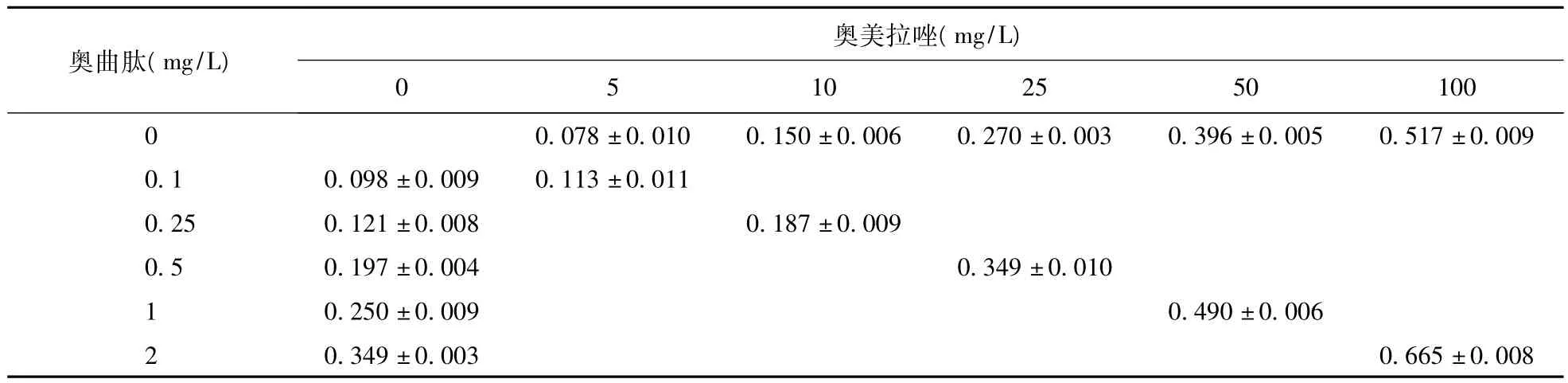
表1 奥曲肽和奥美拉唑对SGC-7901细胞生长的影响(n=9)
2.2 奥曲肽与奥美拉唑联合作用SGC-7901细胞的中效效应 按中效方程式计算得单用奥曲肽的中效浓度为6.92 mg/L,单用奥美拉唑时中效浓度为85.52 mg/L,当奥曲肽与奥美拉唑联合应用时,奥曲肽、奥美拉唑的中效浓度分别为1.01、49.42 mg/L。同时,奥曲肽和奥美拉唑在低效应水平时CI>1,而在多数效应范围尤其是高水平效应时,CI指数均<1,相互之间表现为协同作用,见图1。
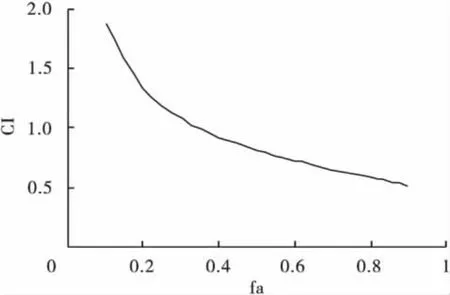
图1 奥曲肽和奥美拉唑合用时CI与fa的关系图
2.3 奥曲肽与奥美拉唑对SGC-7901细胞生长周期的影响 与对照组比较,1.0 mg/L奥曲肽能够阻滞SGC-7901细胞的生长,使G0/G1期细胞增多(P<0.05),而50.0 mg/L奥美拉唑对细胞周期影响不大,但相同浓度的奥曲肽和奥美拉唑共同作用胃癌细胞SGC-7901后,G0/G1细胞比例显著增大(P<0.05),而且超过单用药组。
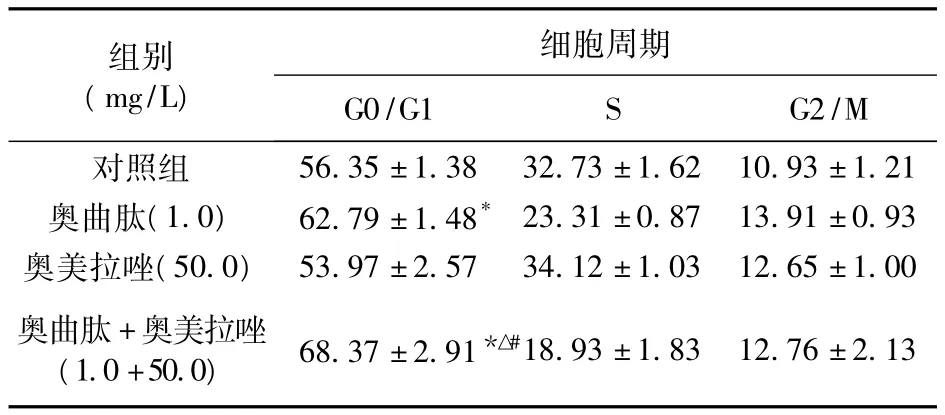
表2 奥曲肽与奥美拉唑单用及联用对SGC-7901细胞周期的影响(%,n=3)
2.4 奥曲肽与奥美拉唑对SGC-7901细胞Bcl-2和Bax蛋白表达的影响 与对照组比较,各组胃癌SGC-7901细胞经过药物处理后,各给药组细胞Bcl-2蛋白表达均减少,Bax蛋白增加,见表3。
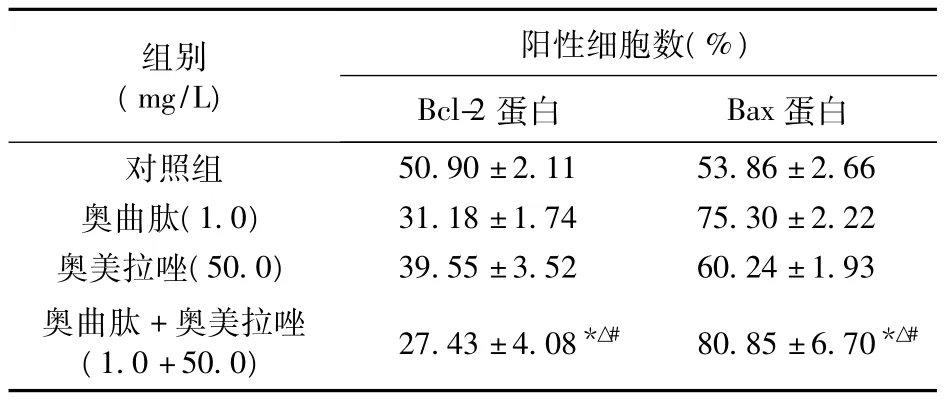
表3 奥曲肽和奥美拉唑对SGC-7901细胞Bcl-2和Bax蛋白表达的影响(n=3)
3 讨论
奥曲肽是具有广泛生物学效应的生长抑素类似物,可治疗消化道出血[8]、胰腺炎[9]、内分泌肿瘤以及胃、肠、胰等实体肿瘤,通过直接和间接作用发挥抗肿瘤作用[10]。研究表明,奥曲肽对人体内胃癌生长具有明显抑制作用[11]。质子泵抑制剂抗肿瘤的效应机制可能是显著降低了肿瘤细胞的异常高pH梯度,即胞外酸性pH和胞质碱性pH,阻止V-ATPases反应,进而允许抗瘤药物进入细胞而发挥功能。早期研究[12]显示,PPI在体内外抑制胃癌细胞凋亡。蒋鹏程等[13]报道,奥美拉唑可以诱导胃癌前病变组织细胞凋亡。张正等[14]报道,奥美拉唑能够直接抑制胃癌细胞HGC-803的增殖。奥美拉唑作用胃癌细胞SGC-7901的相关报道较少。本研究中,奥美拉唑以浓度依赖方式明显抑制胃癌细胞SGC-7901生长。奥曲肽与奥美拉唑联合应用后,随着浓度的增加,抗肿瘤作用也随之增强,中效原理分析,两者在大多数效应尤其是高效应范围合用时,均产生协同效应(CI<1),联合用药的中效浓度明显低于单用药时各自的中效浓度,表明奥曲肽和奥美拉唑联合作用比单独作用效果好,能够增强对胃癌细胞SGC-7901生长抑制作用。通过对流式细胞周期分析,与对照组比较,联合用药和单用奥曲肽作用胃癌SGC-7901细胞48 h后,G0/G1期细胞比例增多(P<0.05),奥美拉唑对细胞周期影响不大,并且联合用药组与单用药组G0/G1期细胞比例的差异有统计学意义(P<0.05),提示奥美拉唑可能增强奥曲肽对胃癌细胞周期的阻滞作用,也间接证明奥美拉唑和奥曲肽共同作用胃癌细胞具有协同效应。同样,联合用药能够显著下调Bcl-2、上调Bax蛋白表达,联合用药的效果优于单用药组(P<0.05),有协同诱导细胞凋亡作用,这种协同作用的机制尚不明确,可能是奥美拉唑改变了胃癌细胞的酸性环境而增强了奥曲肽的作用,值得深入研究。
[1]沈秋瑾,覃文新.靶向肿瘤酸性微环境的抗肿瘤策略[J].生命科学,2008,20(5):795-710.
[2]陈瑞丰,杜国平.生长抑素与胃癌关系的研究现状[J].临床和实验医学杂志,2008,7(6):178-179.
[3]Kumar M,Liu ZR,Thapa L,et al.Antiangiogenic effect of somatostatin receptor subtye 2 on pancreatic cancer cell line:inhibition of vascular endothelial growth factor and matrix metalloproteinase-2 expression in vitro[J].Word J Gastroenterol,2004,10:393-399.
[4]Casini Raggi C,Calabro A,Renzid,et al.Quantitative evaluation of somatostain receptor subtype 2 expression in sporadic colorectal tumor and in the corresponding normal mucosa[J].Clin Cancer Res,2002,8:419-427.
[5]De Milito A,Fais S.Proton pump inhibitors mayreduce tumour resistance[J].Expert Opin Pharmacother,2005,6(7):1049-1054.
[6]陈淮军.生长抑素治疗非静脉曲张性上消化道大出血疗效观察[J].中国医药,2011,6(12):1504-1505.
[7]徐晖,庄丽维,刘娜,等.奥曲肽、生长抑素治疗肝硬化上消化道出血疗效观察[J].中国临床医学,2006,13(6):934-935.
[8]吴卫东.奥曲肽治疗非静脉曲张性上消化道出血疗效观察[J].中国医药,2009,4(10):758-759.
[9]陈霞,王素云,叶丽萍.奥曲肽预防内镜下逆行胰胆管造影术后高淀粉酶血症和急性胰腺炎发生的作用[J].实用医学杂志,2010,26(5):814-815.
[10]孙培龙,胡静波.生长抑素及类似物治疗肿瘤机理的研究进展[J].世界肿瘤杂志,2006,5(3):157-159.
[11]田蕾,李舒.生长抑素类似物奥曲肽对人胃癌生长的抑制作用研究[J].中国全科医学,2011,14(5):1652-1655.
[12]Yeo M,Kim DK,Kim YB.Selective induction of apoptosis with proton pump inhibitor in gastric cancer cells[J].Clin Cancer Res,2004,10(24):8687-8696.
[13]蒋鹏程,倪洪昌,李琦恒.奥美拉唑对胃癌前病变细胞凋亡的影响[J].中国医院药学杂志,2006,26(4):405-408.
[14]张正,李绍敏,刘小菁.奥美拉唑抑制胃癌细胞株生长[J].四川医学,1999,20(2):122-123.

