桦褐孔菌多糖的提取工艺优化及其对小鼠免疫功能的影响
李 宏
(赤峰学院 医学院,赤峰 内蒙古 024001)
桦褐孔菌多糖的提取工艺优化及其对小鼠免疫功能的影响
李 宏
(赤峰学院 医学院,赤峰 内蒙古 024001)
本文通过响应面分析对桦褐孔菌多糖的提取工艺进行了优化,得到最佳提取工艺为提取温度100℃,提取时间3.5h,料液比1:25(g/mL).在最佳提取工艺条件下,桦褐孔菌提取物多糖得率达到1.97%.桦褐孔菌粗多糖对正常小鼠和环磷酰胺致低免疫力小鼠碳粒廓清、淋巴细胞转化实验表明:桦褐孔菌粗多糖可显著提高正常和低免小鼠碳粒廓清功能和淋巴细胞增殖水平.
桦褐孔菌;多糖;提取;响应面;免疫功能
桦褐孔菌(Inonotus obliquus)主要分布于俄罗斯北部、北欧、中国黑龙江、吉林长白山、日本北海道等北纬40~50度地区.民间广泛用于防治消化道疾病和肿瘤(胃癌、肠癌及肝癌等)、心血管疾病、糖尿病和抗病毒等[1,2].大量研究表明,桦褐孔菌中含有三萜类[3]、多酚类[4]、黑色素[5]和多糖[6]等活性物质,具有很高的免疫活性[4-6].本文通过响应面分析对桦褐孔菌多糖的提取工艺进行了优化,并对提取物的免疫活性进行了初步评价.
1 材料与方法
1.1 试验材料
环磷酰胺(cyclophosphamide,CY)上海华联制药有限公司;绵羊血,RPMI-1640不完全培养液,刀豆蛋白(ConA),MTT(四甲基偶氮唑盐)天津鼎国;DMSO(二甲基亚砜)美国Sigma公司;印度墨汁 北京西中化工;黄芪颗粒(国药准字号)四川百里药业.
桦褐孔菌由吉林延边自治州延吉食用菌研究所提供,粉碎、备用.
两周龄Balb/c小鼠,雄性,体重18-22g,室温(20-22℃),自由摄食、饮水.中国医学科学院放射医学研究所实验动物中心提供.
1.2 仪器设备
Uvmini-1240紫外可见分光光度计(日本岛津),SORVALL pico台式高速离心机;MK3型酶标仪(美国Thermo公司),CO2培养箱(美国 Thermo公司),生物显微镜(TE2000-U日本爱尼),超净台(SW-CJ-IFD 苏州净化).
1.3 实验方法
1.3 试验方法
1.3.1 桦褐孔菌粗多糖提取工艺优化
准确称取10.00g桦褐孔菌,加入一定量的水回流提取2次,合并提取液、减压浓缩、醇沉、除蛋白、冷冻干燥,得到粗提物干粉于4℃冰箱中备用.
实验设计及结果如表1所示,以多糖得率为评价指标,重复3次.多糖含量采用硫酸-苯酚法测定.
1.3.2 桦褐孔菌粗多糖对小鼠碳粒廓清吞噬能力的影响
BALb/c小鼠80只,随机分为8组,每组10只(正常小鼠4组;低免小鼠4组,其中免疫力低下小鼠于实验前两天皮下注射环磷酰胺50mg/kg体重,每天一次,共两次,以造成免疫低下模型),按低、中、高计量连续灌喂14d,于试验的第15d,尾静脉注射稀释五倍的印度墨汁0.1ml/10g,分别于1min和10min眼底静脉丛取血,600nm下测OD值,计算吞噬指数K[7].空白对照组每天灌胃等量生理盐水,阳性对照组每天灌胃黄芪颗粒配成的溶液(50mg/Kg),0.1mL/10g体重.
1.3.3 桦褐孔菌粗多糖对小鼠淋巴细胞转化的影响
采用体外培养法[8]:实验分组及操作同1.3.2,于试验的第15d脱颈处死,无菌取出脾脏.用5mL注射器吸取3~5 mL的RPMI-1640不完全培养液反复冲洗,将脾细胞悬液收集到无菌离心管中,1500r/min,离心5min,弃上清液,再加入10mL红细胞裂解液 (pH为7.4的Tris-NH4CI),沉淀用含10%小牛血清的RPMI-1640完全培养液配制成2×106个/mL的脾细胞悬液.于96孔细胞培养板内加入脾细胞悬液100μL、20μL终浓度为 50μg/mL的 ConA溶液和 80μL RPMI-1640完全培养基,空白加入RPMI-1640完全培养液200μL,每组设六个重复.培养板置于37℃、5%CO2培养箱中培养72h.终止培养前4h,每孔加入MTT(5mg/mL)20μL,混匀后继续培养.培养结束,小心吸取孔内培养上清液,然后每孔加入150μLDMSO,稍振荡使紫色结晶完全溶解,以空白对照调零,酶标仪测定570nm处的吸光度值(OD).
1.4 统计学分析
所有数据经SAS9.0和SPSS软件处理后用X±S表示,组间差异采用t检验.
2 结果与讨论
2.1 响应面分析优化
利用SAS9.0软件,以多糖得率为评价指标,通过响应面对温度、时间和料液比三因素进行分析,具体实验设计及结果如表1所示,回归方程如下:
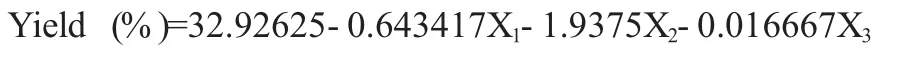

多糖得率的响应面实验方差分析见表2.在多糖提取过程中,温度(X1)、时间(X2)、对多糖得率的影响非常显著(P<0.01),料液比(X3)、温度的二次项(X12)对多糖提取率的影响较显著(P<0.05).
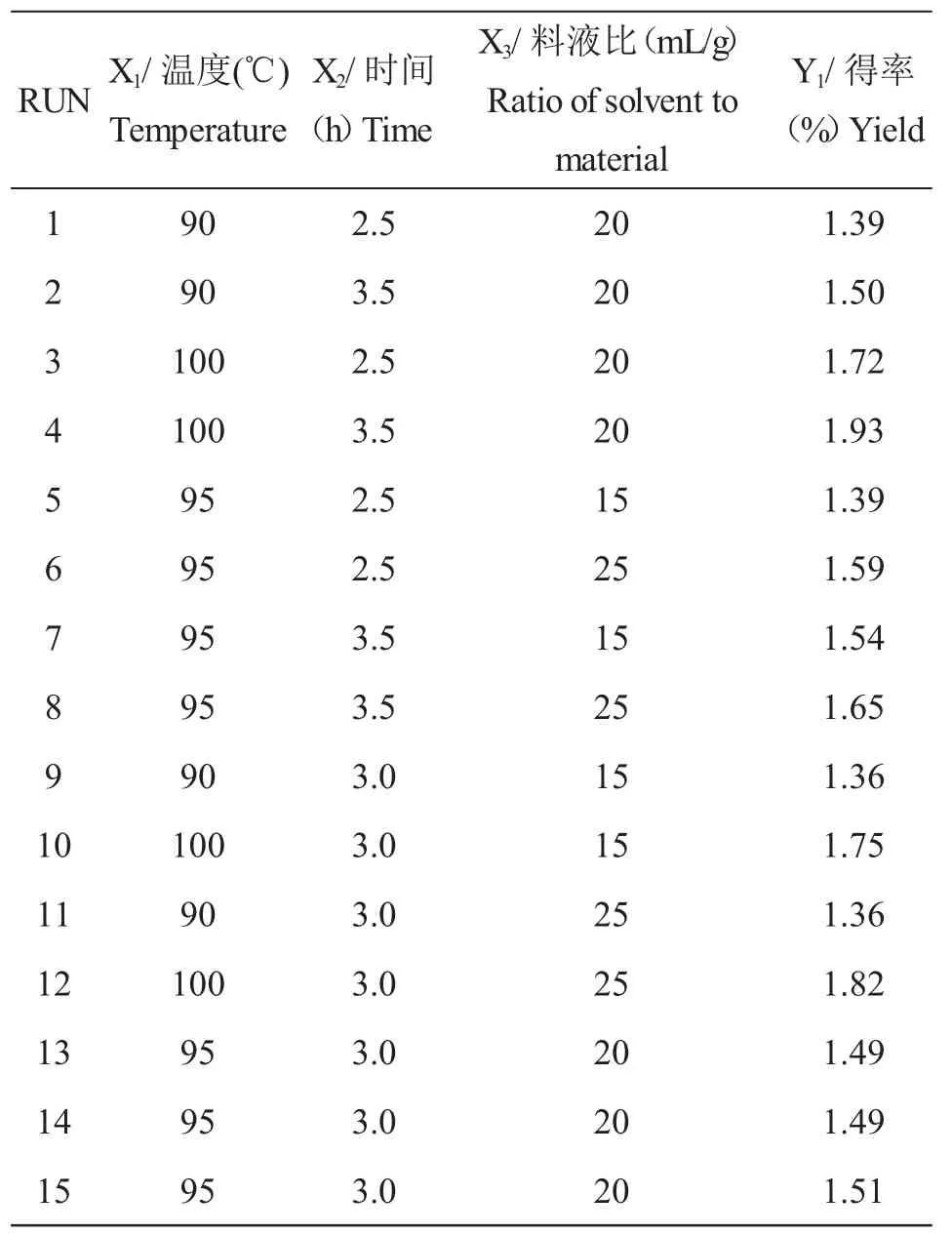
表1 响应面分析试验设计及结果
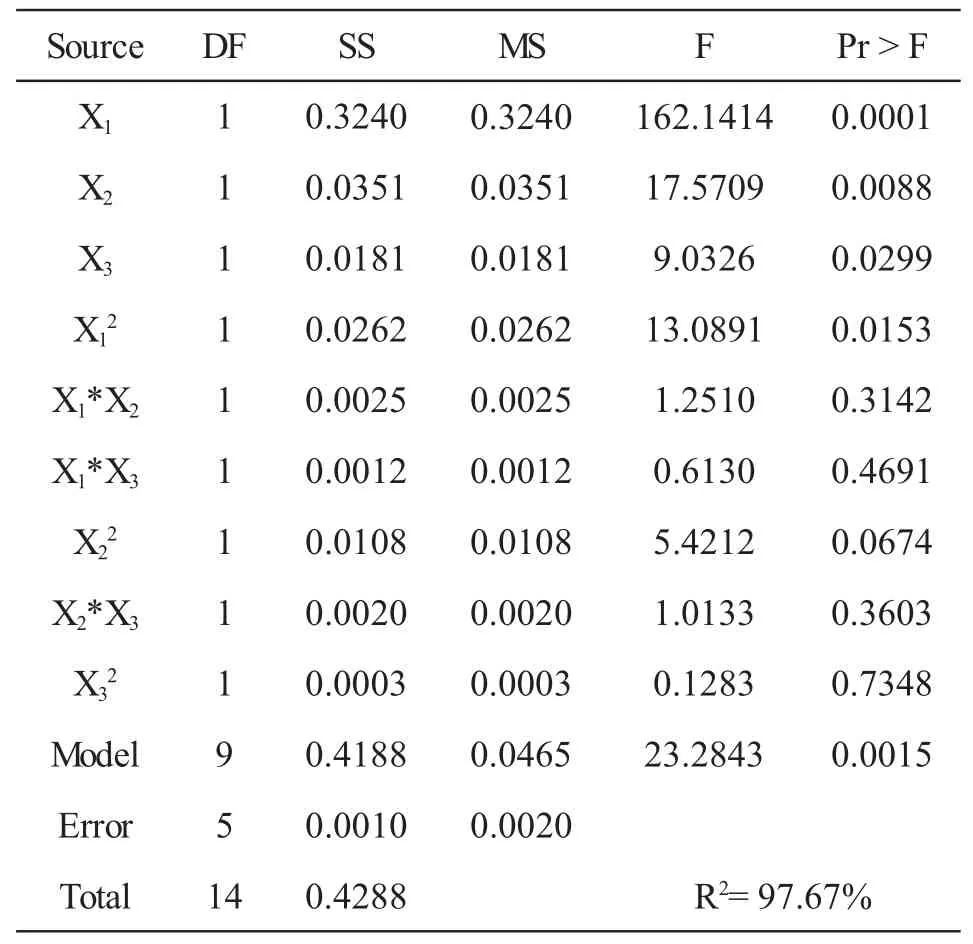
表2 多糖得率的响应面实验因素方差分析
根据回归方程,温度(X1)、时间(X2)、料液比(X3)对得率的响应面分析图如图1、图2、图3、所示.通过分析可知温度(X1)的升高和时间(X2)的延长有利于多糖成分的溶出.通过回归分析可得到最优提取条件为:温度100℃、时间3.5h、料液比25:1(mL/g),模型预测多糖得率为1.962%,在此条件下进行验证实验,得率达到1.97%.
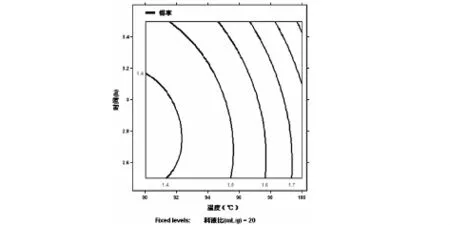
图1 温度和时间对多糖得率的优化曲线图(料液比固定为 20:1(mL/g))
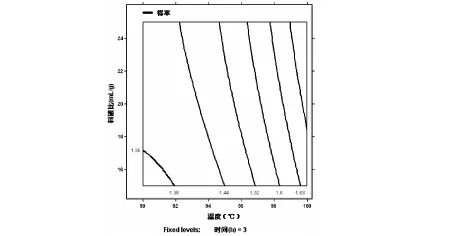
图2 温度和料液比的优化曲线图(时间固定为3h)
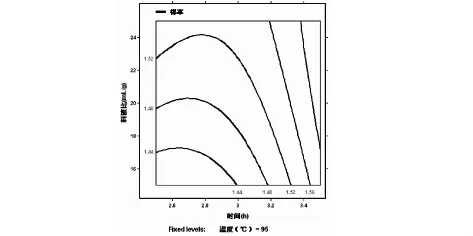
图3 时间和料液比的优化曲线图(温度固定为95℃)
2.2 桦褐孔菌粗多糖对正常和低免模型小鼠碳粒廓清吞噬指数的影响
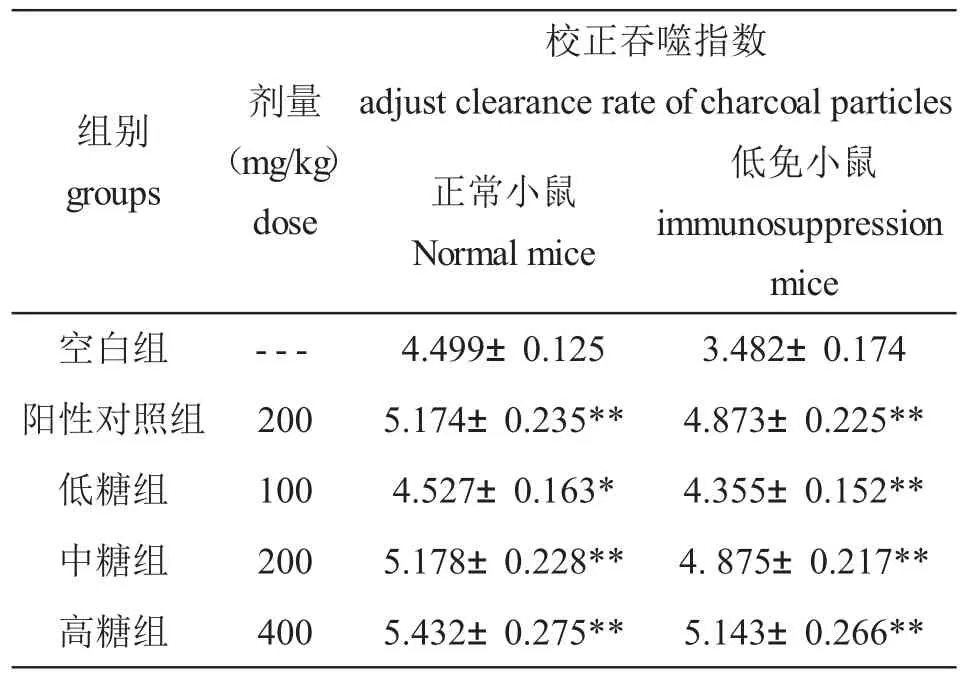
表3 桦褐孔菌多糖对正常和低免模型小鼠碳粒廓清吞噬指数的影响
非特异性免疫是特异性免疫的基础,特异性免疫所产生的免疫物质又能增强非特异性免疫的作用,因此,增强机体的非特异性免疫对提高机体的整个免疫功能意义重大.单核巨噬细胞是非特异性免疫的重要组成细胞之一.当细菌、异物等抗原性物质进入机体后,可迅速被机体单核巨噬系统吞噬和清除,因而巨噬细胞廓清指数可以反映其吞噬功能的强弱.桦褐孔菌多糖对正常及免疫力低下模型小鼠巨噬细胞吞噬功能的影响结果见表3.
由表3可知,桦褐孔菌粗多糖对正常小鼠低、中、高剂量组的校正吞噬指数均显著增加(p<0.01),对低免小鼠低、中、高剂量组的校正吞噬指数均极显著增加(p<0.001),且等剂量的桦褐孔菌多糖与阳性对照黄芪多糖的吞噬指数接近,说明桦褐孔菌多糖可使正常和低免小鼠的单核巨噬细胞系统吞噬异物的能力显著提高,从而增强小鼠的非特异性免疫功能.
2.3 桦褐孔菌粗多糖对正常小鼠和低免小鼠体外淋巴细胞转化的影响
淋巴细胞在受到抗原或有丝分裂原的刺激产生免疫应答的最初阶段,是使静止的淋巴细胞活化增殖成为有活性的细胞.本实验利用刀豆蛋白(ConA)刺激T淋巴细胞,经刺激后增殖的T淋巴细胞采用MTT法进行检测.
图4显示了T细胞受到ConA刺激后,细胞体积增大,代谢旺盛(呈团簇状增长)的增殖情况及加入MTT后,细胞活化增殖时通过线粒体能量代谢过程将MTT代谢形成蓝紫色结晶后,在细胞内或细胞周围形成了较清晰蓝紫色的情况.
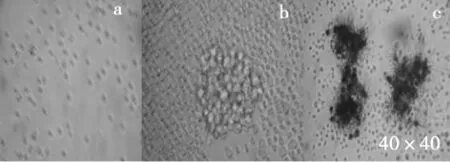
图4 细胞的转化增殖情况(a正常细胞,b加入ConA后,c加入MTT后)
由表4可知,桦褐孔菌粗多糖低、中、高剂量组对正常小鼠淋巴细胞均有显著的增殖作用(低剂量糖p<0.01,中、高剂量糖p<0.001),高于空白组,对免疫力低下模型小鼠的淋巴细胞均有极显著的增殖作用(p<0.001),接近于阳性对照药物(国药准字号黄芪颗粒)对淋巴细胞的增殖作用.说明桦褐孔菌粗多糖可以显著促进正常和环磷酰胺致低免小鼠机体的T淋巴细胞增殖,从而增强机体的免疫力.
3 结论
本文通过响应面分析对桦褐孔菌多糖的微波辅助提取工艺进行了优化,得到最佳提取工艺为提取温度100℃,提取时间3.5h,料液比1:25(g/mL).在最佳提取工艺条件下,桦褐孔菌提取物多糖得率达到1.97%.
桦褐孔菌粗多糖对正常小鼠和环磷酰胺致低免疫力小鼠碳粒廓清、淋巴细胞转化实验表明:桦褐孔菌粗多糖可显著提高正常和低免小鼠碳粒廓清功能和淋巴细胞增殖水平.

表4 桦褐孔菌粗多糖对正常和低免小鼠体外淋巴细胞转化的影响
〔1〕MaretS (1991)Fungiin Khanty folk medicine.J Ethnopharmacol31:175-179.
〔2〕Mizuno T,Zhuang C,Abe K,et al.Antitumor and hypoglycemic activities of polysaccharides from the sclerotia and mycelia of Inonotus obliquus (Pers.:Fr.)pil.(A-phyllophoromycetideae)[J].Int J Med Mushrooms.1999,1:301-316.
〔3〕Yusoo Shin,Yutaka Tamai,Minoru Terazawa.Chemical constituents of Inonotus obliquus,a new triterpene,21,24-cyclopentalanosta-3β,21,25-triol-8-enefrom sclerotium[J].The Japan Wood Research Society(2001)47:313-316.
〔4〕yong Cui,Dong-Seok Kim,Kyoung-Chan Park.Antioxidant effect of Inonotus obliquus[J].Journal of Ethnopharmacology2005,96:79-85.
〔5〕Yong Ook Kim,Hae Woong Park,Jong Hoon Kim,et al.Anti-cancer effect and sructural characterization of endo-polysacchridefrom cultivated myceliaofInonotus obliquus[J].Life science79(2006)72-80.
〔6〕Song HS,Lee YJ,Kim SK,et al.Downregulatory effect of AGI-1120(α-glucosidase inhibitor)and Chaga mushoom(Inonotus obliquus)on clluar nfκb activation and their antioxidantactivity.[J].Korean Jpharmacogen 2004,35:92-97.
〔7〕邓静修,刘芳,陈如泉.地甘口服液促进T淋巴细胞转化及稳定淋巴细胞的实验研究 [J].中华实用中西医杂志,2002,2(15):586~587.
〔8〕徐叔云,卞如濂,陈修.药理实验方法学[M].北京:人民卫生出版社,2002.
R285.5
A
1673-260X(2012)02-0128-03

