狭叶薰衣草离体培养技术研究
王 婵,陈丽娟,程明华,方颂娟,但 敏,李妮亚
(海南师范大学 生命科学学院,海南 海口 571158)
狭叶薰衣草(Lavandula angustifoliaMill.)为唇形科薰衣草属多年生亚灌木[1].狭叶薰衣草的香气尤为宜人,也是经济价值最好的薰衣草.狭叶薰衣草喜冷凉全日照的环境,不宜在高温潮湿环境中生长[2-4],目前大面积的种植主要是在新疆伊犁,种植面积占全国薰衣草种植面积的95%左右[5].由于狭叶薰衣草种子发芽率低,且出苗很不一致,要达到60%~70%的出苗率,需2至3个月的时间.刘珊等[6]报道,以幼嫩的英国薰衣草叶片,通过愈伤再分化,得到完整植株.苏秀娟等[7]以英国薰衣草叶片为外植体,分化出芽获得再生植株,表明可以通过组织培养,大量快繁英国薰衣草.植物的离体培养再生技术,主要具有两个方面的优点:首先是利用该技术进行植物的快繁并且可研究植物器官的发生;第二为植物转基因技术和体细胞诱变育种提供了较好的材料.本实验以狭叶薰衣草为材料,诱导狭叶薰衣草叶、茎段和顶芽的愈伤组织,并通过带有叶的顶芽不经愈伤直接分化出芽而获得再生植株.使得含高品质精油的狭叶薰衣草能快速大量繁殖,同时为下一步通过化学诱变和组织培养相结合的方法培育狭叶薰衣草新品种提供科学依据和技术支撑.
1 材料与方法
1.1 材料与试剂
材料:狭叶薰衣草种子(购于中国香草种子销售中心)在本实验室常温下培育成幼苗;选用长势好、无病虫害、伸展的狭叶薰衣草叶和顶芽作为外植体.
试剂:MS(Murashige and Skoog培养基);6-BA(6-苄氨基嘌呤);NAA(萘乙酸);2.4-D(2.4-二氯苯氧乙酸);IBA(吲哚丁酸).
1.2 方法
1.2.1 消毒
将狭叶薰衣草叶片、嫩茎和顶芽剪下,流水冲洗1.5~2.0 h.在无菌室工作台上将外植体先用75%的酒精浸泡30 s后无菌水冲洗3~5遍,再用0.1%的升汞溶液清洗2 min后无菌水冲洗3~5遍,然后用无菌滤纸吸干叶片表面水分.
1.2.2 培养基
以MS为基本培养基,添加不同种类不同浓度的植物生长调节剂,按不同的实验要求配制培养基(蔗糖:3%;琼脂:0.7%;pH:5.8):①MS+2,4-D 2.0mg/L+6-BA 2.0mg/L;②MS+2,4-D 0.1mg/L+6-BA 0.3mg/L;③MS+2,4-D 0.2mg/L+6-BA 0.3 mg/L;④MS+6-BA 1.0mg/L;⑤MS+6-BA 2.0mg/L;⑥ MS+6-BA 0.1mg/L;⑦MS+6-BA 0.5mg/L;⑧1/2MS+IBA 0.5mg/L;⑨1/2MS+NAA 0.5mg/L.
1.2.3 愈伤组织的诱导
将无菌的外植体顶芽、茎段、叶片接种到培养基①、②和③上.每瓶1~2个外植体,把叶片边缘切除或用无菌刀从叶片中间轻轻划1~2下,利于发生愈伤.在23±1℃,8 h光照(光照强度为1 500 lx),16 h暗培养的条件下进行培养.
1.2.4 愈伤组织的继代
将在愈伤诱导培养基上生长1个月的愈伤组织,挑淡黄色、疏松的愈伤组织转接到④和⑤上,每组20个重复.
1.2.5 丛生芽的诱导
取幼嫩顶芽为外植体,保留顶芽2~3个叶片和其下0.5~1.0 cm左右的茎段,经消毒后接种到⑥MS+6-BA 0.1 mg/L上.薰衣草叶片幼嫩,消毒时间不宜超出3min,防止消毒剂对外植体组织的伤害.外植体流水冲洗2 h左右后叶片张力明显增加,可在消毒时滴加1~2滴吐温80溶液,以消除叶片表面张力使叶片易于贴附在培养基上.
1.2.6 芽的继代增殖培养
芽的继代增殖培养,主要参考Hu等[8]人的方式进行.取1.0~1.5 cm单芽转移到芽继代培养基(⑦MS+0.5mg/L 6-BA)上培养,每瓶接1~2个芽,20~25 d后,再进行转接,这样可以得到大量的丛生芽.转接2-3代后,转移到生根培养基中培养,获得完整的狭叶薰衣草植株.
1.2.7 再生芽的生根培养
将幼嫩丛生芽切分开接种到⑧1/2MS+IBA 0.5mg/L和⑨1/2MS+NAA 0.5mg/L培养基上,每皿接1~2个小芽块,设5个重复,于人工气候箱先暗培养1周,然后移入光照培养,观察生根情况并及时记录初生根时间、生根条数.
2 结果与分析
2.1 不同激素配比对愈伤诱导及增殖的影响
接种在愈伤组织诱导培养基上的外植体,一周后在叶片、茎段和顶芽的切口处有膨大的现象,15 d后相继长出稍许白色愈伤.40 d后统计愈伤组织发生情况.
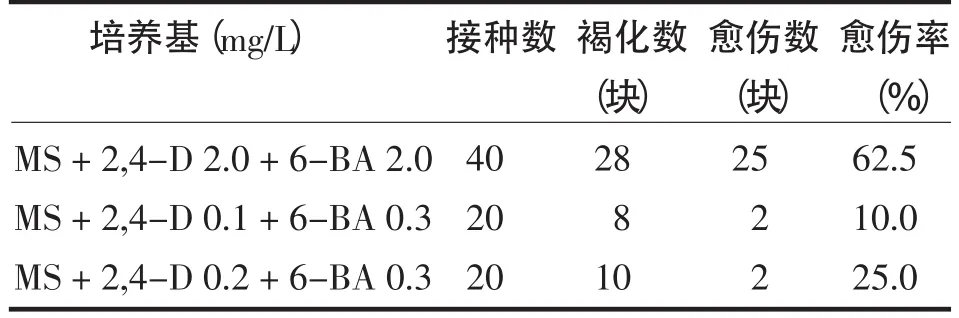
表1 不同植物激素配比对愈伤组织诱导的影响Tab.1 The effect of different concentration of hormones on callus on leaf of L.angustifolia
表1表明,以培养基①诱导愈伤效果好,达62.5%,当把初次发生的愈伤转接到6-BA 1.0mg/L和6-BA 2.0mg/L后,愈伤增殖效果都非常好,其愈伤增殖率差别不甚明显,都达100%,且长势优良而迅速,25~30 d愈伤更加透亮,可长满整个培养瓶.此外,组织褐化现象很容易出现,尤其是叶片,接种后5~7 d即开始褐化并逐渐褐化加深.而低浓度的2,4-D(0.1和0.2 mg/L)和低浓度的6-BA(0.3 mg/L)配比,出愈率都较低.刘珊等[6]实验表明,2,4-D浓度高于0.1 mg/L时的12个组合激素配比,外植体的出愈率都低于60%,2,4-D浓度为0.1 mg/L时外植体出愈率都高于70%,刘珊等[6]采用是较高浓度的KT和较低浓度2,4-D配比.这与本实验结果不一致,推测是在高浓度2,4-D,同时加入高浓度的6-BA,可较快的诱导狭叶薰衣草愈伤的发生.张艳玲等[9]报道,6-BA浓度高的配比比6-BA浓度低的配比愈伤数发生的多.
2.2 不同外植体对愈伤组织诱导的影响
分别取外植体叶片、茎段和顶芽接种到诱导愈伤培养基上,一周后叶片的切口处、叶柄基部、茎段端部和顶芽有膨大现象,20 d后部分叶片较易因褐化而停止发生愈伤,茎段和顶芽褐化不明显,能继续生长出愈伤.
2.3 以带叶顶芽为外植体诱导芽的分化和芽扩增
取带叶顶芽为外植体,且保留其下部0.5~1.0 cm左右的茎部,消毒后将其接种到⑥MS+6-BA 0.1mg/L上,2周后茎基部出现小部分愈伤,25 d后出现绿色芽点并开始逐渐分化成丛生芽,出芽率达80%,35 d后芽增长较快,取基部约1 cm切段转移到丛生芽继代培养基(⑦MS+0.5mg/L 6-BA)上,培养15~20 d,逐渐有许多小芽从基部生出形成丛生芽.且在丛生芽上不断有新的顶芽和腋芽冒出,培养基因芽体的生长显著减少.留出一部分小芽继代培养基上继续培养,其余的小芽用于生根培养.




2.4 再生植株的生根培养
将芽丛中长至1~2 cm的单芽切下后,分别接种到⑧1/2MS+IBA 0.5mg/L和⑨1/2MS+NAA 0.5mg/L培养基上.在含有IBA 0.5mg/L培养基中的丛生芽的芽体,5~7 d后顶芽基部茎段端膨大并裂开,10 d后裂开处冒出3~4个2 mm左右的根,20 d已有明显可见的根长出,而接种1/2MS+NAA 0.5mg/L培养基上丛生芽的芽体,未能长出根.
3 讨论
在薰衣草组织培养中,以叶片、茎段和顶芽为外植体的愈伤组织的诱导及增殖,顶芽诱导愈伤的效果最好,茎段和叶片次之.接种10 d后叶边缘、柄基部、茎段两端膨大明显,可见乳白色愈伤出现,但外植体褐化严重,叶片尤其易褐化发黑,达70%.因此开始培养的一周内光强度稍减弱,而且在相同成分培养基上转接1~2次,减小褐化率,30~35 d左右愈伤长势良好.张艳玲等[9]以孟士德薰衣草(Lavandula angustifolia‘Munstead’)叶片研究表明:以叶片为外植体全部褐化死亡,而Tsuro等[10]以薰衣草(Lavandula vela)子叶诱导愈伤组织获得较好的效果,这可能是由于子叶较叶片生长时间短,含精油量少,不宜褐化.或者,不同植物材料褐化程度也不一样[9].本实验结果表明:接种在同样的愈伤组织诱导培养基上的茎段和顶芽均能进行愈伤诱导,无褐化现象,这与张艳玲等[9]人的实验结果一致.这可能与茎段和顶芽内酚类物质少或氧化酶活性低有关.以MS+2,4-D 2.0mg/L+6-BA 2.0mg/L植物激素配比,出愈率较高.这与一些学者的结果相似.Calvo等[11]报道6-BA浓度以2.0 mg/L对愈伤组织的诱导及不定芽分化的效果最好.但也有报道[12],以2,4-D诱导薰衣草(Lavandula angustifolia)愈伤,再加6-BA,出芽困难,本实验也得到同样的结果.而刘珊等[6]以KT代替6-BA,也已获得较好的薰衣草芽分化.
用MS+6-BA 0.1mg/L培养基上以芽诱导腋芽,用MS+6-BA 0.5mg/L培养基上产生大量的丛生芽,在短时间内得到大量的有效芽,将这些芽用于生根培养,生根率达75%,得到狭叶薰衣草再生植株.
在狭叶薰衣草带叶顶芽离体培养中,由于外植体较大,很易污染,采用叶片消毒时,先用流水冲洗1.5~2.0 h,接种前再用0.1%升汞浸泡2 min时间,得到较好的效果,大大降低了污染.外植体消毒时间的长短,直接影响了组织培养的成功与失败,尤其对较幼嫩薰衣草的叶片,一定要掌握好叶片消毒的时间和方式[7].
已有文献报道[7,13],在生根培养中,一定范围内IAA浓度增加对根诱导和生长有增强的趋势.我们的实验采用了1/2MS+IBA 0.5mg/L,生根效果较好,而用1/2MS+NAA 0.5mg/L,未能诱导出根,但许耀祖等[12]利用MS+IAA 0.5 mg/L+NAA 0.1 mg/L+蔗糖15 g/L+活性炭1.0 g/L,做为1种宜于薰衣草生根的理想培养基,这可能与不同品种和所用外植体不同有关.再者,生长素对根、茎、叶的生长的影响以根最为敏感,薰衣草幼苗本身能够产生较多的生长素,故诱导生根仅需要很低浓度的生长素[7].表明单独用较高浓度NAA不利诱导生根培养.
[1]吴征镒.中国植物志[M].北京:科学出版社,1977:248.
[2]姚雷,张少艾.芳香植物[M].上海:上海教育出版社,2002:156-158.
[3]王有江,朱红霞.芳香花草[M].北京:中国林业出版社,2004:48-50.
[4]Sudria C,Pinol M T,Palazon J,et al.Influence of plant growth regulatorson the growth and essential oil content of cutured Lavandula dentate plantlets[J].Plant Cell,Tissue and Organ Culture,1999,58:177-184.
[5]黄珊珊,廖景平.狭叶薰衣草与羽叶薰衣草核型分析[J].园艺学报,2007,34(3):735-738.
[6]刘珊,陈全家,苏秀娟,等.英国薰衣草愈伤再生体系的建立[J].新疆农业科学,2010,47(1):73-76.
[7]苏秀娟,陈全家,马林,等.英国薰衣草叶片再生体系的建立[J].新疆农业大学学报,2006,29(2):22-25.
[8]Hu X R,Yang A F,Zhang K W,et al.Optimization of in vitro multiple shoot clump induction and plantlet regeneration of Kentucky bluegrass(Poa pratensis)[J].Plant Cell,Tissue and Organ Culture,2006,84(1):90-99.
[9]张艳玲,高远,王维鹏,等.孟士德薰衣草愈伤组织诱导和植株再生[J].上海交通大学学报,2008,26(1):25-28.
[10]Tsuro M,Koda M.Comparative effect of diferent types of cytokinin for shoot formation and plant regeneration from leaf-derived callus of lavender(Lavandula vera DC)[J].Scientia Horticultume,1999,81(3):331-336.
[11]Calvo M C,Segura J.In vitro propagation of lavender[J].HortScience,1989,24:375-376.
[12]许耀祖,王晓军,赵民安,等.薰衣草高频植株再生系统的建立[J].西南农业大学:自然科学版,2005,27(3):344-349.
[13]Tsuro M,Koda M,Inoue M.Efficient plant regeneration from multiple shoots formed in the leaf-derived callus of Lavandula vera,using th“eopen culture system”[J].Scientia Horticculture,2000,86(1):81-88.

