益肾调周法对卵巢早衰模型大鼠卵巢储备能力的影响
王 浩
(湖南中医药大学研究生院,湖南 长沙 410208)
卵巢功能早衰(premature ovarian failure, POF)是妇科的常见病之一,在一般人群中患病率为1%~3%,在40岁之前的发病率为1%,30岁之前为1‰,且发病率呈逐年上升的趋势[1]。POF不仅可直接导致患者不孕、月经稀发、最终闭经,并且病程中常常伴随着烦躁、抑郁、甚至敌对等情绪改变,同时内外生殖器官及第二性征逐渐萎缩及退化[2],并引起脂质代谢紊乱,诱发高脂血症、动脉硬化、冠状动脉粥样硬化性心脏病等。因此,POF的防治是当今生殖医学研究的重点及难点。女性生育功能主要体现在卵巢的储备能力上(ovarian reserve),所以如何准确预测卵巢储备能力,亦是防治POF的重要指标。本研究以付霞霏、何援利(2008年)建立的《化疗所致卵巢早衰动物模型的建立》为基础,旨在观察益肾调周法对卵巢储备能力的影响,探讨其量效关系及作用机理,为中药防治POF提供科学有效的思路和方法。
1 材料和方法
1.1 材料
1.1.1 动物 SPF级健康雌性8周龄SD大鼠135只,质量180 g士20 g,由河南省动物实验中心提供。动物合格证号:SCKx-(豫)2010-002。饲养室温控制在20~25℃,光照12 h,采用分笼架式喂养,标准饲料,饮水为自来水。
分组 将135只大鼠按质量分层随机(随机数字表法)分组,随机分为9组,即空白对照组(A)、模型对照组(B)、克龄蒙对照组(C)、滋肾填精汤高剂量组(D1)、滋肾填精汤低剂量组(D2)、温肾填精汤高剂量组(E1)、温肾填精汤低剂量组(E2)、益肾调周法高剂量组(F1)、益肾调周法低剂量组(F2),每组15只,分笼常规喂养。
1.1.2 实验药物 滋肾填精汤(熟地,黄精,女贞子,白芍,当归,淮山药,山茱萸,川芎,合欢皮,炙甘草),由河南中医学院药理实验室制备,采用乙醇回流提取法,调整至含生药2 g/mL。
温肾填精汤(菟丝子,淫羊藿,仙茅,桑寄生,川断,巴戟天,何首乌,黄精,合欢皮,杜仲,木香,炙甘草),由河南中医学院药理实验室制备,采用乙醇回流提取法,调整至含生药2 g/mL。
克龄蒙(Climen):拜耳医药保健有限公司,片剂,21片/盒。
1.1.3 主要试剂 环磷酰胺(Cyclophosphamid,CTX):山西普德药业有限公司,粉剂,200 mg/支。
大鼠雌二醇(E2)放免试剂盒,(上海劲马)。
大鼠促卵泡素(FSH)ELISA试剂盒,品牌:美国R&D。
大鼠抑制素B(INHB)ELISA检测试剂盒,品牌:美国R&D。
大鼠抗苗勒氏管激素(AMH)ELISA检测试剂盒,品牌:美国 DSL 。
1.2 给药方法
参照《动物与人体的每公斤体重剂量折算系数表》《实验动物学》及《中药新药药效学研究》,中药各组实验当日冷开水配置所需动物灌胃浓度,低剂量,高剂量分别相当于临床等效药量的2、4倍。空白对照组,模型对照组和各中药治疗组每日灌胃2次,空白组和模型对照组每日灌胃蒸馏水,克龄蒙对照组采用相当于临床等效药量的4倍,每日灌胃1次,连续灌胃20 d。
表1 益肾调周法对大鼠血清E2,FSH的影响(±s,n=10)
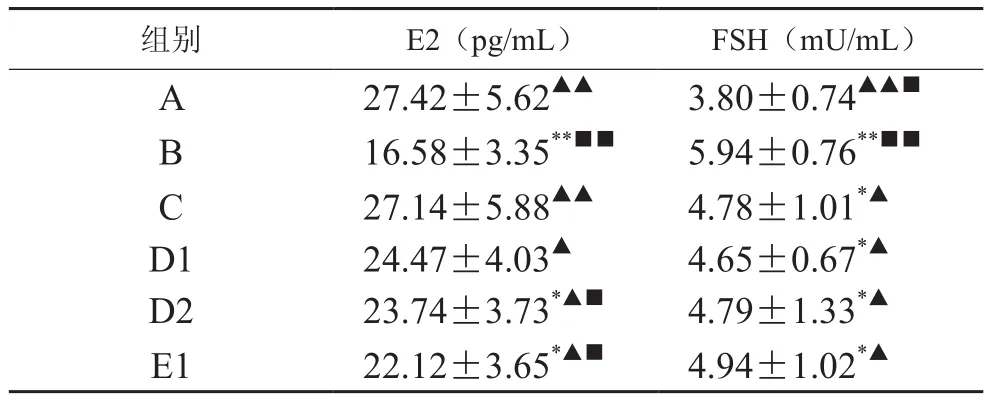
表1 益肾调周法对大鼠血清E2,FSH的影响(±s,n=10)
注:与A组比较,*P<0.05,**P<0.01;与B组比较,▲P<0.05,▲▲P<0.01;与C组比较,■P<0.05,■■P<0.01
组别 E2(pg/mL)FSH(mU/mL)A 27.42±5.62▲▲ 3.80±0.74▲▲■16.58±3.35**■■ 5.94±0.76**■■C 27.14±5.88▲▲ 4.78±1.01*▲D1 24.47±4.03▲ 4.65±0.67*▲D2 23.74±3.73*▲■ 4.79±1.33*▲E1 22.12±3.65*▲■ 4.94±1.02*▲B
1.2.1 一般情况的观察 每日早上8点测体重1次,观察一般生命体征、行为方式、进食状况的改变、毛色及精神状态的变化。
1.2.2 指标的检测 于实验末次给药后,各组大鼠禁食24 h,不禁水,用电子天平称重后,根据体重按随机数字表法各组随机抽取10只,断头采血2.0 mL,将所取血静置30 min,3000 r/min,离心20 min,取血清。采用放射免疫计数仪测定血清中E2值;用酶联免疫测定试剂盒,测定血清中FSH水平;采用双抗体夹心酶联免疫吸附技术 ;检测AMH,INHB测定各孔吸光度OD值,并通过酶标仪读数读出AMH、INHB 的浓度值。
1.2.3 卵巢早衰动物模型的建立
将分组动物连续阴道脱落细胞图片两个周期,有动情周期的大鼠纳入组内,其余排除,并绘制组内每只大鼠的详细动情周期表。模型复制依据文献《化疗所致卵巢早衰动物模型的建立》(付霞霏,何援利,2008年)记载:除空白对照组外,其余8组均使用环磷酰胺给予首次负荷剂量50 mg/kg后,以8 mg/(kg.d)的剂量连续腹腔注射14 d。空白对照组每天注射同容积生理盐水,共15 d。造模完成后称质量,并连续阴道脱落细胞涂片两个性周期。阴道角化细胞持续出现7~8 d(75%),无规律的动情周期变化,提示卵巢早衰大鼠模型制作成功。造模成功者,纳入组内继续实验,其余排除。
1.3 统计学分析
数据分析采用SPSS 18.0统计分析软件处理,计量资料所有数据以“±s”表示。考察各个实验组与空白组及模型组比较是否存在差异时使用Donnett-t检验;考察各个实验组两两之间比较是否存在统计学意义时使用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
表1的结果显示,其他各组血清雌二醇水平与空白组比较,滋肾高剂量组,温肾低剂量组,温肾高剂量组,差异有统计学意义(P<0.05),与空白组比较,模型组不仅存在统计学意义,并且差异有统计学意义(P<0.01);与模型组比较,克龄蒙组,滋肾高剂量组,温肾低剂量组,温肾高剂量组,益肾调周法低剂量组,差异有统计学意义(P<0.05),而空白组,益肾调周法高剂量组的差异显著(P<0.01);与克龄蒙组比较,滋肾高剂量组,温肾低剂量组,温肾高剂量组,差异有统计学意义(P<0.05),而模型组的差异显著(P<0.01)。
表2的结果显示,其他组血清FSH水平与空白组比较,克龄蒙组,滋肾低剂量组,滋肾高剂量组,温肾低剂量组,温肾高剂量组,益肾调周法低剂量组差异有统计学意义(P<0.05),模型组的差异显著(P<0.01);与模型组比较,滋肾低剂量,滋肾高剂量组,温肾低剂量组,温肾高剂量组,益肾调周法低剂量组差异有统计学意义(P<0.05),而空白组,克龄蒙组,温肾低剂量组,温肾高剂量组的差异显著(P<0.01);与克龄蒙组比较,空白组,益肾调周法高剂量组,差异有统计学意义(P<0.05),而模型组的差异显著(P<0.01)。
表2 益肾调周法对大鼠血清AMH,INHB的影响(±s,n=10)

表2 益肾调周法对大鼠血清AMH,INHB的影响(±s,n=10)
注:与A组比较,*P<0.05,**P<0.01;与B组比较,▲P<0.05,▲▲P<0.01;与C组比较,■P<0.05,■■P<0.01
组别 AMH(pmol/L)INHB(ng/L)A 2.51±0.13▲▲ 16.51±2.49▲1.67±0.13**■■ 13.28±3.61**■■C 2.46±0.16▲▲ 16.16±4.61▲D1 2.07±0.19*▲■ 16.66±3.55▲D2 2.14±0.17*▲ 16.99±1.93▲E1 2.12±0.17*▲ 18.86±2.48*▲■E2 2.09±0.19*▲■ 16.59±2.51▲F1 2.39±0.20▲ 16.15±2.82▲F2 2.56±0.10▲▲ 20.43±2.05**▲▲■■B
表2的结果显示,其他组血清AMH水平与空白组比较,滋肾低剂量组,滋肾高剂量组,温肾低剂量组,温肾高剂量组,差异有统计学意义(P<0.05),模型组的差异显著(P<0.01);与模型组比较,滋肾低剂量,滋肾高剂量组,温肾低剂量组,温肾高剂量组,益肾调周法低剂量组差异有统计学意义(P<0.05),而空白组,克龄梦组,益肾调周法高剂量组的差异显著(P<0.01);与克龄蒙组比较,滋肾低剂量组,温肾高剂量组差异有统计学意义(P<0.05),而模型组的差异显著(P<0.01)。
表2的结果显示,其他组血清INHB水平与空白组比较,温肾低剂量组,差异有统计学意义(P<0.05),模型组,益肾调周法高剂量组的差异显著(P<0.01);与模型组比较,空白组,克龄蒙组,滋肾低剂量,滋肾高剂量组,温肾高剂量组,而温肾低剂量组,益肾调周法低剂量组差异有统计学意义(P<0.05),益肾调周法高剂量组的差异显著(P<0.01);与克龄蒙组比较,温肾低剂量组差异有统计学意义(P<0.05),而模型组,益肾调周高剂量组的差异显著(P<0.01)。
3 讨论
3.1 评价卵巢储备能力的指标选择
卵巢早衰的发病与免疫、遗传、代谢及卵巢手术、放疗、化疗等诸多因素有关,而发病机制尚未明确,主要病理机制之一可能是卵巢储备能力的下降[3]。卵巢储备功能是指卵巢皮质区卵泡生长、发育,形成可受精的卵母细胞的能力。卵巢的衰老包括卵子和颗粒细胞的衰老,临床上诊断POF时很难直接对卵巢内存留的卵子数和卵子质量进行检测,因此通过与颗粒细胞生理功能相关的检查来反映卵巢的衰老程度以预测POF。近年来,年龄、基础雌二醇(E2)、基础抑制素B(INHB)水平、基础抗苗勒管激素(AMH)水平、FSH、FSH/LH、以及克罗米酚刺激实验、Gn-RH 刺激实验等相继被提出[4],但是,这些指标是否可以准确的预测卵巢的储备能力,仍处于研究中。
FSH是女性卵巢功能调节的重要激素,必须与卵巢颗粒细胞上的受体结合后,才能够激活颗粒细胞内的芳香化酶(P450arom),使雄激素芳香化并形成卵泡自身内的雌激素微环境[5]。INHB主要由卵巢颗粒细胞产生,是女性FSH分泌的重要调节因子,研究证明[6],INHB的分泌量与基础FSH呈负相关。当卵巢储备功能出现减退时,血清INHB先于 FSH而产生变化,因此有学者认为血清 INHB水平降低是女性卵泡减少、卵巢老化的最早标志[7]。另外,INHB能够特异作用于脑垂体细胞,通过旁分泌及自分泌方式发挥生物学效应,对促性腺激素释放激素(GnRH)诱导的 FSH 分泌有选择性的抑制作用,INHB可选择性抑制 FSH的产生,并且可以通过调节E2底物来调节E2的产生,因此,另有学者认为INHB可作为卵巢储备功能的直接指标,而垂体分泌FSH仅为间接指标[8]。由于INHB的变化是与E2同步,对FSH有负反馈作用, 所以认为INHB的变化启动了围绝经期女性生殖内分泌轴的一系列变化[9]。所以,可以考虑POF患者的生殖内分泌变化是否也符合这样的变化。AMH由卵巢生长卵泡的颗粒细胞分泌, 因而血清 AMH水平亦可作为预测卵巢储备功能的指标。La Marca等[10]认为AMH在整个月经周期呈相对稳定状态,这意味着临床上可以在月经周期的任一时期取血检测 AMH水平,这也成为 AMH 作为卵巢储备功能监测指标的优势之一。研究发现卵泡液AMH水平和小窦状卵泡雌二醇水平呈负相关关系,表明AMH生成和FSH活性之间存在着密切的相互依赖的调节关系[11],AMH和AMH-R基因的一般多态性促使窦状卵泡雌二醇生成并诱导卵泡生长加速,并且此种配体-受体复合体活性越低,FSH对卵泡发育和卵泡激素合成的作用越明显[12],因此,AMH可以调节卵巢对FSH敏感性[13]。因此本文选取了E2、FSH、AMH、INHB为评价指标,目的在于宏观评价益肾调周法对卵巢储备能力的影响。
3.2 疗效机制探讨
综合实验结果可知,对于激素水平的影响,益肾调周法高剂量组与克龄蒙治疗组的结果相当,高于单纯的滋肾添精方,温肾添精方和益肾调周法低剂量组;而对于AMH和INHB的影响,调周法高剂量组明显优于其他治疗组。益肾调周法一方面可以提高血清中E2水平,通过性腺轴反馈抑制垂体FSH的分泌合成,而且可以通过升高血清中INHB的含量,抑制垂体分泌FSH,另外,通过提高血清中AMH的含量,提高卵巢对FSH的反应,从而促进优势卵泡的生成,进而促进E2的分泌。总之,益肾调周法可以宏观的调整血清中FSH、E2、AMH、INHB的含量,增强卵巢的敏感性并改善卵巢的储备能力,其高剂量组的疗效显著。
[1]Beck Peccoz P,Persani L.Premature ovarian failure.[J].Orphanet J Rare Dis,2006,1:9 13.
[2]司徒仪主编.中西医结合妇产科学[M].北京:北京科学技术出版社,2003,155.
[3]Blum enfeld Z,A vivi I,Eckm an A,et al.Gonadotropin-releasing hormone agonistdecreases chemotherapy-induced gonadotoxicity and premature ovarian failure in young female patientswithHodgkin lymphoma[J].Fertil Steril,2008,89:166.
[4]Maheshwari A,Fowler P,Bhattacharya S.Assessment of ovarian reserve-should we perform tests of ovarian reserve routinely?[J].Hum Reprod,2006,21(11):2 729-2 735.
[5]De Castro F,Ruiz R,Montoro L,et al.Role of follicle stimulating-hormone receptor Ser680Asn polymorphism in the efficacy of folli clestimulating hormone[J].Fertil Steril,2003,80(3):571-576.
[6]Hall J E.Neuroendocrine changes with reproductive agingin women[J].Semin Reprod Med,2007,25(5):344.
[7]SHYR-Yeu Lin, John R Morrison, David J, et al. Regulation of ovarian function by the TGF-superfamily and follistatin[J].Reproduction,2003,126:133-148.
[8]SeiferDB, ScottRT, Bergh PA, et a.l Woman with declining ovarian reservemay demonstrate a decrease in day 3 serum inhibin B before a rise in day 3 follicl-stimulating hormone[J]. FertilSteri,l 1999, 72(1):63.
[9]Welt. Female reproductive aging ismarked by decreased secretion of dimeric inhibin[J]. Clin EndocrinolMetab, 1999,84(1):105.
[10]La Marca A, Stabile G, Tirelli A, et al. Anti - mullerian hormonemeasurement on any day of the menstrual cycle strongly predicts o-varian response in assisted reproductive technology[J].Hum Re-prod,2007,22(3):766-771.
[11]Andersen CY,ByskovAG.Estradiol and regulation ofantiMüllerian hormone, inhibin-A, and inhibin-B secretion: analysis of small antral and preovulatory human folliclesf'luid[J].J Clin EndocrinolMetab,2006, 91:4 064-4 069.
[12]KevenaarME,Themmen AP,Laven JS,et a.l Anti-Mü-llerian hormone and anti-Müllerian hormone type II receptor polymorphisms are associatedwith follicularphase estradiol levels in normo-ovulatory women[J]. Hum Reprod,2007, 22:1 547-1 554.
[13]张敏慧,丛晶者,李 威,等.抗苗勒管激素与卵巢功能[J].现代妇产科进展,2010,19(4):281-286.

