Bcl2-siRNA提高人肺腺癌细胞A549/DDP对顺铂敏感性的研究
张学林,余秉翔
解放军总医院 呼吸科,北京 100853
siRNA(small interfering RNA)是一种长约21-25bp的小RNA分子,由Dicer(RNAse Ⅲ家族中对双链RNA具有特异性的酶)加工而成,是RNA干扰(RNA interference,RNAi)途径中的中间产物,siRNA通过与一系列特异性蛋白质结合形成RNA诱导的沉默复合物(RISC),再由RISC切割靶mRNA最终导致翻译受阻,产生转录后基因沉默效应(PTGS)。在细胞内,siRNA能在低于反义核苷酸几个数量级的浓度下,使靶基因表达水平降低,甚至可达完全“敲除”的效果[1]。肺癌在我国的发病率与死亡率已居恶性肿瘤之首,其中非小细胞肺癌(non-small-cell lung cancer,NSCLC)占80%以上,其五年生存率仅8%-10%,65%患者诊断时已为晚期[2]。铂类药物联合其他化疗药物是治疗NSCLC的主要方案,但是多药耐药现象影响化疗疗效[3-4]。越来越多研究表明Bcl-2基因与肿瘤耐药关系密切。本研究以人肺腺癌顺铂耐药细胞A549/DDP及其亲本细胞A549为模型,通过siRNA降低肿瘤细胞中Bcl2 mRNA及蛋白的表达,进而增加A549/DDP细胞对顺铂的敏感性,为研究肺癌顺铂耐药提供依据。
材料和方法
1 试剂与仪器 注射用顺铂(冻干型)为齐鲁制药产品;jetPRIME转染试剂购于PolyPlus-transfection公司;Cell Counting Kit-8(CCK-8)购自DOJINDO公司;TRI Reagent购自Sigma公司;反转录试剂盒购于Promega 公司;荧光PCR试剂购于TaKaRa公司;Bcl-2、GAPDH抗体购于Santa Cruz公司。siRNA由上海吉玛公司合成(Negative Control RNA序 列 为 :5'-UUCUCCGAACGUGUCACGUTT-3',5'-ACGUGACACGUUCGGAGAATT-3'。siBcl-2序 列[5]为 :5'-UGUGGAUGACUGAGUACCUGAdTdT-3',5'-UCAGGUACUCAGUCAUCCACAdTdT-3'); 其 余试剂均为进口分装或国产分析纯。Mx3000p荧光实时定量PCR仪由Stratagene生产;MS酶标仪由芬兰Labsystems生产。
2 细胞株培养 人肺腺癌顺铂耐药细胞株A549/DDP及其亲本细胞株A549(ATCC)购于中国医学科学院肿瘤研究所。细胞用RPMI-1640培养液加含10%胎牛血清(Hyclone)和100U/ml青霉素、100μg/ml链霉素,于37℃、5% CO2孵箱中孵育。为保持A549/DDP细胞耐药性,在新鲜配置的含1μg/ml顺铂培养液中培养,常规消化、传代。实验前2d,A549/DDP细胞培养液换为不含顺铂培养液。
3 测定A549/DDP耐药系数 取对数生长期的A549/DDP细胞和A549细胞铺于96孔板,每孔3.0×103个细胞,16h后换为含不同浓度顺铂的培养液,A549培养液顺铂浓度为(0、0.5、1、1.5、2、3μg/ml),A549/DDP培养液顺铂浓度为(0、3、6、9、12、15μg/ml),每个浓度5个复孔。药物作用48h后,换为新鲜配置的含10% CCK-8液的培养液100μl,置孵箱继续培养,1h后用多功能酶标仪于450nm波长下检测每孔吸光度值(A)。按公式计算每个浓度的顺铂对细胞生长的抑制率(IR):IR(%)=(1-Ai/A0)×100%(Ai为各浓度顺铂组的平均吸光值,A0为不加顺铂组的平均吸光值)。并计算顺铂对细胞的半数抑制浓度(IC50)。耐药系数RI=IC50A549/DDP/IC50A549。实验重复3次,取平均值。
4 转染 取对数生长期A549/DDP细胞接种于6孔板,每孔1.0×105个细胞,接种16h后采用jetPRIME转染试剂,按说明书进行转染。每孔转染双链RNA终浓度为20nmol/L。转染24h后换为不含顺铂的正常培养液。实验分阴性对照组(NC组)和转染siBcl-2组。
5 Real time RT-PCR检测Bcl-2 mRNA的表达水平总RNA的提取采用TRI Reagent法,按照说明书进行。总RNA提取后逆转录为cDNA,按照说明书操作。以GAPDH为内参照扩增Bcl-2基因。GAPDH上 游 引 物:5'-TCAGTGGTGGACCTGACCTG-3', 下 游 引 物:5'-TGCTGTAGCCAAATTCGTTG-3'。Bcl-2上 游 引 物:5'-GGATGCCTTTGTGGAACTGT-3', 下 游 引 物:5'-AGCCTGCAGCTTTGTTTCAT-3'。用2-ΔΔCt方法处理实时定量数据,计算Bcl-2 mRNA的表达差异。实验重复3次,取平均值。
6 细胞凋亡检测 细胞转染32h后,接种于96孔板,每孔3.0×103个细胞,接种16h后换为新鲜配置的含不同浓度顺铂的培养液(0、3、6、9、12、15μg/ml),药物作用48h后,按方法3测吸光度A值,并计算两组的IC50值,比较转染siBcl-2后A549/DDP对顺铂敏感性的变化。实验重复3次,取平均值。
7 Western Blot检测Bcl-2蛋白的表达 用RIPA裂解液收集转染后细胞,BCA蛋白定量试剂盒测定蛋白浓度后,利用10%的SDS-PAGE胶进行分离等量蛋白,然后转膜、封闭,加入1∶1 000稀释的兔抗人Bcl-2单克隆抗体,以及1∶5 000稀释的二抗。最后加入发光试剂,曝光、显影。以GAPDH为内参照。
8 统计学分析 采用SPSS17.0统计软件进行数据处理,计量数据以-x±s表示,两组独立样本采用t检验,以P<0.05为差异有统计学意义。
结 果
1 A549/DDP细胞耐药系数测定 加药48h后,顺铂(DDP)对A549及A549/DDP细胞的增殖均有抑制作用(图1、2)。顺铂对A549细胞的IC50值为(1.68±0.26)μg/ml,对A549/DDP细胞的IC50值为(10.92±1.15)μg/ml,A549/DDP细胞的耐药系数为6.49(P<0.05)(图3)。
2 Bcl-2 mRNA及蛋白在A549及A549/DDP细胞中的差异表达 提取细胞中RNA后,通过逆转录及Real time RT-PCR检测Bcl-2 mRNA的表达。Bcl-2 mRNA在A549/DDP细胞中的表达水平是A549细胞的3.77±0.56倍(P<0.05)(图4)。收集6孔板中A549及A549/DDP细胞,以GAPDH为内参照,检测两者之间Bcl-2蛋白的差异,由图5示,A549/DDP细胞中Bcl-2蛋白表达明显高于A549细胞。
3 siBcl-2的干涉效果 在A549/DDP细胞中转染双链RNA 48h后,siBcl-2组同NC组相比,Bcl-2 mRNA表达水平降低了92.6%(P<0.05)(图6),其蛋白表达也明显降低(图7),几乎达到“敲出”该基因的效果,说明其干涉效果良好。
4 转染siBcl-2后A549/DDP对顺铂的敏感性 在A549/DDP细胞中转染RNA后,siBcl-2组顺铂的IC50值为(4.83±0.76)μg/ml;NC组顺铂的IC50值为(11.47±1.02)μg/ml;敏感性提高了57.8%(P<0.05)(图 8、9)。

图 1 顺铂对A549细胞的抑制率 图 2 顺铂对A549/DDP细胞的抑制率 图 3 顺铂对A549及A549/DDP细胞的IC50值Fig 1 Cisplatin-inhibiting rate for A549 cells Fig 2 Cisplatin-inhibiting rate for A549/DDP cell Fig 3 IC50 value of cisplatin for A549 and A549/DDP cells

图 4 Bcl-2 mRNA在A549及A549/ 图 5 Bcl-2 蛋白在A549及A549/DDP 图 6 转染后A549/DDP细胞中Bcl-2 mRNA DDP细胞中的表达 细胞中的表达 的表达Fig 4 Expression of Bcl-2 mRNA in A549 and A549/DDP cells Fig 5 Expression of Bcl-2 protein in A549(1) and A549/DDP(2)cells 1: The protein level in A549 cells; 2: The protein level in A549/DDP cells Fig 6 Expression of Bcl-2 mRNA in A549/DDP cells after transfection NC: The Bcl-2 mRNA level in A549/DDP cells after transfection of negative control RNA; siBcl-2: The Bcl-2 mRNA level in A549/DDP cells after transfection of siBcl-2 RNA
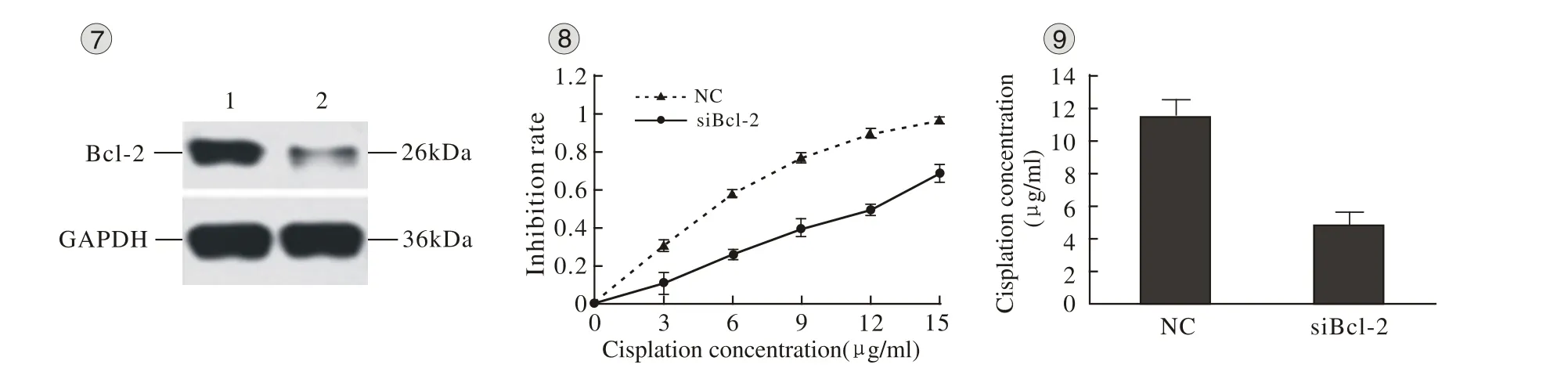
图 7 转染后Bcl-2 蛋白在A549/DDP 图 8 转染后顺铂对A549/DDP细胞 图 9 转染后顺铂对A549/DDP细胞的IC50值细胞中的表达 的抑制率Fig 7 Expression of Bcl-2 protein in A549/DDP cells after transfection 1: The protein level in A549/DDP cells after transfetion of negative control RNA; 2: The protein level in A549/DDP cells after transfetion of siBcl-2 RNA Fig 8 Cisplatin-inhibiting rate for A549/DDP cells after transfection NC: The inhibition rate after transfection of negative control RNA; siBcl-2: The inhibition rate after transfection of siBcl-2 RNA Fig 9 IC50 value of cisplatin for A549/DDP cells after transfection NC: The IC50 value after transfection of negative control RNA; siBcl-2: The IC50 value after transfection of siBcl-2 RNA
讨 论
肺癌耐药的机制十分复杂,至今仍未完全阐明,有多种基因参与此过程,其中Bcl-2基因在肿瘤的发生发展中起重要作用[6]。Bcl-2(B-cell lymphoma/leukemia-2,B细胞淋巴瘤/白血病)基因,是1984年Jsujimoto等在研究B细胞滤泡性淋巴瘤中分离出来的一种原癌基因。正常的Bcl-2基因定位于染色体18q1.3上,大小约230kb。该基因编码26×103kDa大小的蛋白,位于线粒体膜、滑面内质网和核膜上。该基因能抑制诸如抗肿瘤药等凋亡信号引起的细胞凋亡[7]。有数据显示,Bcl-2基因的高表达导致多种肿瘤对化疗药物耐药[8]。Bcl-2不阻止药物进入细胞,不抑制药物引起的DNA损伤,也不改变细胞对DNA的修复速率和细胞周期动力学,该基因导致耐药的机制主要是通过抑制肿瘤细胞的凋亡途径实现的[9]。
有报道,Bcl-2基因的高表达与子宫内膜癌等多种肿瘤对化疗药物的耐药有关[10]。Bcl-2低表达的卵巢癌对化疗反应良好[11]。戴明等[12]发现人肺腺癌细胞紫杉醇耐药与Bcl-2高表达有关。但是也有报道称Bcl-2的低表达与乳腺癌细胞MCF-7多西他赛耐药有关[13]。
本研究中我们以人肺腺癌顺铂耐药细胞A549/DDP及其亲本细胞A549为模型,发现A549/DDP中Bcl-2 mRNA表达的表达量为A549的3.77±0.56倍,其蛋白表达量也明显升高。通过在A549/DDP细胞转染Bcl2-siRNA,使Bcl-2 mRNA及蛋白在细胞中的表达明显降低,从而使顺铂对A549/DDP细胞的半数抑制浓度IC50由(11.47±1.02)μg/ml下降到(4.83±0.76)μg/ml,大大提高A549/DDP细胞对顺铂的敏感性。说明Bcl-2基因的表达与肺癌耐药关系密切,同时,本研究也证实了Bcl2-siRNA对于逆转肺腺癌顺铂耐药具有确切的作用,为肺癌耐药这一难题的攻克提供理论依据。
1 Brummelkamp TR,Bernards R,Agami R. A system for stable expression of short interfering RNAs in mammalian cells[J].Science,2002,296(5567):550-553.
2 马春燕,宋勇. EGFR-TKI治疗非小细胞肺癌的问题与对策[J].药学与临床研究,2010,18(2):112-117.
3 Jemal A,Siegel R,Xu J,et al. Cancer statistics,2010[J]. CA Cancer J Clin,2010,60(5):277-300.
4 Lage H. An overview of cancer multidrug resistance:a still unsolved problem[J]. Cell Mol Life Sci,2008,65(20):3145-3167.
5 Cao N,Cheng D,Zou S,et al. The synergistic effect of hierarchical assemblies of siRNA and chemotherapeutic drugs co-delivered into hepatic cancer cells[J]. Biomaterials,2011,32(8):2222-2232.
6 Stavrovskaya AA. Cellular mechanisms of multidrug resistance of tumor cells[J]. Biochemistry(Mosc),2000,65(1):95-106.
7 刘畅,张杰. BcL2与妇科肿瘤的关系[J]. 中国冶金工业医学杂志,2006,23(5):552-554.
8 Dive C. Avoidance of apoptosis as a mechanism of drug resistance[J].J Intern Med Suppl,1997,740:139-145.
9 杨娜,韩玲. 白细胞介素2(IL-2)和白细胞介素12(IL-12)对肺腺癌细胞作用机制的研究[J]. 吉林医学,2007,28(5):603-606.
10 胡海燕,陆琳,郭红波,等. Bcl2-siRNA 上调子宫内膜癌细胞放疗敏感性的研究[J]. 实用医学杂志,2010,26(15):2688-2689.
11 钟雪云,陈运贤,林华欢,等. 卵巢上皮癌bcl-2,p53基因与多药耐药的相关研究[J].实用肿瘤学杂志,2000,14(2):82-84.
12 戴明,罗荣城,钟华成,等. 紫杉醇耐药人肺腺癌细胞系的建立及生物学活性[J]. 实用医学杂志,2007,23(18):2826-2829.
13 Kastl L,Brown I,Schofield AC. miRNA-34a is associated with docetaxel resistance in human breast cancer cells[J]. Breast Cancer Res Treat,2012,131(2):445-454.

