纤维连接蛋白C端肝素结合域多肽在毕赤酵母中的表达、纯化及鉴定
陈小芳,陈显凌,邹起练,吴勇,陈元仲
1 福建省血液病研究所 福建医科大学附属协和医院血液科,福建 福州 350001
2 福建医科大学 基础医学院细胞生物学与遗传学系,福建 福州 350004
生物技术与方法
纤维连接蛋白C端肝素结合域多肽在毕赤酵母中的表达、纯化及鉴定
陈小芳1,陈显凌1,邹起练2,吴勇1,陈元仲1
1 福建省血液病研究所 福建医科大学附属协和医院血液科,福建 福州 350001
2 福建医科大学 基础医学院细胞生物学与遗传学系,福建 福州 350004
为在毕赤酵母中表达纤维连接蛋白 C端肝素结合域 (Fibronectin C-terminal heparin-binding domain FNCHBD) 多肽并研究其功能,通过PCR技术扩增FNCHBD目的基因,将目的基因与T载体连接,经测序正确后,插入pAo815SM酵母表达载体增加基因拷贝数,然后酶切克隆入酵母表达载pPIC9K;将重组质粒SalI酶切线性化后转化毕赤酵母菌株,筛选工程菌,经甲醇诱导表达,用 SDS-PAGE检测发酵上清液,表明有重组蛋白FNCHBD多肽的高表达,表达产物通过离心、超滤、离子交换层析纯化,纯化产物通过SDS-PAGE、Western blotting印迹、质谱及肝素亲和层沉析对表达产物进行鉴定。结果表明利用酵母工程菌成功表达和纯化了FNCHBD多肽,多肽的分子量接近32 kDa,纯化产物的纯度可达95%以上,能被FN多克隆抗体特异识别且具有多肽肝素结合活性,为后续结构及功能的研究奠定基础。
纤维连接蛋白,肝素结合域,毕赤酵母,表达纯化
Abstract:To express and identify fibronectin C-terminal heparin-binding domain (FNCH BD) polypeptides inPichia pastorisexpression system and study its function, the fragment of FNCHBD was amplified by PCR and inserted into pGEM-T vector. After sequenced, the fragment was inserted into pAo815SM vector, and then cloned into the expression vector pPIC9k. The recombinant plasmid was linerarized with restrict enzymeSalI and transferred into the yeast host cell KM71 and GS115. The positive yeast clone was screened by G418 resistant, and the target protein was induced to express in the medium containing 0.5% methano1. The culture supernatant was collected and then was purified with membrane ultrafiltration and ion exchange chromatography. The purified product was analyzed with mass spectrogram, SDS-PAGE,Western blotting and heparin affinity chromatography. The results showed that the target protein was around 32 kDa and the purity of the product was above 95%. FNCHBD could be specifically recognized by fibronectin polyclonal antibody. These results suggest that FNCHBD could be expressed and purified successfully inPichia pastoris, which provides a good strategy to further studies.
Keywords:fibronectin, heparin-binding domain,Pichia pastoris, expression and purification
纤维连接蛋白 (Fibronectin,FN) 是一个多功能的糖蛋白,参与多种细胞的黏附、扩展、迁移、分化、增殖及存活[1-3],因此它在胚胎发育[4]、组织修复[5]、基质聚集[6]、肿瘤转移[7-8]、抗感染[9]、出血及血栓[10]、肌肉再生[11]等方面都发挥了重要作用。FN是由两个相同单体通过二硫键连接组成的二聚体,每个单体由3种类型 (Ⅰ、Ⅱ、Ⅲ型) 的结构域重复不同次数构成。FN的结构中含有各种生物大分子的结合位点,包括成纤维细胞、巨噬细胞、中性粒细胞、细菌、胶原、肝素等,因此形成了多种功能结构域,其中包含2个肝素结合域[12-13],一个位于FN的N端,由第1~5五个Ⅰ型的同源结构组成,与肝素的结合力较弱,另一个位于FN的C端,由第12~14三个Ⅲ型的同源结构组成,与肝素的结合力较强[12]。血浆FN在抑制肿瘤迁移、抗感染及损伤修复等方面的作用已经得到了广泛的肯定。但从血浆分离FN存在着血浆资源的浪费及可能传播血源性传染病的问题,同时由于FN分子量大,表达全长 FN分子又存在技术上的难题,因此表达 FN的功能区多肽并研究其功能是较为可行的方法。我们前期研究已合成了FN N端的肝素结合域多肽,动物实验研究表明其具有抗小鼠败血症及大鼠DIC的作用[14-15]。目前国际上对FN C端的肝素结合域的生物学功能有了较深入的研究,如促进细胞粘附[16-17]、促进血管内皮生长因子的活性[18]、促进血管的生成[19]、调节细胞的凋亡[20]、抗感染[21]等;但表达FN C端的肝素结合域多肽目前国内外还未见报道。FN C端的肝素结合域含 272个氨基酸 (Tyr1720-Gly1991),编码该多肽的DNA序列从5 428 bp~6 244 bp,长816 bp,本实验成功地通过酵母表达系统表达FN C端的肝素结合域多肽并进行鉴定,为进一步研究结构及功能奠定基础。
1 材料与方法
1.1 材料
FN cDNA、大肠杆菌 DH5α由本实验室保存,pGEM-T TA克隆试剂盒、酵母表达系统 (包括表达载体及酵母菌株及培养基) 购自Invitrogen公司,pAo815SM 载体由厦门特宝公司提供,PrimeSTART HSDNA聚合酶、pfuDNA聚合酶购自TaKaRa公司;pUC8、pUC18 DNA Marker、EcoRⅠ、BamHⅠ、XhoⅠ内切酶、T4 DNA连接酶为 Promega公司产品;低分子量标准蛋白质Marker LMW购自GE公司;质粒DNA提取试剂盒、DNA凝胶回收试剂盒购自 Qiagen公司,兔抗人FN多克隆抗体、羊抗兔IgG购自Sigma公司产品;1 mL的肝素亲和层析预装柱HiTrap Heparin HP购自GE公司;其他试剂为国产或进口分析纯产品。
1.2 目的基因的 PCR扩增和 pGEM-TFNCHBD载体的构建
以本实验室所保存的FNcDNA为模板,设计特异性引物 (M1、M2,↓箭头表示酶切位点,下划线表示KEX2信号肽水解位点),具体序列见表1,通过PCR扩增FNCHBD基因片段,PCR扩增产物长855 bp。PCR扩增产物胶回收后经末端加A,连接至 pGEM-T载体上,连接产物转染大肠杆菌DH5α感受态细胞,通过氨苄青霉素抗性和蓝白筛选挑白色克隆进行扩增,提取质粒进行 PCR和XhoⅠ、EcoRⅠ双酶切鉴定后进行DNA测序。

表1 引物DNA序列Table 1 DNA sequence of primers
1.3 重组pAo815SM-FNCHBD质粒的构建
为增加目的基因的拷贝数,将测序正确的重组pGEM-T-FNCHBD质粒由XhoⅠ和EcoRⅠ双酶切后回收目的 DNA,然后克隆入用同样酶切处理的 pAo815SM 载体上,构建质粒pAo815SM-FNCHBD,转化大肠杆菌DH5α感受态细胞中,转化菌涂布于含100 μg/mL氨苄青霉素 (Amp) 的低盐 LB固体培养基平板上。挑选单个菌斑扩增,提取质粒酶切鉴定。
1.4 重组pPIC9K-FNCHBD表达载体的构建
将鉴定正确的重组 pAo815SM-FNCHBD质粒由EcoRⅠ和BamHⅠ双酶切后胶回收目的基因,然后克隆到用同样酶切的 pPIC9K载体上,重组pPIC9K-FNCHBD载体转化大肠杆菌DH5α感受态细胞。挑单菌斑扩增,提质粒酶切鉴定。
1.5 FNCHBD多肽在酵母细胞中的表达
1.5.1 FNCHBD多肽在酵母细胞GS115中的表达
SalⅠ酶切线性化重组 pPIC9K-FNCHBD质粒 (pPIC9K-FNCHBD/SalⅠ)。线性化质粒转染GS115,转染的GS115细胞涂布RDB平板上,28 ℃培养96 h,收取RDB平板上的菌落,涂于浓度分别为1~4 g/L的G418-YPD平板上,挑取4 g/L G418-YPD平板上的菌落分别接种至5 mL YPD液体培养基中,28 ℃、250 r/min 振摇24 h后转接于装有30 mL含0.25%甲醇的BMGY培养基,28 ℃、250 r/min振荡培养,每12 h添加甲醇至浓度为0.25%,48 h后发酵液经4 ℃、离心 30 min (10 000 r/min),留取上清,进行SDS-PAGE电泳。
1.5.2 FNCHBD多肽在酵母细胞KM71中的表达
线性化质粒转染 KM71酵母细胞,转染的KM71细胞涂布于RDB平板上,28 ℃培养120 h,收取RDB平板上的菌落,涂于浓度分别为1~4 g/L的G418-YPD平板上,挑取4 g/L G418-YPD平板上的菌落分别接种至5 mL YPD液体培养基中,28 ℃、250 r/min振摇24 h后转接于装有含0.25%甲醇的30 mL BMGY培养基,28 ℃、250 r/min振荡培养,每12 h添加甲醇至浓度为0.25%,诱导表达72 h后发酵液经4 ℃、10 000 r/min离心30 min,留取上清,进行SDS-PAGE电泳。
1.6 FNCHBD多肽的纯化
挑选表达较好的 KM71-FNCHBD菌株接种于300 mL BMGY培养基扩大发酵,诱导表达条件同上,72 h后发酵液经4 ℃、10 000 r/min离心30 min,收集上清,上清用10 kDa、容积为300 mL的中空纤维膜超滤浓缩后至1/10体积后用5 L 10 mmol/L Tris-HCl (pH 8.0) 的缓冲液置换,然再过用50 mmol/L Tris-HCl (pH 8.0) 预平衡过的 CM Sepharose FF离子交换柱纯化,用50 mmol/L Tris HCl、350 mmol/L NaCl的洗脱液(pH 8.0) 洗脱,监测 UV280的波形,收集含目的蛋白的洗脱液经SDS-PAGE电泳检测,初步纯化的样品进一步经Sephacryl S-100HR分离纯化,纯化产物SDS-PAGE电泳检测产物的纯度。
1.7 FNCHBD的鉴定和活性分析
1.7.1 通过质谱分析测定多肽的分子量
将纯化的 FNCHBD多肽产物经质谱仪测定多肽的分子量及纯度。
1.7.2 Western blotting方法鉴定多肽的抗原性
按 Western blotting常规方法制胶,将过HiTrap Heparin HP柱子的样品经SDS-PAGE电泳后,350 mA稳流1 h转移到硝酸纤维膜上,用封闭液 (5%的封闭蛋白的 0.01 mol/L,pH 7.4 PBS,0.05%Tween20) 室温作用1.5 h后加一抗(兔抗人FN多克隆抗体1∶500) 4 ℃包被过夜,TBS漂洗3次,每次5 min,加二抗 (羊抗兔lgG 1∶5 000),室温摇1.5 h后TBS漂洗3次,加AB工作液 (1∶1) 后X光片爆光5 min,显影,定影。
1.7.3 FNCHBD多肽的肝素亲和活性鉴定
将 FNCHBD的酵母发酵液上清过用10 mmol/L的 PBS (pH 7.0) 预平衡后 1 mL的HiTrap Heparin HP柱子,用10 mmol/L的PBS、500 mmol/L的NaCl (pH 7.0) 洗脱,监测UV280的波形,收集活性峰,小量处理样品进行SDS-PAGE分析。
2 结果
2.1 FNCHBD多肽基因的克隆和T载体的构建
以本实验室保存的 FNcDNA为模板进行PCR扩增,2%琼脂糖凝胶电泳检测,可见FNCHBD多肽基因的扩增产物在700 bp的上方有特异性条带,片段大小与预计的 855 bp相符(图1)。回收的PCR产物与T载体连接,重组质粒经XhoⅠ和EcoRⅠ双酶切鉴定正确后,经测序表明插入的 FNCHBD多肽基因与基因库中的完全相符。
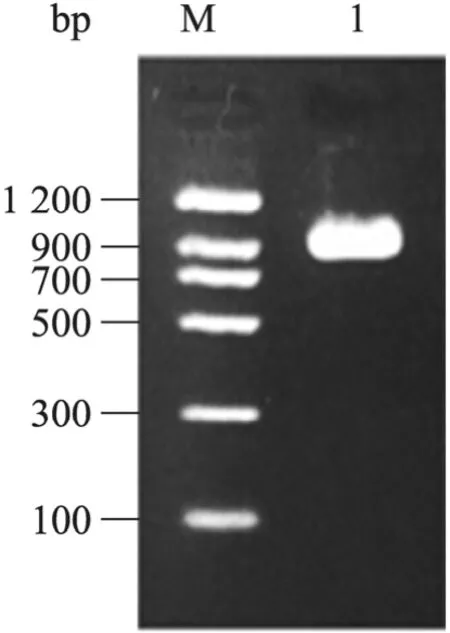
图1 FNCHBD基因的PCR扩增Fig.1 PCR product of FNCHBD. M: DNA marker; 1:FNCHBD.
2.2 酵母表达载体的构建
XhoⅠ和EcoRⅠ双酶切 pGEM-T-FNCHBD载体,酶切目的片段,回收后与pAo815SM连接,转化大肠杆菌DH5α感受态细胞,挑选平板上的抗性菌落,提取质粒进行EcoRⅠ和XhoⅠ双酶切鉴定,构建的 pAo815SM-FNCHBD载体经EcoRⅠ和BamHⅠ双酶切,酶切目的片段与pPIC9K酵母表达载体连接,连接产物转化大肠杆菌DH5α感受态细胞,挑选平板上的抗性菌落,扩增后提取质粒进行EcoRⅠ和BamHⅠ双酶切鉴定,所切下的片段与预期结果相符 (图2),说明成功构建pPIC9K-FNCHBD表达载体。
2.3 FNCHBD多肽在酵母细胞中的表达
将4 g/L G418-YPD平板上的挑选的GS115
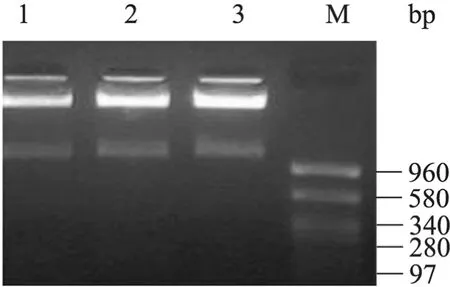
图2 重组质粒pPIC9K-FNCHBD的酶切鉴定Fig.2 Identification of recombinant plasmid pPIC9KFNCHBD by enzyme digestion. M: pUC18 DNA marker;1−3: pPIC9K-FNCHBD digested withEcoR Ⅰ andBamHⅠ.
和KM71酵母细胞,经上述诱导表达后,发酵液均经4 ℃离心后取上清进行 SDS-PAGE电泳,可见KM71菌株在30 kDa的上方出现明显的条带,与预计结果相符,且表达的杂蛋白的本底较低 (图3),因此选用阳性的KM71菌株作为扩大规模发酵的表达菌株。
2.4 FNCHBD多肽的纯化
阳性 KM71菌株的发酵上清经过超滤使蛋白得到浓缩,同时去掉一些小分子的杂蛋白,然后通过CM柱进一步富集目的蛋白,使蛋白得到初步纯化,最后通过S100柱分离出目的蛋白从而得到较纯的蛋白,SDS-PAGE电泳可见到大小约32 kDa的目的多肽条带 (图4)。
2.5 FNCHBD鉴定和活性分析
将纯化后的FNCHB多肽通过质谱分析,确定其分子量为31.051 kDa,与用PROSIS软件分析的理论预计值相符 (图5),证明所得到的多肽为目的蛋白,纯化后样品的纯度>95%,为今后的结构和功能研究奠定基础。Western blotting法显示在与SDS-PAGE的FNCHBD条带相应的位置出现清晰的条带 (图6),表明FNCHBD多肽可与FN的多克隆抗体结合,具有免疫原性,同时也进一步证明了所表达纯化的多肽是目的多肽。FNCHBD少量发酵上清过 1 mL的 HiTrap Heparin HP柱子,洗脱时监测 UV280的波形(图 7),出峰时收集的样品行SDS-PAGE电泳可目的蛋白条带 (图8)。表明通过FNCBHD多肽具有肝素结合活性,能够通过肝素亲和层析纯化。

图3 表达产物FNCHBD多肽的SDS-PAGE分析Fig.3 SDS-PAGE analysis of the expressed FNCHBD. M: low molecular protein marker LMW; 1−10: supernatant liquid of GSll5/pPIC9K-FNCHBD; a−g: supernatant liquid of KM71/pPIC9K-FNCHBD.
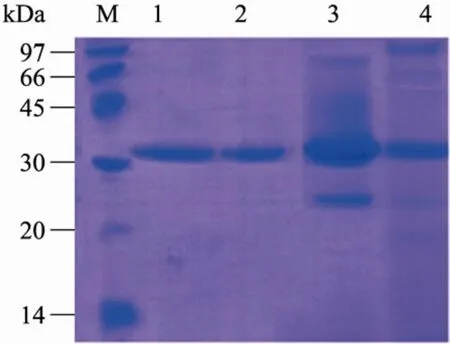
图4 FNCHBD多肽纯化过程的SDS-PAGE分析Fig.4 SDS-PAGE analysis of samples collected at different stages of FNCHBD purification. M: Low molecular protein marker (LMW); 1, 2: fraction eluted from Sephacryl S-100HR; 3: fraction eluted from CM Sepharose FF; 4: dialyzed supematant of KM71/pPlC9K-FNCHBD.

图5 纯化的FNCHBD多肽的质谱图Fig.5 MS of recombinant FNCHBD.

图6 纯化的FNCHBD多肽的SDS-PAGE和Western blotting分析Fig.6 SDS-PAGE and Western blotting analysis of purified FNCHBD. M: low molecular protein marker(LMW); 1: SDS-PAGE analysis of purifed FNCHBD;2: Western blotting analysis of purified FNCHBD.
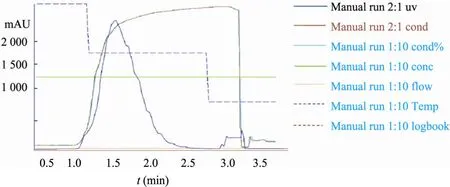
图7 FNCHBD发酵液上清的肝素亲和层析图Fig.7 Diagram of heparin affinity chromatography of supernatant liquid of KM71/pPIC9K-FNCHBD.

图8 肝素亲和层析产物的SDS-PAGE分析Fig.8 SDS-PAGE analysis of fraction eluted from HiTrap Heparin HP. M: low molecular protein marker(LMW); 1: fraction eluted from HiTrap Heparin HP.
3 讨论
酵母是一种低等真核生物,既具有类似原核生物的生长特性,又具有一般真核生物的分子和细胞生物学特性。酵母作为基因工程的表达系统,无细菌细胞壁的热原问题,也不必考虑动物细胞中可能含有原癌基因及病毒DNA等影响,其中毕赤酵母因具备良好的发酵与分泌性能尤其引人注目。毕赤酵母作为甲醇营养型酵母,该表达系统使用的乙醇氧化酶基因 (AOXl) 启动子为强诱导启动子,在AOXl启动子控制下的外源基因表达水平高且便于调控,重组株可按需要在诱导前高密度生长,加入甲醇诱导后能高水平表达,表达外源蛋白基因遗传稳定,具有糖基化、酰基化、蛋白磷酸化等翻译后修饰加工功能,使生产的蛋白具有天然的高级结构及生物学活性;发酵工艺成熟,易放大,产物易纯化,所用发酵培养基十分廉价,一般碳源为甘油或葡萄糖及甲醇,其余为无机盐,成本远低于昆虫和哺乳动物表达系统。因此,将外源基因整合于毕赤酵母染色体上,蛋白表达含量高、表达产物生物学活性好、背景蛋白质少、操作简便及易于工业化生产[22-23]。近年来毕赤酵母表达系统应用的范围越来越广泛,人们已经用毕赤酵母表达体系成功表达了500多种蛋白[24],包括疫苗、激素、干扰素、抗菌肽、酶、膜受体蛋白、细菌毒素及其衍生物等。因此本文尝试用该系统进行FN C端肝素结合域 (FNCHBD) 多肽的表达研究并取得了成功。
在本研究中,我们将 FNCHBD基因插入T载体上通过转化大肠杆菌抽提质粒,使目的基因进一步扩增及易于酶切获得粘性末端,然后通过pAo815SM中间载体增加目的基因的拷贝数,最后将目的基因插入 pPIC9K酵母表达载体α-factor信号肽的下游,构建成FNCHBD基因的重组酵母表达载体pPIC9K-FNCHBD,转化酵母细胞GS115和KM71,获得阳性重组菌株。由于pPIC9K质粒所带Kanamycin抗性基因在酵母中表现为抗G418的抗性,利用这一点可以用来筛选多拷贝的菌株,因此本实验通过将初步筛选的阳性酵母菌株再涂布于浓度分别为 1~4 g/L的G418-YPD平板上,在4 g/L的G418-YPD平板上筛选出高拷贝数的菌株。由于目的基因插入到α-factor信号肽的下游,因此在甲醇的诱导下,目的基因表达产物分泌于酵母培养上清液中,由于在目的基因中引入的KEX2蛋白酶的酶切点,减少了额外氨基酸的加入。表达产物通过SDS-PAGE检测发现其分子量与prosis软件分析的预计值相符,且KM71阳性菌株中目的蛋白的表达量较高且背景蛋白较少,因此选用KM71阳性菌株作为我们下一步实验的菌株。经扩大规模发酵后,发酵液离心后所得的上清经过超虑使蛋白得到浓缩,同时去掉一些小分子的杂蛋白,然后通过CM离子交换柱进一步富集目的蛋白,使目的蛋白得到初步纯化,最后通过S100离子交换柱分离出目的蛋白从而得到较纯的蛋白,通过SDS-PAGE及质谱显示,所纯化蛋白的分子量约为32 kDa,且纯化蛋白的纯度达95%以上,最后通过 Western blotting法和肝素亲和层析法证明纯化的目的多肽具有免疫原性和肝素结合活性,以上充分表明了我们成功地在酵母表达系统中表达和纯化了 FNCHBD多肽,且表达的多肽具有抗原结合和肝素结合活性,这为后续FNCHBD的结构和功能实验奠定了基础。
REFERENCES
[1] Yamada KM. Fibronectin peptides in cell migration and wound repair. J Clin Invest, 2000, 105(11):1507−1509.
[2] Hynes RO. Integrins: bidirectional, allosteric signaling machines. Cell, 2002, 110(6): 673−687.
[3] Kang W, Park S, Jang JH. Kinetic and functional analysis of the heparin-binding domain of fibronectin. Biotechnol Lett, 2008, 30(1): 55−59.
[4] Hynes RO. Fibronectins. New York: Springer-Verlag,1990: 333−348.
[5] Sakai T, Johnson KJ, Murozono M, et al. Plasma fibronectin supports neuronal survival and reduces brain injury following transient focal cerebral ischemia but is not essential for skin wound healing and hemostasis. Nat Med, 2001, 7(3): 324−330.
[6] Mao Y, Schwarzbauer JE. Fibronectin fibrillogenesis: a cell-mediated matrix assembly process. Matrix Biol, 2005, 24(6): 389−399.
[7] Yi M, Ruoslahti E. A fibronectin fragment inhibits tumor growth, angiogenesis, and metastasis. Proc Natl Acad Sci USA, 2001, 98(2): 620−624.
[8] Labat-Robert J. Fibronectin in malignancy. Semin Cancer Biol, 2002, 12(3): 187−195.
[9] Liu X, Collodi P. Novel form of fibronectin from zebrafish mediates infectious hematopoietic necrosis virus infection. J Virol, 2002, 76(2):492−498.
[10] Adili R, Hong Yang, Guangheng Zhu, et al.Plasma fibronectin depletion enhances platelet aggregation and thrombus formation in mice lacking fibrinogen and vonWillebrand factor. Blood, 2009, 113(8):1809−1817.
[11] Vaz R, Martins GG, Thorsteinsdottirs S, et al.Fibronectin promotes migration, alignment and fusion in anin vitromyoblast cell model. Cell Tissue Res, 2012, 348(3): 569−578.
[12] Roumen P, Kenneth MY. Fibronectin at a glance.Cell Science, 2002, 115(20): 3861−3863.
[13] Iwona WP, Jean ES. The ins and outs of fibronectin matrix assembly. J Cell Sci, 2003, 116(16):3269−3276.
[14] Zou QY, Guo JR, Chen XF, et al. Preparation of recombinant polypeptide of N-terminal heparin binding domain of fibronectin and its effect on disseminated intravascular coagulation in rats. J Experi Hemaol, 2010, 18(3): 698−703.
邹起练, 郭江睿, 陈小芳, 等. 纤维连接蛋白 N端肝素结合域多肽的制备及其对 DIC大鼠的治疗作用. 中国实验血液学杂志, 2010, 18(3):698−703.
[15] Zou QY, Guo JR, Chen XF, et al. Recombinant polypeptide of N-terminal heparin binding domain of fibronectin antogonizes hepatic failure induced by endotoxin in mice. Natl Med J China, 2009,89(48): 3425−3429.
邹起练, 郭江睿, 陈小芳, 等. 组纤维连接蛋白N端肝素结合域多肽抗内毒素所致小鼠肝衰竭的作用. 中华医学杂志, 2009, 89(48): 3425−3429.
[16] Kim JH, Park SO, Jang HJ, et al. Importance of the heparin-binding domain of fibronectin for enhancing cell adhesion activity of the recombinant fibronectin. Biotechnol Lett, 2006, 28(17):1409−1413.
[17] Kang W, Park S, Janq JH. Kinetic and functional analysis of the heparin binding domain of fibronectin. Biotechnol Lett, 2008, 30(1): 55−59.
[18] Wijelath ES, Rahman S, Namekata M, et al.Heparin-II domain of fibronectin is a vascular endothelial growth factor-binding domain:enhancement of VEGF biological activity by a singular growth factor matrix protein synergism.Circ Res, 2006, 99(8): 853−860.
[19] Viji RI, Kumar VB, Kiran MS, et al. Angiogenic response of endothelial cells to heparin-binding domain of fibronectin. Biochem Cell Biol, 2008,40(2): 215−226.
[20] Kapila YL, Wang S, Dazin P, et al. The heparin-binding domain and V region of fibronectin reglate apoptosis by suppression of p53 and c-myc in human primary cells. J Biol Chem, 2002,277(10): 8482−8491.
[21] Andersson E, Rydengard V, Sonesson A, et al.Antimicrobial activities of heparin-binding peptides. Eur Biochem, 2004, 271(16): 1219−1226.
[22] Romanos M. Advances in the use ofPichia pastorisfor high level gene expression. Curr Opin Biotechnol, 1995, 6(5): 527−533.
[23] Faber KN, Hader W, Ab G, et al. Methylotrophic yeasts as factories for the production of foreign proteins. Yeast, 1995, 11(14): 1331−l334.
[24] Maeauley-Patrick S, Fazenda ML, McNeil B, et a1.Heterologous protein production using thePichia pastorisexpression system. Yeast, 2005, 22(4):249−270.
Expression, purification and identification for fibronectin C-terminal heparin-binding domain polypeptide inPichia pastoris
Xiaofang Chen1, Xianling Chen1, Qilian Zou2, Yong Wu1, and Yuanzhong Chen1
1Fujian Institute of Hematology,Affiliated Union Hosptal,Fujian Medical University,Fuzhou350001,Fujian,China
2Department of Cell Biology and Genetics,Basic Medical College Fujian Medical University,Fuzhou350004,Fujian,China
陈小芳, 陈显凌, 邹起练, 等. 纤维连接蛋白 C端肝素结合域多肽在毕赤酵母中的表达、纯化及鉴定. 生物工程学报, 2012,28(10): 1265−1273.
Chen XF, Chen XL, Zou QL, et al. Expression, purification and identification for fibronectin C-terminal heparin-binding domain polypeptide inPichia pastoris. Chin J Biotech, 2012, 28(10): 1265−1273.
Received:April 6, 2012;Accepted:July 24, 2012
Supported by:Science and Technology Innovation Platform Construction Project of Fujian Province (No. 2009J1004).
Corresponding author:Yuanzhong Chen. Tel: +86-591-83357896; E-mail: chenyz@pub.fjmu.edu.cn
福建省科技创新平台建设项目 (No. 2009J1004) 资助。