聚乙二醇修饰重组细胞珠蛋白对小鼠急性肝损伤的保护作用
李招发,邓小英,许佳佳,连文昌
1 华侨大学分子药物研究院,福建 泉州 362021
2 华侨大学分子药物教育部工程研究中心,福建 泉州 362021
生物技术与方法
聚乙二醇修饰重组细胞珠蛋白对小鼠急性肝损伤的保护作用
李招发1,2,邓小英1,2,许佳佳1,2,连文昌1,2
1 华侨大学分子药物研究院,福建 泉州 362021
2 华侨大学分子药物教育部工程研究中心,福建 泉州 362021
旨在探究聚乙二醇修饰重组细胞珠蛋白 (PEG modified recombinant cytoglobin,PEG-rCygb) 对小鼠急性肝损伤的保护作用。采用CCl4诱导KM小鼠急性肝损伤模型,尾静脉注射PEG-rCygb,收集血清及肝脏组织检测各项生化指标及组织病理学变化。结果表明,PEG-rCygb治疗组小鼠肝脏系数减小, 血清中AST﹑ALT水平降低, 肝组织匀浆中MDA含量减少, GSH含量增加,T-SOD、CAT活性升高。肝组织切片HE染色显示 PEG-rCygb可以缓解肝细胞脂肪变性, 减少炎症因子, 减轻肝细胞损伤。体外细胞学实验表明 rCygb经PEG修饰后对H2O2造成的肝星状细胞 (HSC) 氧化损伤发挥的保护作用增强。研究结果显示PEG-rCygb提高了机体对自由基的清除能力, 对CCl4引起的小鼠急性肝损伤具有保护作用。
聚乙二醇,重组细胞珠蛋白,氧化应激,急性肝损伤,氧自由基
Abstract:To investigate the protective effect of polyethylene glycol (PEG) modified recombinant cytoglobin(PEG-rCygb) on acute liver damage in mice. The acute liver injury model of KM mice was induced by CCl4and then treated with PEG-rCygb, The liver and blood samples were collected for biochemical and histopathological analysis. The results showed that PEG-rCygb reduced the liver mass index and decreased significantly the levels of alanine amiotransferase (AST) and aspartate transaminase (ALT) in mouse serum. In liver tissues, the content of malondialdehyde(MDA) was decreased, whereas the content of glutathione (GSH) was increased in PEG-rCygb treated group. PEG-rCygb also elevated the activities of total super oxidedismutase (T-SOD) and catalase (CAT) in liver tissues. HE staining of liver tissue slices revealed that PEG-rCygb relieved fatty degeneration of liver, decreased inflammatory factors and reduced liver cell injury. Further in vitro experiments indicated that the protective effects of PEG-rCygb on hepatic stellate cell (HSC)against H2O2were enhanced compared with that of rCygb. All results indicated that the PEG-rCygb promoted oxygen free radical scavenging ability and prevented acute liver injury in KM mice induced by CCl4.
Keywords:PEG, recombinant cytoglobin, anti-oxidative, acute liver damage, oxygen free radical
细胞珠蛋白 (Cytoglobin,Cygb) 是血红素球蛋白超家族中的新成员,由Kawada等在大鼠肝星状细胞中发现[1],是一个分子量为 21 kDa的胞浆蛋白。在生理状态下以单体形式存在,由190个氨基酸残基组成,具有传统的螺旋转角螺旋三明治结构,在人体各组织及发育的各个阶段分布广泛[2],同其他球蛋白家族成员血红蛋白(Hemoglobin,Hb)、肌红蛋白 (Myoglobin,Mb)和脑红蛋白 (Neuroglobin,Ngb) 一样,能够与氧可逆结合并具有高亲和力[3]。Cygb的抗肝损伤作用主要表现在自由基清除反应中的电子传递,进而抑制自由基诱导的 HSC活化以及随后的肝组织纤维化。本实验室曾利用rAAV-2作为载体将cygb基因导入CCl4和胆管结扎诱导的雄性SD大鼠肝损伤模型中,在体内和体外均发现 Cygb可减少肝组织纤维化[4-5]。此外,本实验室已成功克隆cygb基因,并建立了成熟的体外表达纯化Cygb蛋白的工艺,在研究中发现,rCygb对温度较为敏感、易降解、形成聚体等导致失活[6]。聚乙二醇化 (PEGylation) 是获得美国FDA批准的多种药物制剂的添加物和载体。1977年由Abuchowski等[7]首次将其用来修饰牛血清白蛋白并发现修饰后的蛋白质比未修饰的蛋白更有效。此后,PEG修饰应用于蛋白质类药物的研究也逐渐发展起来。目标蛋白经修饰后,稳定性增加,免疫原性下降,药物在体内的半衰期延长,保证了较高的血药浓度,从而增加疗效[8-9]。本研究利用 (mPEG)2-NHS对rCygb进行修饰,通过构建小鼠急性肝损伤模型,细胞氧化应激模型,探讨PEG修饰的rCygb对小鼠急性肝损伤的治疗作用。
1 材料与方法
1.1 材料
聚乙二醇活性酯 (mPEG)2-NHS购自北京凯正生物工程发展有限责任公司;T-SOD、MDA、GSH、CAT、ALT、AST测定试剂盒均购自南京建成生物公司;病理切片石蜡购自上海三精工贸有限公司;二甲苯、无水乙醇均为AR级,购自汕头西陇化工有限公司;H.E.染色试剂盒购自碧云天生物技术公司;rCygb (纯度 95%,分子量21 kDa) 为本实验室制备[6]。肝星状细胞株为本研究所保存。
KM小鼠,体重18~20 g,从上海斯莱克实验动物有限责任公司购买 (合格证编号为2007000521085),动物常规饲养,室温 22 ℃~25 ℃。
1.2 方法
1.2.1 PEG-rCygb制备
在室温条件下,以 (mPEG)2-NHS活性酯与rCygb的质量比9∶1于pH 8.0的Tris-HCl缓冲体系中发生修饰反应,温和作用 1 h,上样至SephacrylTMS-100凝胶过滤层析柱,用含0.15 mol/L NaCl和0.01 mol/L的pH 8.0的Tris-HCl平衡液洗脱,收集洗脱峰得到PEG-rCygb纯品,用0.22 µm微孔滤膜抽滤后-80 ℃保存。
1.2.2 过氧化物酶活性测定
采用愈创木酚法[6]测定PEG-rCygb和rCygb的过氧化物酶活性,于470 nm处测定光吸收值变化。取 50 mL,10 mmol/L Tris-HCl 缓冲液 (含0.15 mol/L NaCl),加入28 μL愈创木酚,磁力搅拌器加热搅拌至全部溶解后,加入19 μL,30%的H2O2混匀,即可配制反应混合液。500 μL反应体系,包括 484 μL反应混合液和 16 μL rCygb,重复3次。用缓冲液代替rCygb作为对照。
1.2.3 小鼠急性肝损伤模型构建
取雄性KM小鼠64只,随机分成8组,每组8只。对照组每天尾静脉注射生理盐水0.2 mL;模型组每天尾静脉注射生理盐水0.2 mL;rCygb低、中、高剂量组每天分别尾静脉注射 rCygb 0.02、0.04、0.08 mg/kg;PEG-rCygb低、中、高剂量组每天分别尾静脉注射 PEG-rCygb 0.02、0.04、0.08 mg/kg;除对照组外,其他各组预防治疗1周,于第7天腹腔注射0.1% CCl4玉米油造模剂 (10 mL/kg),禁食不禁水,12 h后先称重,再摘取眼球取血,3 500 r/m离心10 min获得血清待测[10-11]。同时各组均取小鼠肝称重,计算肝脏系数,并统一取肝左叶块,部分用10%中性甲醛溶液固定,常规石蜡包埋组织切片,HE染色,显微镜观察肝组织病理变化。部分在预冷的生理盐水中漂洗,除去血液,滤纸拭干,放入 5 mL小烧杯内,充分研碎,制备10%组织匀浆液,用普通离心机或低温低速离心机2 000 r/min离心10 min,保留上清待测[12]。按照试剂盒说明书操作,测定血清中ALT、AST以及肝组织匀浆液中T-SOD、MDA、CAT、GSH含量。
1.2.4 肝星状细胞细胞毒性检测
肝星状细胞 (HSC) 接种于96孔培养板中,待细胞生长至融合状态时,将经0.22 µm微孔滤膜抽滤无菌的rCygb及PEG-rCygb梯度稀释后,加入到各孔中,rCygb及PEG-rCygb各组终浓度依次为 0.0004、0.002、0.01、0.05、0.25、1.0、5.0、12.5、50 mmol/L,每组设3个平行孔,空白组加入等量 D-Hank′s缓冲液作为对照。然后置于 37 ℃、5% CO2饱和湿度下,分别继续培养12 h和24 h。处理完毕后各孔中加入MTT (终浓度为0.5 g/L),于37 ℃继续培养3~4 h,然后吸净各孔中液体,每孔加入150 μL DMSO,于振板仪缓慢振荡5 min左右至紫色结晶完全溶解,用酶标仪检测OD492(630 nm作为对照波长)[13]。
1.2.5 PEG-rCygb抗细胞氧化应激作用检测
将生长状态良好的HSC细胞接种于96孔板中,用含10%胎牛血清的DMEM培养基常规培养,待细胞贴壁良好后,开始实验处理。实验设正常对照组、模型组 (H2O2)、实验组 (rCygb和PEG-rCygb预处理),每组设立 3个平行孔。实验组先用不同浓度的rCygb和PEG-rCygb,各组终浓度依次为:0.05、0.25、1.0、5.0、12.5、25、50、100 mmol/L进行预处理,然后用500 μmolH2O2作用 6 h,模型组只用 H2O2处理。倒置显微镜下观察细胞的形态和增殖情况。MTT法测定细胞相对增殖率:每孔加入MTT溶液,37 ℃继续孵育4 h,小心吸弃上清液,每孔加入150 μL DMSO,振荡10 min,490 nm处检测A值,计算细胞相对增殖率 (Relative growth rate,RGR)[14]。
1.2.6 统计学分析
实验数据经Student'st-test统计学处理,以±s表示。
2 结果
2.1 rCygb与PEG-rCygb过氧化物酶活力以及稳定性对比
利用愈创木酚法检测,rCygb过氧化物酶活力为 (253±6.5) U/g,PEG-rCygb的过氧化物酶活力为 (370±30.1) U/g。结果表明:PEG-rCygb过氧化物酶活力要高于rCygb。在4 ℃保存条件下,rCygb放置1 d后,酶活力略有下降,3 d后酶活力明显降低,降低约 50%,7 d后酶活力降低84%;而PEG-rCygb酶活力随着时间的延长,酶活力降低不明显,7 d后酶活力降低16% (图1)。

图1 rCygb与PEG-rCygb稳定性对比Fig.1 The stability of the rCygb contrast PEG-rCygb.
2.2 PEG-rCygb对CCl4致急性肝损伤小鼠肝脏系数的影响
如表1所示,与正常对照组比较,模型组小鼠肝脏系数明显增加 (P<0.01)。PEG-rCygb和rCygb各浓度梯度组小鼠肝脏系数较模型组均有所减低并具有显著性差异 (P<0.05)。PEG-rCygb中、低剂量组间肝脏系数无显著差异,但PEG-rCygb高剂量组 (0.08 mg/kg) 较rCygb各浓度组更接近对照组 (P<0.01)。具体数据见表 1(肝脏系数=肝重/体重×100%)。
表1 PEG-rCygb对CCl4致急性肝损伤小鼠肝脏系数的影响 (n=8,±s)Table 1 Determination of the liver mass index after liver damage by CCl4(n=8,x±s)

表1 PEG-rCygb对CCl4致急性肝损伤小鼠肝脏系数的影响 (n=8,±s)Table 1 Determination of the liver mass index after liver damage by CCl4(n=8,x±s)
*P<0. 01vscontrol;△P<0.05vsmodel;▲P<0.01vsPEG-rCygb (0.08 mg/kg).
2.3 PEG-rCygb对急性肝损伤小鼠血清及肝组织中相关指标的影响
由表2可以看出,经 CCl4造模后,模型组小鼠血清中 ALT、AST的活力值显著增大(P<0.01)。PEG-rCygb各组小鼠血清中 ALT和AST活力值显著降低,并且 PEG-rCygb高剂量组 (0.08 mg/kg) 小鼠血清中 ALT活力值较rCygb各剂量组显著减低 (P<0.01),PEG-rCygb中剂量组 (0.04 mg/kg) AST活力值较rCygb各组更接近正常对照组 (P<0.01)。模型组小鼠血清中CAT活力显著下降 (P<0.01),PEG-rCygb高剂量组 (0.08 mg/kg) 小鼠血清中 CAT活力较rCygb各剂量组小鼠血清中 CAT活力显著增高(P<0.01或P<0.05)。
如表3所示,与正常对照组相比较,模型组小鼠肝组织匀浆中 GSH、T-SOD含量均显著下降 (P<0.01或P<0.05),且与模型组相比,PEG-rCygb及rCygb各组小鼠肝组织匀浆中GSH、T-SOD含量均明显上升 (P<0.01或P<0.05)。PEG-rCygb高、中、低各剂量组较rCygb相对应组更能抑制肝组织中GSH、T-SOD下降 (P<0.01或P<0.05),说明经PEG修饰后 rCygb对小鼠急性肝损伤的治疗效果更佳。
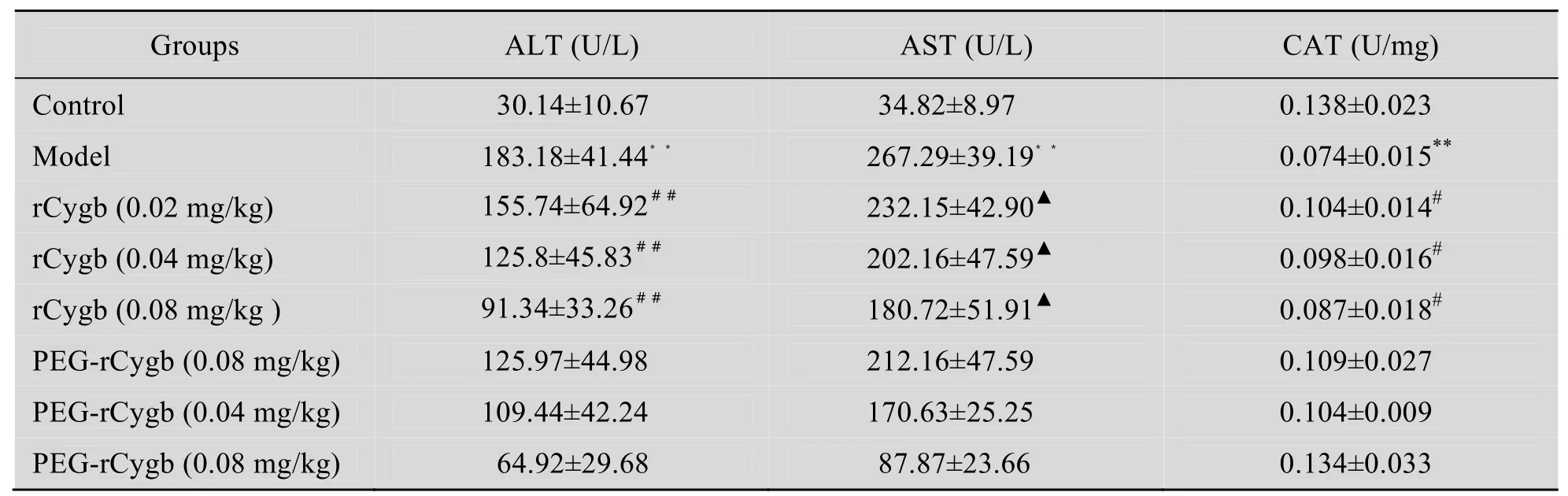
表2 PEG-rCygb对急性肝损伤小鼠血清AST、ALT、CAT的影响Table 2 Determination of the level of AST, ALT, CAT in serum after treatment (n=8,x±s)
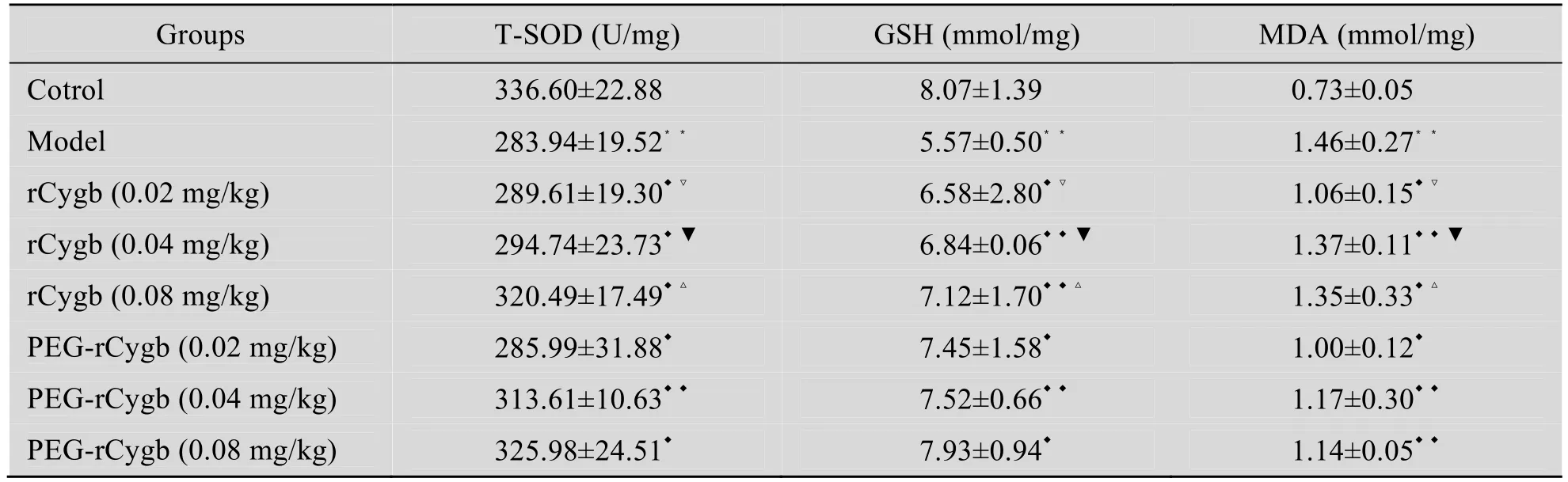
表3 PEG-rCygb对急性肝损伤小鼠组织中SOD、MDA、GSH的影响Table 3 Determination of the level of SOD, MDA, GSH in liver tissue after treatment (n=8,x±s)
与正常对照组相比较,模型组肝组织中MDA 显著升高 (P<0.01),PEG-rCygb各组中MDA的增大程度明显低于rCygb各组,且具有显著性差异 (P<0.05)。
2.4 肝组织病理观察
2.4.1 肝脏肉眼观察
CCl4造模后,小鼠解剖时发现正常对照组小鼠肝脏形态正常,边缘整齐、表面被膜光滑、色泽红润、质地柔软;模型组、PEG-rCygb低剂量组和rCygb低剂量组以及部分rCygb中剂量组小鼠肝组织肿大,有油腻感,色泽暗红,沙粒化程度严重,肝缘变钝,表面有白色物质附着,肝叶间有轻微程度的粘连。PEG-rCygb中、高剂量组和rCygb高剂量组白色附着物明显减少,沙粒程度减轻,质地柔软,但肝组织仍有不同程度的肿大。
2.4.2 HE染色镜检
光镜下可见,空白对照组的肝细胞结构清晰,以中心静脉为中心呈放射状排列,未见病理变化;模型组肝细胞排列紊乱,细胞肿胀,细胞浆内出现大小不一的空泡,呈脂肪变性,出现多灶性坏死灶,坏死灶内细胞核浓缩、碎裂、溶解,有大量的炎症细胞侵润。rCygb高、中、低剂量组差异较大,rCygb低剂量组细胞结构基本清晰,但仍有细胞肿胀、脂肪变性、炎症细胞侵润等现象。与之相较rCygb中剂量组肝细胞病变有所改善,但仍有少量炎症细胞侵润。rCygb高剂量组未见炎症细胞侵润,但在中心静脉周围有少量空泡结构 (图2)。
PEG-rCygb中、低剂量组细胞形态无明显差异,胞浆内仍存在轻微脂肪变性,但与rCygb各组相比病变程度明显改善,PEG-rCygb高剂量组肝细胞浆内空泡结构较其他各剂量组明显减少,与对照组肝细胞状态接近 (图2)。
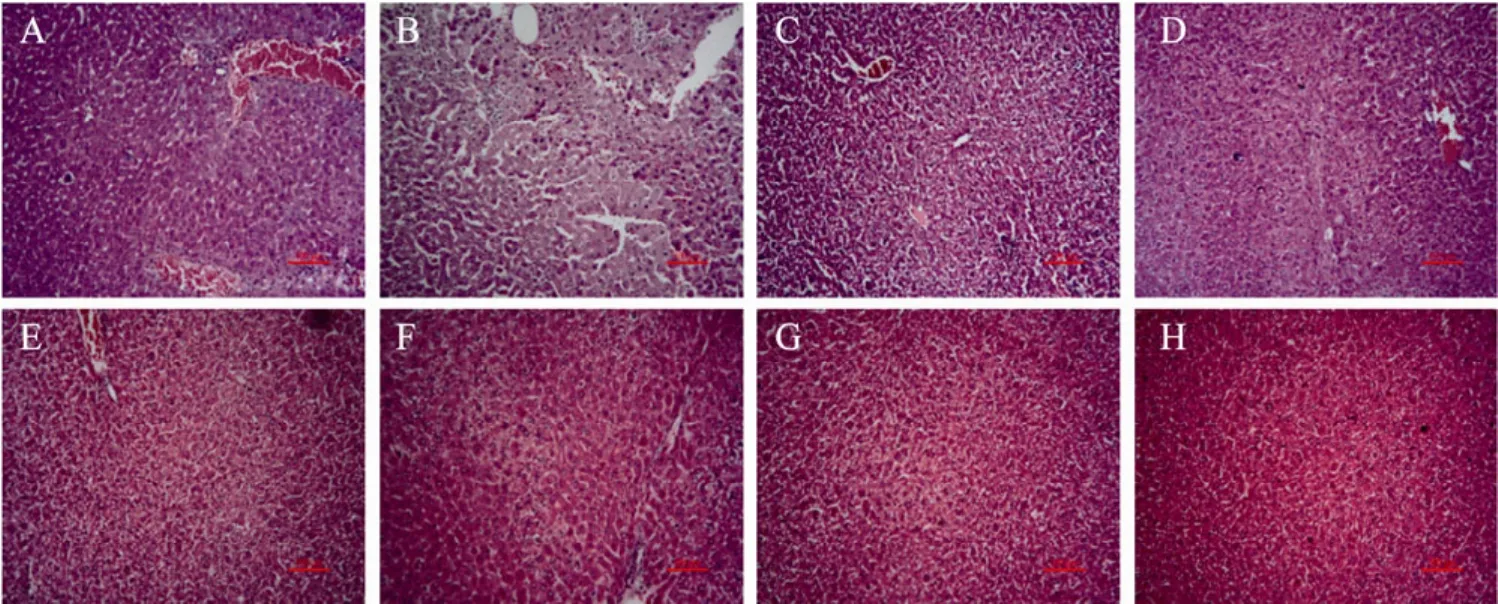
图2 HE染色观察肝组织病理变化 (100×)Fig.2 The histopathological changes were observed by HE staining in the liver tissues (100×). (A) Control. (B)Model. (C) rCygb (0.02 mg/kg). (D) rCygb (0.04 mg/kg). (E) rCygb (0.08 mg/kg). (F) PEG-rCygb (0.02 mg/kg). (G)PEG-rCygb (0.04 mg/kg). (H) PEG-rCygb (0.08 mg/kg).
2.5 PEG-rCygb对肝星状细胞 (HSC) 毒性检测
如图 3所示,药物作用 HSC 12 h后,PEG-rCygb各浓度梯度组同rCygb各浓度梯度组细胞相对增殖率 (RGR) 无明显差异,且均接近正常对照组,提示药物作用HSC 12 h后无HSC细胞毒性。药物作用HSC细胞24 h后,rCygb各低浓度梯度组HSC细胞相对增殖率略有增高,但不具有显著性差异,提示 rCygb各浓度组对HSC无细胞毒性。PEG-rCygb各浓度组细胞相对增殖率未见显著上升,同药物作用HSC 12 h后细胞相对增殖率无显著性差异,提示 rCygb经PEG修饰后无HSC细胞毒性,并且增强了其对HSC增殖的抑制作用。
2.6 PEG-rCygb抗 H2O2细胞氧化应激作用检测
如图 4所示,模型组 (H2O2) 经 500 µmol H2O2作用后,产生明显的细胞毒性,RGR下降(接近50%)。PEG-rCygb各浓度组HSC对H2O2氧化损伤作用有一定的抵抗能力,尤其是较高浓度组 (25、50、100 mmol/L) RGR显著增高,且较rCygb相应浓度组显著增加,提示经PEG修饰后rCygb抗细胞氧化应激作用显著增强。
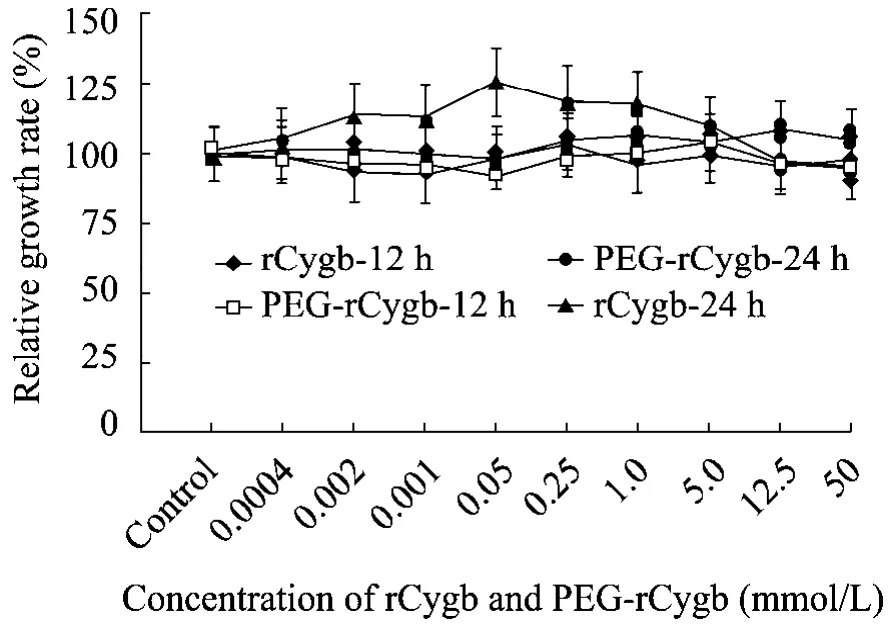
图3 PEG-rCygb对肝星状细胞 (HSC) 毒性检测Fig.3 Detection of cytotoxicity of PEG-rCygb to hepatic stellate cell (HSC).

图4 PEG-rCygb抗H2O2细胞氧化应激作用检测Fig.4 Antioxidation effect of PEG-Cygb against H2O2-induced cell damage to hepatic stellate cell (HSC).
3 讨论
本研究采用经典的 CCl4化学性损伤动物模型来研究PEG修饰后的rCygb对小鼠急性肝损伤的保护作用。CCl4诱导的肝损伤主要肝毒性机制为自由基的过快产生及引发的链式过氧化反应。CCl4在肝内主要被微粒体细胞色素氧化酶代谢,生成两个活性自由基 (CCl3O2·和 C1·) 及一系列氧活性物,诱发机体促氧化物与抗氧化物之间的动态平衡失调,引发链式过氧化反应,并诱导膜系统发生脂质过氧化反应,导致线粒体细胞膜的流动性丧失、通透性增高、造成细胞损伤[15]。同时自由基的过快产生使得低分子自由基清除剂 (如GSH) 以及酶性清除剂 (如T-SOD、CAT)大量消耗,造成体内 H2O2、超氧阴离子自由基(O2-) 增加,最终造成DNA氧化损伤,蛋白质空间结构改变、细胞因子凋亡、肝细胞坏死。
AST是转氨酶中比较重要的一种,主要存在于肝细胞中的线粒体,当肝细胞受到严重损伤时,线粒体膜破坏,释放出AST。ALT也是转氨酶中的一种,主要存在于肝细胞胞浆中,是反映肝细胞损伤最灵敏的检验方法,只要1%的肝细胞受到破坏,其在血清中的含量就可高出一倍。本实验中模型组小鼠腹腔注射 0.1% CCl4玉米油造模剂 (10 mL/kg) 后,模型组肝脏系数与对照组相比显著增大,ALT和AST水平也均显著升高,提示肝脏受损严重造模成功。PEG-rCygb高剂量组肝脏系数显著低于 rCygb各浓度组,ALT和 AST水平为其他各组中最低,并且PEG-rCygb各组ALT和AST水平随浓度增高而下降,表明经PEG修饰后的rCygb对肝脏受损的改善作用更明显。
MDA是脂质过氧化反应的终产物之一,由氧自由基或反应性氧化产物 (ROS) 与膜磷脂的多不饱和脂肪酸过氧化产生,可继续与膜蛋白作用产生交联,破坏膜结构,最终使细胞膜失去生物功能。常作为评价脂质过氧化程度的重要指标。超氧阴离子自由基 (O2-) 是活性氧生成过程中的初始产物,T-SOD是超氧阴离子歧化反应的催化剂,在体内氧化损伤过程中起重要的清毒作用。作为机体氧化损伤的酶清除剂,T-SOD可减少机体氧自由基的积累,缓解肝细胞损伤。CAT是一种金属蛋白酶,是机体抗氧化损伤的酶清除剂,可催化过氧化氢分解为水和氧气。CAT活力的高低直接反应出其对机体的保护能力。自由基的过快生成导致T-SOD和CAT等酶清除剂大量消耗,T-SOD和CAT的活力越高,说明机体清除毒性氧自由基的能力就越强,对肝损伤的保护作用越强。本实验结果表明,PEG-rCygb能显著降低MDA含量,升高T-SOD和CAT活性,提示 PEG-rCygb可通过清除羟自由基和超氧阴离子自由基,抑制脂质过氧化反应。
肝星状细胞的增殖和激活是肝损伤向肝纤维化转变的中心环节[16],各种致纤维化因素均以HSC为靶点,使其活化,活化的HSC产生大量细胞外基质 (ECM),ECM在肝脏内大量沉积,最终形成肝纤维化。本研究发现,给药 24 h后PEG-rCygb各浓度组RGR较正常对照组无显著差异,提示经PEG修饰后rCygb抗HSC增殖能力增强,且无 HSC细胞毒性。细胞氧化应激模型也显示,PEG-rCygb高浓度组 (25、50、100 mm/L) RGR显著高于模型组及rCygb各相对应浓度组。说明经PEG修饰后rCygb的抗氧化应激作用增强,进而抑制HSC细胞增殖[2]。
上述结果显示,经PEG修饰后的rCygb清除机体自由基的能力增强,抗 HSC氧化应激的能力提高,且无HSC细胞毒性,分析通过PEG修饰,一方面rCygb分子排阻体积显著增大,肾脏清除率明显下降,另一方面 PEG分子具有结构特异性,PEG修饰后的rCygb对肝脏网状内皮系统有抗性,使得网状内皮系统对rCygb的识别摄取和清除能力降低,并且rCygb经PEG修饰后其诱导产生中和抗体以及与抗体结合的能力降低或消除,使其难以被免疫系统识别和清除,从而有效延长了rCygb在体内的半衰期。此外,PEG链的空间位阻作用使得rCygb对蛋白酶酶解的抵抗能力大为增加,进而增加了rCygb的生物稳定性,进而增强其清除机体自由基的能力,改善肝脏内环境,达到抗肝损伤的作用。但是对于PEG增强rCygb药效作用的具体作用机理还有待进一步研究。
REFERENCES
[1] Kawada N, Kristensen DB, Asahina K, et al.Characterization of a stellate cell activation-associated protein (STAP) with peroxidase activity found in rat hepatic stellate cells. J Biol Chem, 2001, 276(84): 25318−25323.
[2] Nakatani K, Okuyama H, Shimahara Y, et al.Cytoglobin/STAP, its unique localization in splanchnic fibroblast-like cells and function in organ fibrogenesis. Lab Invest, 2004, 84(1): 91−101.
[3] de Sanctis D, Dewilde S, Pesce A, et al. Crystal structure of cytoglobin: the fourth globin type discovered in man displays heme hexa-coordination. J Mol Biol, 2004, 336(4):917−927.
[4] Xu R, Harrison PM, Chen M, et al. Cytoglobin overexpression protects against damage-induced fibrosis. Mol Ther, 2006, 13(6): 1093−1100.
[5] Li ZF, Zhao XF, Zhang TT. A preliminary study of anti-aging and wound healing of recombination cytoglobin. Acta Pharmaceut Sin, 2012, 47(1):51−57.
[6] Zhang TT, Li ZF, Xu RA. Preparation, purification and activity of recombinant rat cytoglobin. J Huaqiao Univ: Nat Sci, 2009, 30(6): 668−672.
[7] Abuchowski A, Van Es T, Palczuk NC, et al.Alteration of immunological properties of bovine serum albumin by covalent attachment of polyethylene glycol. J Biol Chem, 1977, 252(11):3578−3581.
[8] Deschamps AA, van Apeldoorn AA, Hayen H, et al.In vivoandin vitrodegradation of poly (ether ester) block copolymers based on poly (ethylene glycol) and poly (butylene terephthalate).Biomaterials, 2004, 25(2): 247−258.
[9] Harrington KJ, Mohammadtaghi S, User PS, et al.Effective targeting of solid tumors in patients with locally advanced cancers by radiolabeled pegylated liposomes. Clin Cancer Res, 2001, 7(2): 243−254.
[10] Xu SY, Bian RL, Chen X. Experimental Methodology of Pharmacology. 3rd ed. Beijing:People's Medical Publishing House, 2002.
徐叔云, 卞如濂, 陈修. 药理实验方法学. 3版.北京: 人民卫生出版社, 2002.
[11] Shen YX, Xu SY, Wei W, et al. Melatonin reduces memory changes and neural oxidative damage in mice treated with D-galactose. J Pineal Res, 2002,32(2): 173–178.
[12] Song X, Bao MM, Li DD, et al. Advanced glycation in D-galactose induced mouse aging model. Mech Ageing Dev, 1999, 108(3): 239–251.
[13] Lü YH, Wang QZ, Li ZF, et al. Role of cytoglobin in protecting hepatic stellate cells against oxidation induced damage. Chin J Biotech, 2011, 27(8):1174−1182.
吕颖慧, 王启钊, 李招发, 等. 细胞珠蛋白对肝星状细胞氧化损伤的保护作用. 生物工程学报,2011, 27(8): 1174−1182.
[14] Wang QZ, Lü YH, Li ZF, et al. Construction,detection and analysis of the oxidative stress models of hepatic stellate cells. Chin Clini Pharm Ther, 2010, 15(9): 1002−1007.
[15] Berger ML, Bhatt H, Combes B, et al. CCl4-induced toxicity in isolated hepalocyles: the importance of direct solvent injury. Hepatoiogy,1986, 6(1): 36−45.
[16] Guo JS, Friedman SL. Hepatic fibrogenesis. Semin Liver Dis, 2007, 27(4): 413−426.
Protective effects of PEG modified recombinant cytoglobin on acute liver injury in mice
Zhaofa Li1,2, Xiaoying Deng1,2, Jiajia Xu1,2, and Wenchang Lian1,2
1Institute of Molecular Medicine,Huaqiao University,Quanzhou362021,Fujian,China
2Molecular Medicine Engineering Research Center of the Ministry of Education,Quanzhou362021,Fujian,China
李招发, 邓小英, 许佳佳, 等. 聚乙二醇修饰重组细胞珠蛋白对小鼠急性肝损伤的保护作用. 生物工程学报, 2012, 28(10):1227−1235.
Li ZF, Deng XY, Xu JJ, et al. Protective effects of PEG modified recombinant cytoglobin on acute liver injury in mice. Chin J Biotech, 2012, 28(10): 1227−1235.
Received:February 20, 2012;Accepted:September 6, 2012
Supported by:Natural Science Foundation of Fujian Province (No. 2010J01207), the Fundamental Research Funds for the Central Universities(No. JB-ZR1142).
Corresponding author:Zhaofa Li. Tel: +86-595-22690838; Fax: +86-595-22690516; E-mail: lizhaofa@hqu.edu.cn
福建省自然科学基金 (No. 2010J01207),中央高校基本科研业务费资助项目 (No. JB-ZR1142) 资助。