Nisin A前体基因nisA的过量表达对Nisin A产量的影响
樊苗苗,邱一敏,刘晨,冀志霞,马昕,虞沂,陈守文
1 华中农业大学 农业微生物学国家重点实验室,湖北 武汉 430070
2 武汉大学药学院,湖北 武汉 430071
工业生物技术
Nisin A前体基因nisA的过量表达对Nisin A产量的影响
樊苗苗1,邱一敏1,刘晨1,冀志霞1,马昕1,虞沂2,陈守文1
1 华中农业大学 农业微生物学国家重点实验室,湖北 武汉 430070
2 武汉大学药学院,湖北 武汉 430071
Nisin是一种广泛应用于食品工业的抗菌素。通过基因工程手段分别构建了Nisin A前体结构基因nisA的穿梭表达载体 pMG36ek-nisA和整合型载体 pDG780-nisA,并转入 Nisin A产生菌乳酸乳球菌Lactococcus lactisATCC 11454中,得到两株基因工程菌FMM1和FMM2。对比工程菌和原始产生菌的生长状态及Nisin A产量,结果表明FMM1的生长速度、生物量以及发酵液的酸碱度没有显著变化,而Nisin A产量提高了31%;相反,FMM2的生物量较原始菌株显著降低,但Nisin A产量也有一定程度的提高。通过RT-PCR检测工程菌与原始产生菌Nisin A生物合成基因簇中11个基因的转录水平,结果显示FMM1和FMM2的11个基因的转录水平均有提高,其中FMM1提高更为显著。因此推测,nisA是Nisin A高产的关键因素之一,其游离型过量表达能显著提高Nisin A的产量。该研究为采用基因工程手段提高Nisin A的产量提供了新的思路,并对Nisin A的大规模工业生产有指导意义,同时,也为其他抗菌肽产生菌的基因工程改造提供了参考。
Nisin A,nisA,乳酸乳球菌ATCC 11454,过量表达
Abstract:Nisin is an antimicrobial peptide widely used in food industry. In this study, Nisin A production inLactococcus lactisATCC 11454 was improved by overexpression of Nisin A structural genenisAthrough introducing a shuttle expression vector pMG36ek-nisAand anintegrated vector pDG780-nisAinto the host strain. The differences of growth profiles and Nisin A production level between the two obtained genetic engineering strains FMM1/FMM2 and the parent strain were investigated. Our results show that while the growth profile (the growth rate, biomass and pH) of FMM1 was similar to the parent strain, its Nisin A production increased 31%. In contrast, the biomass of FMM2 was notably lower than the parent strain, while its yield of Nisin A enhanced slightly. The transcription level of genes involved in Nisin A biosynthesis in both engineering strains was further detected by RT-PCR. We found that all the 11 Nisin A biosynthetic genes in FMM1 and FMM2 had a higher transcription level than those in the parent strain, and these genes exhibited more significant increasing degree of transcription level in FMM1 which hosted the autonomous replicatingnisAgene. These data suggest that expression ofnisAmay act as a rate-limit factor in Nisin A biosynthesis. In conclusion, this work provides a new method to improve Nisin A production by increasing the transcription level ofnisA, paving the way to further large-scale industrial production of Nisin A.
Keywords:Nisin A,nisA,Lactococcus lactisATCC 11454, overexpression
乳链菌肽 (Nisin),亦称乳酸链球菌素或尼生素,是乳酸乳球菌Lactococcus lactis某些亚种在生长过程中所产生的一类属于羊毛硫抗生素家族的天然活性多肽类细菌素。它对许多革兰氏阳性菌有强烈的抑制作用。1969年,FAO/WHO食品添加剂联合专家委员会批准Nisin作为食品添加剂使用;1988年,食品应用工业中评定Nisin为公认安全的 (GRAS)[1]。迄今为止,Nisin是世界上唯一允许在食品防腐方面使用的抗菌素,已被60多个国家和地区广泛用于食品防腐保鲜中,并且在医药和轻工业等领域也极具广阔的应用前景。
Nisin是一种由34个氨基酸组成的抗菌肽,典型特征是分子结构中含有许多稀有氨基酸,以及稀有氨基酸之间形成的 5个硫醚环[2-3],其活性分子常以二聚体或是四聚体的形式存在。目前,已经发现6种Nisin类型 (A,B,C,D,E,Z),研究最深入的是Nisin A和Nisin Z[4]。Nisin的生物合成涉及到 11个基因,其中,nisA/Z是编码Nisin的前体肽结构基因[5],nisRK是Nisin生物合成的双组分调控基因[6],nisI和nisFEG是Nisin抗性基因和免疫基因[7],其余基因与Nisin后期加工成熟相关[8-9]。
近年来,随着Nisin市场需求的扩大以及分子生物学技术与理论的成熟,人们逐渐摒弃传统的菌株改良方法,进而将目光转向运用基因工程手段获取Nisin高产菌株,并取得一定成效。Kim等[10]将 Nisin生物合成相关的调控和免疫基因nisRK、nisFEG构建在一个16 kb的载体pND300上,在L.lactisATCC 11454中过量表达后,工程菌生长速度加快,而且Nisin产量也提高了20%左右;Wu等[11]利用Mu转座复合体突变技术来提高Nisin产量,其中有3个突变体Nisin产量降低,其余的没有提高;胡红梅等[12]通过增加Nisin产生菌的免疫基因nisI的拷贝数使Nisin产量提高32%。Cheigh等[13]尝试在Nisin产生菌中加强表达nisZ、nisRK、nisFEG,其中nisRK、nisFEG的加强表达菌株的Nisin产量有所提高,但是菌体生长速度却受到影响,而nisZ的加强表达菌株未构建成功。
迄今为止,还没有关于通过过量表达nisA来提高Nisin A产量的相关报道。本研究首次通过构建前体肽编码基因nisA的穿梭表达载体和整合载体来提高L.lactisATCC 11454中Nisin A的产量,并对产量提高的分子机理进行了初步探索。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
大肠杆菌Escherichia coliDH5α、藤黄微球菌Micrococcus luteus、乳酸乳球菌Lactococcus lactisATCC 11454购自美国菌种保藏中心ATCC;大肠杆菌-乳酸菌穿梭表达载体pMG36ek为本实验室改造并保存,是在pMG36e的多克隆位点Hind Ⅲ位点插入卡那霉素抗性基因片段;含卡那霉素抗性基因的质粒pDG780为本实验室保存;克隆表达载体pMD19-T购自TaKaRa公司。
1.1.2 培养基
L.lactis: M17培养基,30 ℃静置培养[14];E.coli: LB培养基,37 ℃振荡培养[15];M.flavus:同乳链菌肽效价测定培养基 BHI medium(Difco),30 ℃静置培养。
1.1.3 工具酶和试剂
pfuDNA聚合酶、Ex Taq酶、TaqDNA聚合酶、限制性内切酶、T4 DNA连接酶、T4 DNA聚合酶、Klenow fragment、溶菌酶、dNTPs、DNA分子量标准均购自TaKaRa公司;Nisin A标准品购自Sigma公司;RNA Extraction Kit购自 Omega公司;RevertAid First Strand cDNA Synthesis Kit购自Fermentas公司;质粒提取试剂盒购自北京庄盟国际生物基因科技有限公司;DNA片段快速纯化/回收试剂盒购自北京赛百盛基因技术有限公司;其他试剂均为进口分装或国产分析纯。
1.2 方法
1.2.1 DNA的提取
大肠杆菌质粒 DNA和乳酸菌基因组 DNA的提取方法参见分子克隆[15];乳酸乳球菌质粒DNA的抽提方法参见文献[16]。
1.2.2 DNA的酶切、纯化、连接和转化
DNA的酶切、纯化、连接按TaKaRa公司相应试剂说明书进行。
1.2.3 感受态细胞的制备及转化
大肠杆菌的感受态制备和转化参见分子克隆CaCl2介导转化法;乳酸乳球菌的感受态制备和电转化根据文献[17-18]进行。
1.2.4nisA基因与相关调控元件的拼接合成及重组质粒的构建与鉴定
根据P32启动子和nisA序列各设计一对引物 (表1)。其中粗体部分为酶切位点,下划线为SOE-PCR重叠引物。

表1 本研究中所用的PCR引物Table 1 Primers used in this study
nisA片段扩增以L.lactisATCC 11454总DNA为模板,nisA-F和nisA-R为引物,反应条件:95 ℃预变性 5 min;94 ℃变性 45 s,42 ℃退火45 s,72 ℃延伸30s,共30个循环;P32片段扩增以pMG36ek质粒为模板,P32-F和P32-R为引物,反应条件:95 ℃预变性5 min;94 ℃变性45 s,62 ℃退火45 s,72 ℃延伸30s,共30个循环。以PCR纯化产物为模板,P32-F和nisA-R为引物,采用重叠延伸 PCR方法[19]拼接合成目的基因 P32-nisA。扩增产物用 2.5%琼脂糖凝胶电泳检测,并纯化回收。PCR产物与质粒pMG36ek经EcoRⅠ和ClaⅠ双酶切后连接,转化感受态 DH5α。涂布于含卡那霉素抗性的 LB平板,37 ℃培养。次日挑取单菌落增菌,提取质粒进行 PCR和双酶切验证,并测序确证。构建的游离型载体命名为 pMG36ek-nisA;将构建好的pMG36ek-nisA质粒用KpnⅠ和NsiⅠ酶切,得到Er-P32-nisA片段,连接到pDG780载体上,转化验证步骤同上,得到整合型载体命名为pDG780-nisA。
1.2.5 重组质粒的电转化、筛选及验证
L.lactisATCC 11454感受态制备与电转化参考文献[17-18],电击后涂布于含红霉素的GM17平板上,30 ℃培养48 h。挑取单菌落在含红霉素的GM17液体培养基中增菌后提取质粒,因L.lactisATCC 11454含内源质粒,且外源质粒在该菌中拷贝数极低,故对外源质粒进行以下鉴定:1) 取适量质粒为模板,用 P32-F和nisA-R为引物进行PCR验证。2) 经PCR鉴定后的质粒重新转化到感受态DH5α,涂布卡那霉素抗性平板;次日挑取单菌落增菌,提取质粒作双酶切鉴定。得到工程菌并命名为 FMM1和 FMM2,连续传代十次稳定后,进行后续试验。
1.2.6 工程菌与原始菌的生长状况的测定与比较
对FMM1和FMM2的生长曲线和发酵液的pH变化进行测定,实验重复3次。
1.2.7 工程菌与原始菌Nisin A产量的测定与比较
采用琼脂扩散法,参考文献[20]并略加改进,测定Nisin A效价。以Nisin A标准品作为对照,测定FMM1和FMM2对指示菌M.flavus的抑菌活性实验,检测其抑菌圈直径,根据直径大小作标准曲线,再根据标准曲线公式计算出待测样品的效价;以原始产生菌L.lactisATCC 11454为对照,实验重复3次。
1.2.8 RNA的提取和RT-PCR检测
乳酸乳球菌RNA的提取以及反转录参见试剂盒说明书,RT-PCR以cDNA为模板,反应条件:95 ℃预变性 5 min;94 ℃,变性 45 s,50 ℃退火45 s,72 ℃延伸30s,共30个循环。琼脂糖凝胶电泳检测RT-PCR产物。
2 结果与分析
2.1 PCR拼接合成目的基因及重组质粒的构建
经琼脂糖凝胶电泳鉴定,SOE-PCR产物片段约340 bp,符合预期片段长度 (图1)。进一步测序鉴定 (测序图略),证实与设计序列一致。按照“材料与方法”中的重组质粒构建流程,得到游离型载体 pMG36ek-nisA和整合型载体pDG780-nisA(图 2),并验证正确 (图略)。
2.2 工程菌的构建
将游离型载体pMG36ek-nisA和整合型载体pDG780-nisA分别电转化到L.lactisATCC 11454中,以红霉素抗性为筛选标记筛选阳性转化子,进行 PCR和酶切鉴定 (图略)。结果成功获得Nisin A前体结构基因nisA的过量表达工程菌株FMM1和FMM2。
2.3 重组菌与原始菌的生长状况的测定与比较
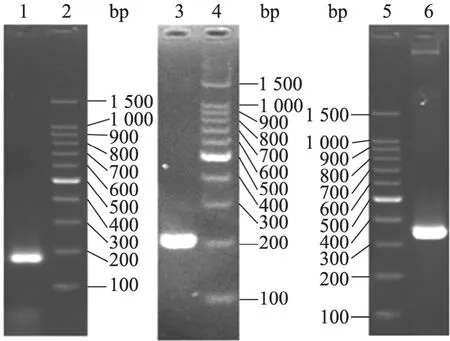
图1 P32启动子、nisA及两者重叠延伸PCR产物的鉴定Fig.1 PCR analysis of P32 promoter,nisAgene and their SOE product. 1: P32, a strong constitutive promoter; 2, 4, 5: 100 bp DNA ladder marker; 3:PCR product ofnisAgene; 6: SOE-PCR product of P32-nisA.
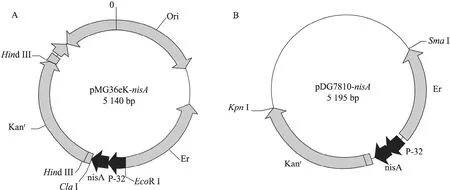
图2nisA过量表达载体的图谱Fig.2 Map of the recombinant plasmid fornisAoverexpression. (A) Shuttle expression vector pMG36ek-nisA. (B)Integrated expression vector pDG780-nisA.
为了解nisA基因的过量表达对宿主菌的生长是否造成影响,将过夜培养的FMM1、FMM2和L.lactisATCC 11454分别以1%的接种量转接至新鲜的GM17培养基中发酵,每2 h取发酵液测定OD600和pH (图3)。结果表明,在发酵24 h周期内,FMM1和出发菌株L.lactisATCC 11454的生长速率和生物量相近,表明该工程菌中nisA基因的导入对细菌生长基本没影响;FMM2的生物量则比二者低 10%左右,推测原因可能是pDG780-nisA质粒整合入L.lactisATCC 11454基因组后,整合位点周边基因的表达发生变化,进而对细胞生长造成影响,具体机制还待深入研究。对3株菌发酵液的pH检测显示无明显差别。
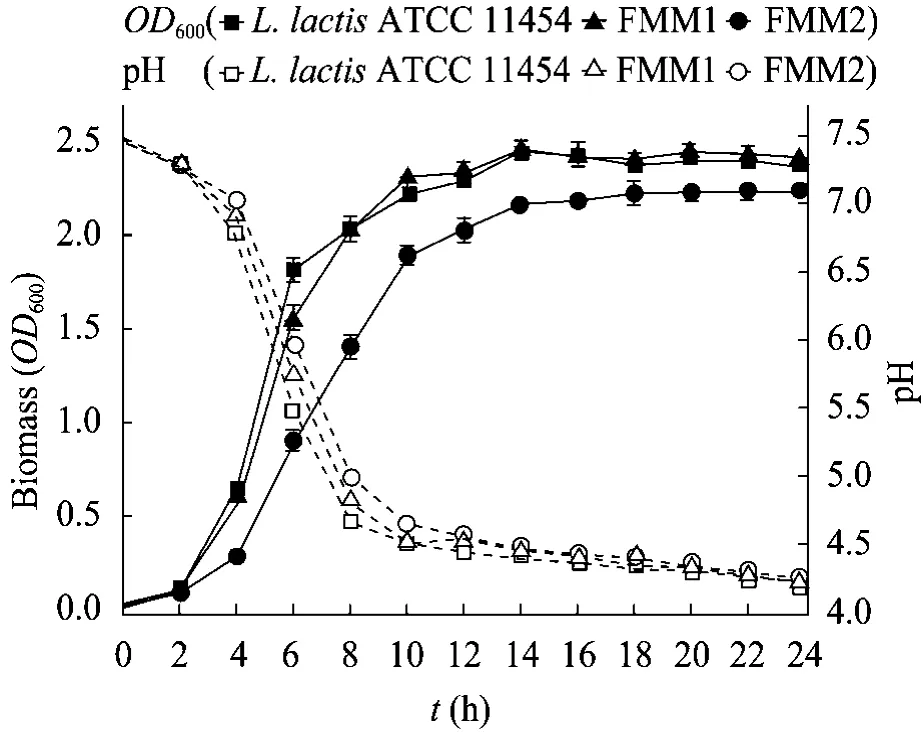
图3 工程菌FMM1、FMM2和野生菌L.lactisATCC 11454发酵过程中OD600和pH变化曲线Fig.3 Cell density (OD600) and pH value of FMM1,FMM2 andL.lactisATCC 11454 culture over a 24 h time period of fermentation.
2.4 工程菌与原始菌Nisin A产量的比较
为检测nisA的引入对Nisin A产量的影响,本研究采用琼脂扩散法分别检测工程菌FMM1、FMM2和原始菌L.lactisATCC 11454的Nisin A产量。将过夜培养物分别以1%的接种量转接至新鲜的GM17培养基中。发酵第6 h开始取样,每2 h取一次。以Nisin A标准品作对照,测定发酵液的抑菌活性 (图4和表2)。结果表明,进入发酵稳定期后,FMM1菌株的Nisin A产量显著提高31%左右;而FMM2菌株的产量提高则稳定在8%左右。这说明nisA的加强表达能够提高Nisin A的产量,因此预测,进一步改造nisA游离型表达载体,可大幅提高Nisin A产量,继而通过对其机制研究和优化培养,最终应用于Nisin A的大规模工业生产。
2.5 工程菌与原始菌的基因表达水平的比较
为进一步了解过量表达nisA致使Nisin A产量提高的机制,本研究分别提取工程菌和原始菌的总RNA,然后通过RT-PCR检测工程菌与原始菌Nisin A生物合成基因簇中11个基因的转录水平 (图 5)。结果显示nisA的过量表达能够提高Nisin A生物合成基因簇的 11个基因的转录水平,说明Nisin A前体结构基因nisA过量表达可以促使Nisin A基因簇的高效转录,从而提高Nisin A前体的产量,为其高产提供了可行性策略。

图4 FMM1、FMM2和L.lactisATCC 11454的Nisin A产量的比较Fig.4 Comparison of Nisin A production of FMM1,FMM2 andL.lactisATCC 11454.
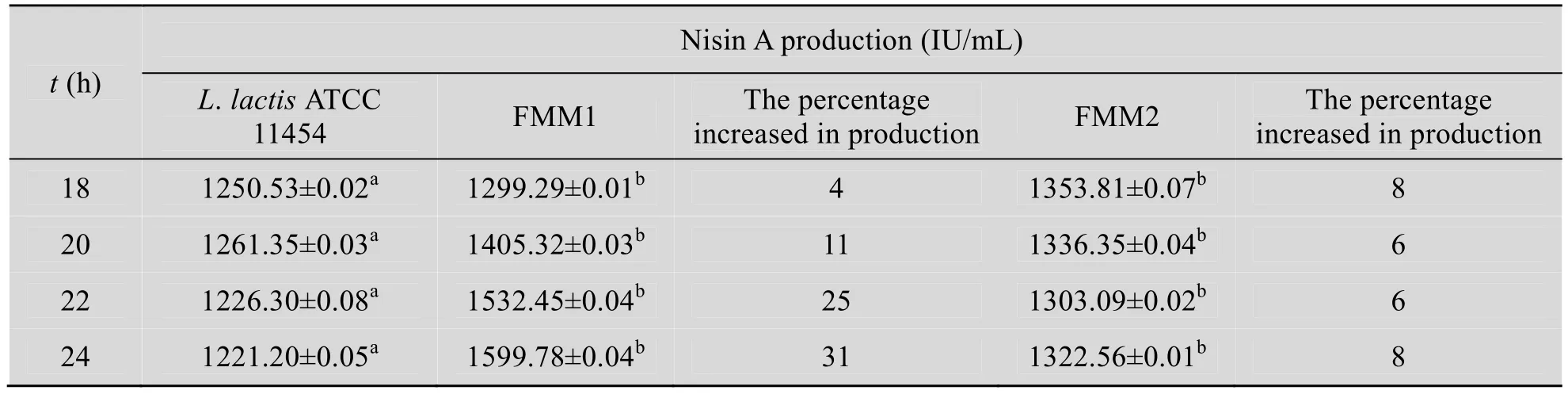
表2 Nisin A产量的比较Table 2 Comparison of Nisin A production among the three strains in the different time
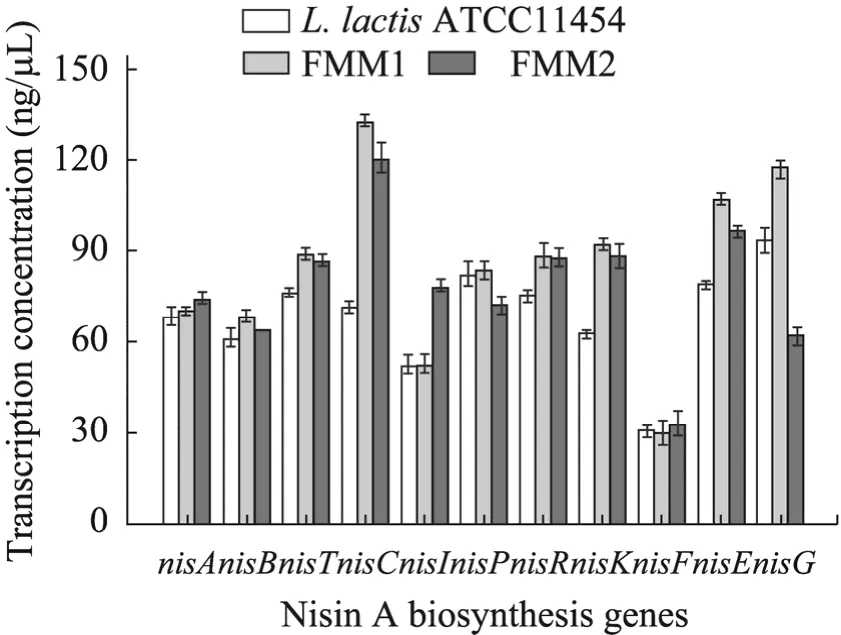
图5 FMM1、FMM2和L.lactisATCC 11454的Nisin A基因簇的转录水平比较Fig.5 Comparison of the transcription of Nisin A biosynthesis genes of FMM1, FMM2 andL.lactisATCC 11454.
3 讨论
本研究比较了Nisin A前体编码基因nisA以游离型和整合型方式过量表达对Nisin A产量的影响,结果表明nisA的游离型过量表达对Nisin A增产有良好的效果,可能因为提高nisA拷贝数后能够供应更多的Nisin A前体,从而在一定程度上增加了Nisin A的产量。另外,nisA整合型过量表达菌株的Nisin A产量也有较大提高,但菌株的生物量明显降低,可能因为外源基因整合入基因组后,整合位点上下游基因的表达受到影响,从而改变了宿主菌生理状态所致。为从分子水平上解释工程菌株Nisin A产量提高机理,本研究对工程菌株进行了RT-PCR实验,结果表明,游离型工程菌FMM1中nisA的过量表达可以促使Nisin A基因簇中大部分基因的高效转录,尤其与前体肽修饰相关的nisB(脱水酶) 和nisC(环化酶) 的转录水平显著增加,从而使Nisin A合成量提高 31%;另一方面,整合型工程菌FMM2中nisA的加强表达在一定程度上可以提高nisB和nisC的转录水平,但是相比于FMM1,FMM2中负责前体肽切割的nisP转录量降低,这可能是导致其成熟的 Nisin A产量较低的原因;同时,可能由于FMM2的单位菌体Nisin A产量增加,其免疫基因nisI的表达量大幅增加以提高菌体的耐受性,但是具体分子机制还有待进一步揭示。此外,实验结果也暗示nisA基因对其他Nisin A生物合成相关基因的表达具有协同效应,这在Nisin A生物合成研究中也是首次报道。与此同时,本研究也尝试了通过过量表达nisRK与nisFEG提高Nisin A的产量,结果也能够使Nisin A的产量提高 (结果未显示),并且根据文献报道[13],在Nisin Z产生菌L.lactisA164中过量表达nisRK和nisFEG能够使Nisin Z的产量提高 56%,这与我们的结果一致。因此推测,在Nisin A的生物合成过程中调控基因和免疫基因对Nisin A产量也有影响,其分子机理还有待进一步探讨。
综合以上结果,本研究一方面通过基因工程手段提高了Nisin A的产量,弥补了传统工业生产弊端,为Nisin A规模化生产和后续研究奠定了一定的基础;另一方面,相比其他Nisin类型,针对Nisin A高产工程菌株的构建,优选方案是有效提高其生物合成前体物的供应,本研究将进一步改造nisA游离型表达载体,并尝试利用其他启动子带动nisA的高效转录,更大幅度地提高Nisin A的产量。
REFERENCES
[1] Hansen JN. Antibiotics synthesized by posttranslational modification. Annu Rev Microbiol, 1993, 47: 535−564.
[2] Xu QJ, Li XL, Li XX, et al. The natural peptide antimicrobial agent of nisin and its application of food preservation. Food Res Dev, 2008, 29(4):177−182.
徐启军, 黎锡流, 李晓玺, 等. 天然多肽抗菌活性物质 Nisin及其在食品抗菌保鲜中的应用. 食品研究与开发, 2008, 29(4): 177−182.
[3] Ross AC, Vederas JC. Fundamental functionality:recent developments in understanding the structure-activity relationships of lantibiotic peptides. J Antibiot (Tokyo), 2011, 64(1): 27−34.
[4] Kramer NE, Smid EJ, Kok J, et al. Resistance of Gram-positive bacteria to nisin is not determined by lipid II levels. FEMS Microbiol Lett, 2004,239(1): 157−161.
[5] Engelke G, Gutowski-Eckel Z, Hammelmann M, et al. Biosynthesis of the lantibiotic nisin: genomic organization and membrane localization of the NisB protein. Appl Environ Microbiol, 1992,58(11): 3730−3743.
[6] Engelke G, Gutowski-Eckel Z, Kiesau P.Regulation of nisin biosynthesis and immunity inLactococcus lactis6F3. Appl Environ Microbiol,1994, 60(3): 814−825.
[7] Kuipers OP, Beerthuyzen MM, Siezen RJ, et al.Characterization of the nisin gene clusternisABTCIPRofLactococcus lactis. Requirement of expression of thenisAandnisIgenes for development of immunity. Eur J Biochem, 1993,216(1): 281−291.
[8] van der Meer JR, Rollema HS, Siezen RJ, et al.Influence of amino acid substitutions in the nisin leader peptide on biosynthesis and secretion of nisin byLactococcus lactis. J Biol Chem, 1994,269(5): 3555−3562.
[9] Koponen O, Tolonen M, Qiao M, et al. NisB is required for the dehydration and NisC for the lanthionine formation in the post-translational modification of nisin. Microbiology, 2002,148(11): 3561−3568.
[10] Kim WS, Hall RJ, Dunn NW. Improving nisin production by increasing nisin immunity/resistance genes in the producer organismLactococcus lactis.App Microbiol Biotechnol, 1998, 50(4): 429−433.
[11] Wu Z, Xuanyuna Z, Li R, et al. Mu transposition complex mutagenesis inLactococcus lactis−identification of genes affecting nisin production. J Appl Microbiol, 2009, 106(1): 41−48.
[12] Hu HM, Jiang LK, Lin YH, et al. Enhanced nisin production by overexpression of nisin immunity genenisIin the nisin-producing strain. Acta Microbiol Sin, 2010, 50(10): 1341−1346.
胡红梅, 蒋立科, 林宇恒, 等. 乳链菌肽自身免疫基因nisI的表达对乳链菌肽产量的影响. 微生物学报, 2010, 50(10): 1341−1346.
[13] Cheigh CI, Park H, Choi HJ, et al. Enhanced nisin production by increasing genes involved in nisin Z biosynthesis inLactococcus lactissubsp.lactisA164. Biotechnol Lett, 2005, 27(3): 155−160.
[14] Guo ZW. Genetic breeding ofLactococcus lactisATCC11454 for high-yield nisin strain [D].Wuhan: Huazhong Agricultural University, 2007.
郭志伟. 乳酸乳球菌 ATCC11454高产乳链菌肽的遗传育种[D]. 武汉: 华中农业大学, 2007. (未链接到本条文献信息)
[15] Sambrook J, Russell DW, ed. Huang PT, et al,Trans. Molecular Cloning: A Laboratory Manual.3rd ed. New York: Cold Spring Harbor Laboratory Press, 2002.
Sambrook J, Russell DW, 著. 黄培堂, 等译. 分子克隆实验指南. 3版. 北京: 科学出版社, 2002.
[16] O'sullivan DJ, Klaenhammer TR. Rapid mini-prep isolation of high-quality plasmid DNA fromLactococcusandLactobacillusspp. Appl Environ Microbiol, 1993, 59(8): 2730−2733.
[17] Gerber SD, Solioz M. Efficient transformation ofLactococcus lactisIL1403 and generation of knock-out mutants by homologous recombination. J Basic Microbiol, 2007, 47(3): 281−286.
[18] Turgeon N, Laflamme C, Ho J, et al. Elaboration of an electroporation protocol forBacillus cereusATCC 14579. J Microbiol Methods, 2006, 67(3):543−548.
[19] Xu F, Yao QH, Xiong AS, et al. SOE PCR and its application in genetic engineering. Mol Plant Breed, 2006, 4(5): 747−750.
徐芳, 姚泉洪, 熊爱生, 等. 重叠延伸 PCR技术及其在基因工程上的应用. 分子植物育种, 2006,4(5): 747−750.
[20] Wolf CE, Gibbons WR. Improved method for quantification of the bacteriocin nisin. J Appl Bacteriol, 1996, 80(4): 453−457.
Effect of overexpressing Nisin A structural genenisAon Nisin A production
Miaomiao Fan1, Yimin Qiu1, Chen Liu1, Zhixia Ji1, Xin Ma1, Yi Yu2, and Shouwen Chen1
1State Key Laboratory of Agricultural Microbiology,Huazhong Agricultural University,Wuhan430070,Hubei,China
2School of Pharmaceutical Sciences,Wuhan University,Wuhan430071,Hubei,China
樊苗苗, 邱一敏, 刘晨, 等. Nisin A前体基因nisA的过量表达及其对Nisin A产量的影响. 生物工程学报, 2012, 28(10):1175−1183.
Fan MM, Qiu YM, Liu C, et al. Effect of overexpressing Nisin A structural genenisAon Nisin A production. Chin J Biotech,2012, 28(10): 1175−1183.
Received:March 19, 2012;Accepted:May 19, 2012
Supported by:The "Dawn" Program of Wuhan Science and Technology Bureau for Young Scholars (No. 201050231069).
Corresponding author:Shouwen Chen. Tel: +86-27-87283005-8102; E-mail: chenshouwen@mail.hzau.edu.cn
Yi Yu. Tel: +86-27-68752491; E-mail: yu_yi@whu.edu.cn
武汉市科技局晨光计划 (No. 201050231069) 资助。