建立分泌型荧光素酶基因标记的原位肝癌模型及用于干扰素β基因治疗评价
王刚,连忠辉,田文洪,,董小岩,尉迟捷,吴小兵,4
1 中国疾病预防控制中心 病毒病预防控制所,北京 100052
2 吉林大学 生命科学学院,吉林 长春 130012
3 北京五加和分子医学研究所,北京 100176
4 北京亦庄国际生物医药投资管理有限公司,北京 100111
生物技术与方法
建立分泌型荧光素酶基因标记的原位肝癌模型及用于干扰素β基因治疗评价
王刚1,连忠辉2,田文洪1,2,董小岩3,尉迟捷1,吴小兵1,4
1 中国疾病预防控制中心 病毒病预防控制所,北京 100052
2 吉林大学 生命科学学院,吉林 长春 130012
3 北京五加和分子医学研究所,北京 100176
4 北京亦庄国际生物医药投资管理有限公司,北京 100111
旨在建立一种分泌型荧光素酶基因标记的小鼠原位移植型肝癌模型并观察其对干扰素 β基因治疗的反应。首先建立稳定表达分泌型荧光素酶Gluc (Gaussia princepsluciferase) 的小鼠肝癌细胞Hepa 1-6/Gluc;将该细胞通过脾注射至C57BL/6小鼠肝脏建立原位移植型肝癌模型,通过检测外周血Gluc活性监测小鼠体内肿瘤生长情况;用此模型观察水动力注射干扰素β质粒DNA的抗肿瘤效果。结果表明,通过脾注射Gluc基因标记的Hepa 1-6细胞可以建立小鼠原位移植型肝癌模型;外周血Gluc活性可以有效反映体内接种肿瘤细胞的数量和肿瘤的生长情况;通过监测外周血Gluc活性可灵敏反映干扰素β基因治疗对肿瘤生长的抑制作用。本研究表明,利用Gluc为报告基因建立的小鼠原位移植型肝癌模型可以体外实时监测肿瘤的生长情况,并能灵敏可靠地用于抗肿瘤治疗效果的评价。
荧光素酶,Gluc,肝癌模型,IFN-β,基因治疗
Abstract:To establish an orthotopic transplant mouse model of hepatocellular carcinoma (HCC) labeled with secretary luciferase and to study its response to anti-tumor treatment with interferon-β gene therapy. We labeled the murine hepatoma Hepa1-6 cells with secretaryGaussia princepsluciferase (Gluc), and then injected Gluc labeled Hepa1-6 cells intrasplenically in C57BL/6 mice. We monitored blood Gluc to evaluate the tumor development and anti-tumor effects of hydrodynamic injection with interferon-β expressing plasmid. We successfully established the orthotopic mouse model of HCC by intrasplenic injection of Gluc labeled Hepa1-6 cells. The Gluc blood assay could reflect the amount of cancer cellsin vivo, tumor progression, as well as anti-tumor effect of interferon-β gene therapy. In conclusion, Gluc labeled orthotopic transplant mouse model of HCC canex vivoreal-time monitor the tumor development and tumor response to treatments.
Keywords:luciferase, Gluc, model of hepatocellular carcinoma, IFN-β, gene therapy
肝细胞癌 (Hepatocellular carcinoma,HCC,简称肝癌) 是最为常见的肝脏原发恶性病变。动物肝癌模型是研究肿瘤体内生长、转移以及抗肿瘤药物开发的重要工具。通常情况下,模型体内肿瘤生长情况的监测是比较困难的,肿瘤需要生长到一定程度才能在体外触及,往往需要在不同时间处死动物才能测量肿瘤大小,因此难以获得连续的肿瘤生长数据。这为研究肿瘤的发生和发展,尤其给肿瘤治疗效果的评价造成了不便。
Gluc是一种来自于海洋挠脚类动物Gaussia princeps的分泌型荧光素酶[1],是一个理想的体外实时监测体内生物学过程的报告基因[2-3]。通过检测外周血中的 Gluc已经实现了方便地监测接种在动物体内的神经胶质瘤、乳腺癌和肝母细胞瘤[2-5]。我们试图建立以Gluc为报告基因的小鼠原位移植型肝癌模型,用以方便灵敏地体外实时监测体内肿瘤生长情况,并尝试用这种模型实时监测和评价肿瘤治疗效果。
1 材料与方法
1.1 材料
含有neo基因并以 CAG (Cytomegalovirus enhancer,chicken β-actin promoter,β-globin poly A signal) 为启动子的 Gluc真核表达质粒pAAV2neo-CAG-Gluc、人干扰素 β (Interferon-β,IFN-β) 真核表达质粒 pAAV2neo-CAG-IFN-β 和增强型绿色荧光蛋白 (Enhanced green fluorescent protein,EGFP) 真核表达质粒 pAAV2neo-CAGEGFP由本室构建和保存。来源于C57L小鼠的肝癌细胞株Hepa 1-6购自美国ATCC,由本室保存。3~4周龄雄性C57BL/6小鼠购自北京华阜康生物科技股份有限公司。质粒大提试剂盒购自德国Qiagen公司;DMEM培养基、胎牛血清和脂质体 Lipofectamine™ 2000购自美国 Invitrogen公司;G418和戊巴比妥钠购自北京欣经科生物技术有限公司;Gaussia荧光素酶检测试剂盒购自美国NEB公司;VeriKine-HS™ Human IFN-β ELISA检测试剂盒购自美国PBL公司。
1.2 细胞培养、转染和筛选
Hepa 1-6细胞用含10%胎牛血清的DMEM培养液于 5%的 CO2培养箱中培养。用脂质体lipofectamine™ 2000按说明书将 pAAV2neo-CAG-Gluc质粒转染Hepa 1-6细胞,用含G418(400 μg/mL) 的选择性培养基培养15 d,获得稳定表达Gluc的Hepa 1-6细胞 (Hepa 1-6/Gluc)。
1.3 细胞生长曲线和培养上清中 Gluc活性测定
取Hepa 1-6/Gluc细胞,接种于24 孔板,接种密度为5×103cell/孔,每天更换培养基。接种后1~8 d,每天取3孔细胞的培养上清,用PBS缓冲液稀释100倍后取2.5 μL使用Gaussia 荧光素酶检测试剂盒检测,按照说明书进行操作,使用发光检测仪收集 10s光信号并测定其相对光强度(Relative light units,RLU)。然后用胰蛋白酶消化上述3孔细胞,用血球计数板测定细胞数,并绘制细胞生长曲线。
1.4 脾注射法制备小鼠原位肝癌模型
取对数生长期的Hepa 1-6细胞,常规消化、吹打,尽量分散细胞。用 PBS缓冲液洗涤细胞两次,并计数,最终用 PBS缓冲液稀释成1×107cell/mL浓度的细胞悬液,置于4 ℃备用。取3~4周龄雄性C57BL/6小鼠,按照75 mg/kg剂量腹腔注射1%戊巴比妥钠麻醉。小鼠右侧卧位,固定于鼠板,常规消毒,于背侧中部、左侧腋中线与腋后线间剪开约0.5~0.8 cm左右切口,完全游离脾脏,用 30 G的胰岛素注射器吸取100 μL 的 Hepa 1-6 细胞悬液 (1×106cell),于脾脏上极沿脾脏纵轴进针,缓慢注入脾内,结扎脾蒂切除脾脏,全层缝合腹壁。
1.5 外周血Gluc活性检测
小鼠接种Hepa 1-6/Gluc细胞后,尾静脉采血2.5 μL,加入Gaussia 荧光素酶检测试剂盒中的底物50 μL,使用发光检测仪收集10s光信号并测定其相对光强度。
1.6 水动力法体内转染IFN-β基因和EGFP基因并检测其表达
取小鼠体重 10%的生理盐水,将 10 μg的pAAV2neo-CAG-IFN-β 或 pAAV2neo-CAG-EGFP溶于其中,并于5~7 s内经小鼠尾静脉快速注射入体内。尾静脉采血,分离血清,用 VeriKine-HS™ Human IFN-β ELISA检测试剂盒按说明书操作检测外周血 IFN-β水平。取小鼠肝脏制作冰冻切片,于荧光显微镜下观察 EGFP在肝脏的表达。
1.7 肿瘤大体和病理
小鼠接种Hepa 1-6/Gluc细胞后不同时间,观察肿瘤大体并照相,取肿瘤组织做石蜡切片,常规HE染色观察病理形态。
2 结果
2.1 Gluc标记的Hepa 1-6细胞的鉴定
通过G418筛选获得稳定表达Gluc的Hepa 1-6/Gluc细胞株,生长曲线 (图 1A) 显示 Hepa 1-6/Gluc细胞经历了潜伏期、指数生长期并进入平台期,细胞生长良好。24孔板中的细胞数目在8 d 的培养中从 (7.01±0.78)×103cell 增长至(1.15±0.15)×106cell,增殖了 164倍。细胞培养上清 Gluc检测结果显示 (图 1B),Gluc活性从(5.27±0.94)×104RLU 增长 至 (5.18±0.07)×106RLU,增长了98倍,Gluc监测曲线很好地体现出细胞生长的潜伏期、指数生长期和平台期;Gluc活性与细胞数两者均数之间具有极好的相关性 (R2=0.998) (图 1C)。以上结果说明,Gluc能可靠、灵敏地反映体外培养Hepa 1-6/Gluc细胞的数量和生长情况。
2.2 Gluc标记小鼠原位肝癌模型的建立
将 1×105、3×105、1×106、3×106和 1×107cell的 Hepa 1-6/Gluc细胞通过脾注射接种至C57BL/6小鼠 (n=4),在接种后2 h检测外周血Gluc活性,观察Gluc活性是否可靠反映接种细胞的数目。结果发现,1×105cell的Hepa 1-6/Gluc细胞接种即可在外周血检测到 Gluc的表达,Gluc活性随细胞接种量的增加而升高,1×107cell的细胞接种后可达到 (3.35±0.52)×104RLU;Gluc活性与接种细胞数具有很好的相关性(R2=0.925) (图 2A)。
然后观察了Hepa 1-6/Gluc细胞的成瘤性,1×106cell以上的Hepa 1-6/Gluc细胞脾注射均可造成 100%小鼠出现移植型肝癌。1×106cell的Hepa 1-6/Gluc细胞注射的小鼠在接种后5 d,肝表面出现肉眼可见的散在白色结节,多出现在肝缘部位。在接种后20 d,肝表面出现弥漫性的白色结节 (图 2B),除肝脏外,脾脏的注射部位也出现了白色结节 (图2B),其他脏器未见结节。

图1 Gluc标记的Hepa 1-6细胞 (Hepa 1-6/Gluc) 的鉴定Fig.1 Identification of the Gluc labeled Hepa 1-6 cell (Hepa 1-6/Gluc). (A) Growth curve of the Hepa 1-6/Gluc cell.(B) Time-course data of the Gluc activities in the Hepa 1-6/Gluc cell culture supernatants. (C) Correlation of the cell culture supernatant Gluc activity to the Hepa 1-6/Gluc cell number.
然后用1×106cell的Hepa 1-6/Gluc细胞脾注射制作了小鼠原位肝癌模型并检测了外周血Gluc活性的变化。由于Hepa 1-6/Gluc细胞在脾脏的生长会影响 Gluc监测肝脏肿瘤的准确性,因此我们在制作模型时将脾脏进行了切除。结果显示 (图 2C),接种 2 h后外周血 Gluc活性为(1.01±0.16)×104RLU,接种 1 d 后下降至(8.29±1.4)×103RLU,从接种2 d起Gluc活性出现指数级升高,在18 d时达到 (6.28±1.16)×106RLU,指数增长期一直持续至18~21 d,随后Gluc增长进入平台期。模型动物从23 d出现死亡,存活期为 (27.00±2.92) d。
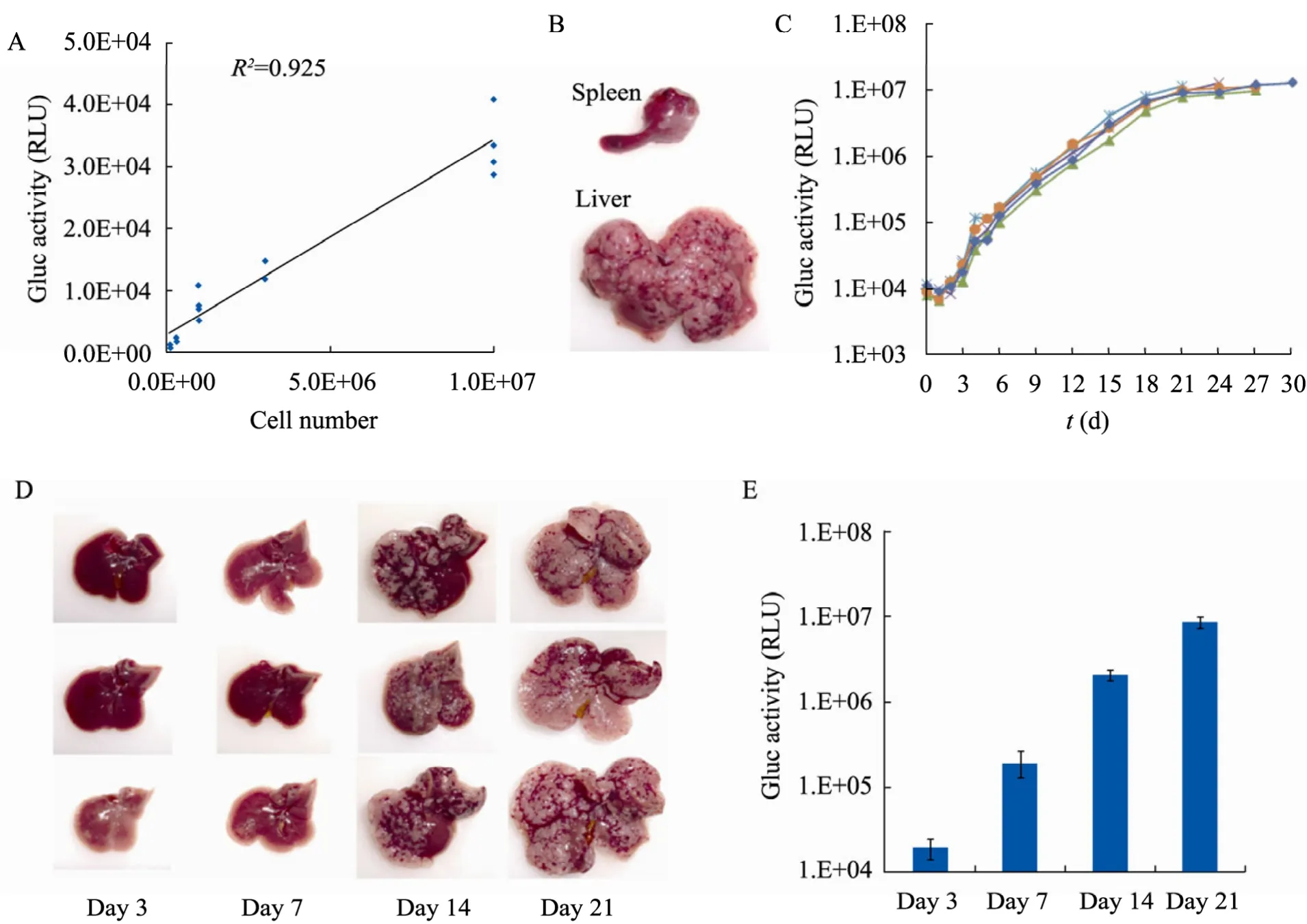
图2 建立Gluc标记的原位移植型肝癌模型Fig.2 Establishment of the Gluc labeled orthotopic transplant model of HCC. (A) Correlation of the blood Gluc activity to the inoculated Hepa 1-6/Gluc cell number (n=4). (B) Tumor mass in the spleen (upper) and the liver (lower)20 d after intrasplenic injection of Hepa 1-6/Gluc cells. (C) Time-course data of the blood Gluc activity in five independent mouse models. (D) Tumor mass in the liver on 3 d, 7 d, 14 d and 21 d after intrasplenic injection of Hepa 1-6/Gluc cells. (E) Blood Gluc activities on 3 d, 7 d, 14 d and 21 d after intrasplenic injection of Hepa 1-6/Gluc cells.
为了探讨外周血 Gluc水平能否反映肝脏肿瘤的生长情况,分别在1×106cell的Hepa 1-6/Gluc细胞接种后3 d、7 d、14 d和21 d,各取3只小鼠,观察肝脏肿瘤大体,与外周血 Gluc活性进行对比。结果显示 (图2D,E),在接种后3 d肝脏未形成明显结节,但肝脏表面尤其肝缘部位出现苍白色,外周血 Gluc值为 (1.90±0.50)×104RLU;接种后7 d肝脏表面出现十几个至数十个不等的白色结节,肝缘部位有少量结节汇合成片,外周血Gluc值为 (1.91±0.64)×105RLU;接种后14 d肝脏表面出现大量白色结节,50%以上汇合成片,外周血 Gluc值为 (2.02±0.37)×106RLU;接种后 21 d肝脏表面出现弥漫性白色结节,几乎不见正常肝组织,外周血 Gluc值为(8.79±1.27)×106RLU。上述结果显示,外周血Gluc活性随肿瘤的生长而升高,与肿瘤大体符合,可以客观反映肝脏肿瘤的生长情况。
2.3 利用Gluc实时监测肝癌模型对干扰素β基因治疗的反应
随后我们对建立的肝癌模型进行了干扰素β的基因治疗,小鼠接种 1×106cell的 Hepa 1-6/Gluc细胞后 5 d,通过尾静脉水动力注射10 μg的 pAAV2neo-CAG-IFN-β 质粒 (n=5) 和对照质粒 pAAV2neo-CAG-EGFP (n=5),探讨通过监测外周血 Gluc水平能否可靠反映抗肿瘤治疗的效果。
首先检测了EGFP和IFN-β在小鼠模型中的表达情况。水动力注射后24 h做肝脏冰冻切片,荧光显微镜观察后做HE染色区别肝组织和肿瘤组织。结果见图3A,HE染色显示在正常肝组织中出现数个肿瘤团块;荧光显微镜观察显示水动力注射造成约30%的肝细胞表达了EGFP,而所有肿瘤组织中未见绿色荧光。这说明水动力注射质粒至小鼠移植型肝癌模型能造成外源基因转导正常肝脏组织,而不能转导肝癌组织。小鼠模型水动力注射IFN-β表达质粒后24 h外周血中IFN-β 的检测值为 (3 362±605) pg/mL。
外周血Gluc监测结果 (图3B) 发现,Hepa 1-6/Gluc细胞接种后,外周血Gluc活性与先前的研究结果一致,1 d后出现轻度的下降,从 2 d起进入指数级的增长,在第5 d给予IFN-β基因治疗前 Gluc活性为 (8.17±1.89)×104RLU。EGFP对照组小鼠在质粒注射后,外周血 Gluc活性仍呈指数级增长,直至18~21 d进入平台期,随后出现小鼠死亡。与EGFP对照组相比,IFN-β注射组的3只小鼠在治疗后4 d出现Gluc活性的明显抑制,随后出现迅速下降,分别在21~24 d时降至阴性水平 (<300 RLU);IFN-β组的另2只小鼠 Gluc活性也出现一定程度的抑制,但仍持续升高,直至小鼠死亡。观察小鼠的生存情况(图3C) 显示,EGFP对照组小鼠在50 d的观察期内全部死亡,平均生存期为21.60 d;而IFN-β组存活率为60%,Gluc转阴的3只小鼠均未出现死亡,2只死亡小鼠的平均生存期为27.50 d,较对照组延长。治疗50 d后观察Gluc转阴的小鼠肝脏大体情况,发现肝脏肿瘤消失,肝组织HE染色未见肿瘤组织 (图3D)。IFN-β注射组中肿瘤获得清除的 3只小鼠治疗后 20 d外周血IFN-β 的检测值为 (2 475±589) pg/mL,而肿瘤持续生长的2只小鼠外周血IFN-β的检测值明显降低,分别为413 pg/mL和阴性 (<250 pg/mL),这可能是肿瘤生长造成正常肝细胞不能良好表达 IFN-β。上述结果说明,IFN-β基因治疗有效抑制了小鼠肝癌模型中肿瘤的生长,甚至可以完全清除肝癌细胞,外周血 Gluc活性灵敏可靠地反映了IFN-β的抗肿瘤治疗效果。
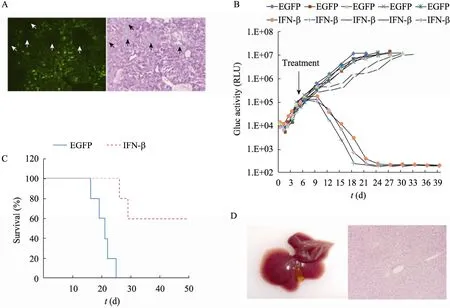
图3 利用Gluc监测肿瘤对干扰素β基因治疗的反应Fig.3 Using Gluc to monitor tumor response to the interferon-β gene therapy. (A) Expression of EGFP in the tumor and the liver for the mouse model hydrodynamic injection with EGFP expressing plasmid (arrows indicate tumors).(left) Fluorescence (100×), (right) HE staining (100×). (B) Blood Gluc activities for independent mouse models with hydrodynamic injection of IFN-β or EGFP expressing plasmid (n=5). (C) Survival curve in IFN-β treated mouse models vs EGFP control animals (n=5). (D) Liver mass (left) and HE staining (200×) (right) for IFN-β treated mouse models surviving beyond 50 d.
3 讨论
传统的原位移植型肝癌模型难以实现无侵入性的、实时连续监测体内肿瘤的生长情况,限制了对肿瘤发生、发展的研究和治疗效果的评价。利用荧光素酶标记肿瘤细胞并结合动物活体成像定位和监测肿瘤的生长可以一定程度解决这个困难,但需要注射底物和麻醉动物,并且光学信号需要透过组织得到接收,使得精确性较差[2-6]。目前仍需要更灵敏和更方便的方法实现体外监测动物模型体内肿瘤的生长情况。因此,本研究尝试以分泌型荧光素酶Gluc为报告基因,建立可以体外实时监测肿瘤生长情况的小鼠原位移植型肝癌模型。Gluc具有极高的灵敏度,较萤火虫荧光素酶和海肾荧光素酶灵敏2 000倍,较分泌型碱性磷酸酶灵敏20 000倍[1-3]。Gluc可以分泌入血,通过尾静脉微量采血测定 Gluc活性可以方便地监测体内生物学过程[2-3]。Gluc在血液中具有很短的半衰期 (大约20 min),不会随时间而积累,可以得到体内的实时信息[2-3]。Gluc已经开始用于体外监测体内生物学情况,比如实时监测小鼠肿瘤模型中肿瘤的生长[2-6]、小鼠体内基因表达[7-8]和肝脏miRNA活性[9]。
选择来源于 C57L小鼠的肝癌细胞系 Hepa 1-6作为肝癌模型的接种细胞。利用 Gluc标记Hepa 1-6细胞后,体外培养时细胞生长良好,培养上清中 Gluc活性可以灵敏可靠地反映细胞数量和细胞的生长情况。将1×106cell的Gluc标记Hepa 1-6细胞通过脾注射至C57BL/6小鼠肝脏成功造成了原位移植型肝癌模型。由于脾脏也出现了肿瘤结节,因此我们在脾注射后将脾脏进行了切除。研究发现,小鼠模型外周血 Gluc活性既能可靠反映体内接种的肿瘤细胞数量也能灵敏反映体内肿瘤的生长情况,Gluc活性与肿瘤的大体情况一致。我们成功利用 Gluc为报告基因建立了可以体外实时监测的小鼠原位移植型肝癌模型。
为证实外周血 Gluc活性能否反映抗肿瘤治疗的效果,我们通过水动力注射干扰素β表达质粒对小鼠肝癌模型进行基因治疗。干扰素是常用的抗肿瘤细胞因子,具有直接杀伤肿瘤细胞、免疫调节和抑制肿瘤血管生成的作用[10-12]。注射干扰素β可以抑制肝癌细胞的生长并且抑制肝癌的复发[13-14]。由于干扰素具有较高毒性,为实现在体内长期维持较低血药浓度,人们开始选择干扰素的基因治疗。利用腺相关病毒载体将IFN-β基因导入小鼠肝脏获得了长期低剂量表达IFN-β,成功预防和清除小鼠神经胶质瘤和黑色素瘤等肿瘤[15-16]。水动力注射法是简单高效的小鼠转导基因方法,转导的基因可以高效在肝脏表达[7-9,17-18]。本研究选择了水动力方法注射携带IFN-β基因质粒DNA至小鼠模型,进行IFN-β基因治疗。通过观察报告基因在肝脏和肿瘤的表达,我们证实水动力注射质粒至移植型肝癌模型可以造成外源基因转导正常肝脏组织,而不能转导肝癌组织。水动力注射IFN-β表达质粒后1 d,小鼠外周血即检测到IFN-β表达,在注射后20 d仍维持在较高水平,从而达到了长期低剂量的IFN-β治疗。小鼠模型给予IFN-β基因治疗获得成功,实验组60%的小鼠肿瘤得以完全清除。外周血Gluc活性监测显示治疗组小鼠Gluc活性均出现抑制,部分小鼠 Gluc出现下降,直至最终检测不到。肝脏大体和病理研究发现所有 Gluc阴性小鼠的肿瘤均得以完全清除。因此,外周血 Gluc活性可以灵敏可靠地反映IFN-β的抗肿瘤治疗效果。
本研究通过脾注射分泌型荧光素酶 Gluc标记的Hepa 1-6细胞在C57BL/6小鼠建立了原位移植型肝癌模型。通过检测外周血 Gluc水平可以体外实时定量监测体内肿瘤的生长情况并可以灵敏可靠地反映抗肿瘤治疗的效果。本方法具有方便、灵敏和实时监测的特点,实现了对单一动物个体的长期研究,有利于对肝癌的发生、发展以及抗肿瘤治疗效果的研究。
REFERENCES
[1] Tannous BA, Kim DE, Fernandez JL, et al.Codon-optimizedGaussialuciferase cDNA for mammalian gene expression in culture andin vivo.Mol Ther, 2005, 11(3): 435–443.
[2] Wurdinger T, Badr C, Pike L, et al. A secreted luciferase forex vivomonitoring ofin vivoprocesses. Nat Methods, 2008, 5(2): 171–173.
[3] Bovenberg MSS, Degeling MH, Tannous BA.EnhancedGaussialuciferase blood assay for monitoring ofin vivobiological processes. Anal Chem, 2012, 84(2): 1189–1192.
[4] Ellerkamp V, Armeanu-Ebinger S, Wenz J, et al.Successful establishment of an orthotopic hepatoblastomain vivomodel in NOD/LtSz-scid IL2Rγ null mice. PLoS ONE, 2011, 6(8): e23419.
[5] Chung E, Yamashita H, Au P, et al. Secreted Gaussia luciferase as a biomarker for monitoring tumor progression and treatment response of systemic metastases. PLoS ONE, 2009, 4(12):e8316.
[6] Inoue Y, Sheng F, Kiryu S, et al. Gaussia luciferase for bioluminescence tumor monitoring in comparison with firefly luciferase. Mol Imaging,2011, 10(5): 377–385.
[7] Tian WH, Wang G, Luo ST, et al. Real timeex vivodetection and dynamic monitoring ofin vivoexpression of secreted luciferase gene injected by hydrodynamic method. Chin J Biotech, 2009,25(10): 1552–1557.
田文洪, 王刚, 罗顺涛, 等. 体外实时动态监测水动力注射分泌型荧光素酶基因的表达. 生物工程学报, 2009, 25(10): 1552–1557.
[8] Luo ST, Tian WH, Wang G, et al. Comparison of TTR and CMV promotersin vivoandin vitrovia a secreted luciferase reporter system. Chin J Virol,2009, 25(6): 424–429.
罗顺涛, 田文洪, 王刚, 等. 用分泌型萤光素酶报告系统比较TTR启动子与CMV启动子的体内外表达特性. 病毒学报, 2009, 25(6): 424–429.
[9] Wang G, Dong XY, Hu JY, et al. Long-termex vivomonitoring ofin vivomicroRNA activity in liver using a secreted luciferase sensor. Sci China Life Sci, 2011, 54(5): 418–425.
王刚, 董小岩, 胡键阳, 等. 利用分泌型荧光素酶体外长期监测小鼠肝脏microRNA 活性. 中国科学: 生命科学, 2011, 41(4): 273–280.
[10] Johns TG, Mackay IR, Callister KA, et al.Antiproliferative potencies of interferons on melanoma cell lines and xenografts: higher efficacy of interferon β. J Natl Cancer Inst, 1992, 84(15):1185–1190.
[11] Sondak VK. How does interferon work? Does it even matter? Cancer, 2002, 95(5): 947–949.
[12] Dranoff G. Cytokines in cancer pathogenesis and cancer therapy. Nat Rev Cancer, 2004, 4(1): 11–22.
[13] Wang L, Tang ZY, Qin LX, et al. High-dose and long-term therapy with interferon-alfa inhibits tumor growth and recurrence in nude mice bearing human hepatocellular carcinoma xenografts with high metastatic potential. Hepatology, 2000, 32(1):43–48.
[14] Ikeda K, Arase Y, Saitoh S, et al. Interferon beta prevents recurrence of hepatocellular carcinoma after complete resection or ablation of the primary tumor-A prospective randomized study of hepatitis C virus-related liver cancer. Hepatology, 2000,32(2): 228–232.
[15] Streck CJ, Dickson PV, Ng CYC, et al.Adeno-associated virus vector-mediated systemic delivery of IFN-β combined with low-dose cyclophosphamide affects tumor regression in murine neuroblastoma models. Clin Cancer Res,2005, 11(16): 6020–6029.
[16] Streck CJ, Dickson PV, Ng CYC, et al. Antitumor efficacy of AAV-mediated systemic delivery of interferon-β. Cancer Gene Ther, 2006, 13(1):99–106.
[17] Liu F, Song Y, Liu D. Hydrodynamics-based transfection in animals by systemic administration of plasmid DNA. Gene Ther, 1999, 6(7):1258–1266.
[18] Kamimura K, Suda T, Zhang GS, et al. Advances in gene delivery systems. Pharmaceut Med, 2011,25(5): 293–306.
Application of secretary luciferase labeled orthotopic transplant model of hepatocellular carcinoma to evaluate tumor response to interferon-β gene therapy
Gang Wang1, Zhonghui Lian2, Wenhong Tian1,2, Xiaoyan Dong3,Jie Yuchi1, and Xiaobing Wu1,4
1Institute for Viral Disease Control and Prevention,Chinese Center for Disease Control and Prevention,Beijing100052,China
2School of Life Science,Jilin University,Changchun130012,Jilin,China
3Beijing Five Plus Molecular Medicine Institute,Beijing100176,China
4Beijing Yizhuang International Biomedical Investment & Management Co. Ltd.,Beijing100111,China
王刚, 连忠辉, 田文洪, 等. 建立分泌型荧光素酶基因标记的原位肝癌模型及用于干扰素β基因治疗评价. 生物工程学报, 2012, 28(10): 1236−1244.
Wang G, Lian ZH, Tian WH, et al. Application of secretary luciferase labeled orthotopic transplant model of hepatocellular carcinoma to evaluate tumor response to interferon-β gene therapy. Chin J Biotech, 2012, 28(10): 1236−1244.
Received:March 28, 2012;Accepted:May 19, 2012
Supported by:National Science and Technology Major Project (Nos. 2008ZX10002-023, 2012AA020810).
Corresponding author:Xiaobing Wu. Tel: +86-10-6352-3187; Fax: +86-10-6353-6871; E-mail: wuxb0168@vip.sina.com
国家科技重大专项 (Nos. 2008ZX10002-023,2012AA020810) 资助。