青花菜非对称体细胞杂交研究
戴永娟 ,和兆荣 ,胡靖锋 ,汪 骞 ,杨红丽 ,刁玉华 ,李春慧 ,和江明
(1.云南大学生命科学学院,云南 昆明 650091;2.云南省农业科学院,云南 昆明 650205;3.通海县经济作物工作站,云南 通海 652700)
青花菜(Brassica oleracea var.italica),又称西兰花,属十字花科(Cruciferae)芸薹属(Brassica L.)植物,食用部分为花球[1]。由于其柔嫩多汁、味道鲜美以及具有防癌抗癌等功效深受广大消费者的喜爱。但青花菜在生产中常常遭受病虫害的威胁,严重影响了产量和品质。青花菜新品种“优秀”是日本坂田公司育成的春秋两用的早熟青花菜新品种,具有早熟、长势旺、抗性强、花蕾细小浓绿、花球平滑、出口合格率高等特点,是目前比较理想的早熟型青花菜品种。但“优秀”是一个Ogura萝卜胞质雄性不育品种,不育性、不育率和不育度均为100%,利用常规杂交育种难以实现其核基因所控制的优异性状的转移。然而体细胞融合技术是实现这一转移的有效途径[2]。
自1960年Cocking[3]首创原生质体技术,20世纪70年代中期Kartha等[4]通过叶肉细胞形成愈伤组织和再生植株,Schenck[5]第一次报道成功获得B.oleracea和B.napa的体细胞杂种植株至今,芸薹属作物几乎所有种都可由原生质体培养获得再生植株[6]。在芸薹属内、芸薹属与近缘种之间有不少获得体细胞杂种的报道,同时非对称融合技术在芸薹属内也得到了快速发展及应用。非对称体细胞融合能够克服有性杂交的障碍,解决同源染色体的配对问题,实现核质和胞质的重新组合[7-8],而且形成的杂种通常只含有供体亲本的部分染色体,因此在提高杂种的育性及缩短育种年限等方面具有一定的优势。近年来国内外不少专家学者通过非对称体细胞杂交已经成功获得杂种植株[9-11]。笔者旨在通过非对称体细胞杂交途径,将“玉皇”可育的细胞质转移到“优秀”中,以期探索青花菜进行性状改良的途径,为实现品种改良提供可用的育种材料。
1 材料和方法
1.1 材料
“玉皇”为供体,“优秀”为受体(日本坂田公司)。
1.2 方法
1.2.1 原生质体制备 青花菜原生质体分离及纯化:分别取接种于MS培养基中光照培养5~6 d的“玉皇”、暗培养的“优秀”无菌苗下胚轴,碎解成1 mm左右的小段,按50粒种子1 mL酶液,于25℃黑暗条件下,摇床上30 r/min酶解12 h,酶液的配制参考Kao等[12]。酶解后用 45 μm孔尼龙网过滤酶解分离原生质体。将滤液移至离心管中,1 000 r/min离心5 min,弃上清,加入CPW-10洗液(27.2 mg/L KH2PO4、101 mg/L KNO3、246 mg/L MgSO4·7H2O、0.16 mg/L KI、0.025 mg/L CuSO4·5H2O、1 480 mg/L CaCl2·2H2O、10% 甘露醇,pH 5.8),离心清洗5 min,弃上清,重复2次。最后用原生质体培养基(PJ1)离心清洗1次,即可获得纯净的青花菜原生质体。将收集到的“优秀”,“玉皇”原生质体调浓度至(1~2)×106个/mL,分别用 0.05、0.075、0.10、0.15、0.20、0.25 J/cm剂量的UV射线照射“玉皇”下胚轴原生质体,然后分别用 10、20、30、40、50、60 μg/mL的罗丹明(R-6G)处理“优秀”下胚轴原生质体。处理方法参考侯喜林等[13]。
1.2.2 原生质体活力测定 伊文思蓝不为活原生质体吸收,而为死原生质体吸收,显蓝色的原生质体为无活力的。取0.5 mL纯化的原生质体,加入1~2滴0.3%的伊文思蓝染色液,染色2~3 min后,显微镜下观察,统计其存活率。重复3次,取其平均值进行统计。
存活率=(未染色的原生质体/观察的原生质体总数)×100%
1.2.3 原生质体的融合及培养 (1)正交试验优化培养基激素水平:选用6-BA、NAA、2,4-D激素浓度3个因素进行L9(34)正交试验,优化原生质体培养基激素水平(表1)。
(2)供、受体原生质体融合:将经过处理的供、受体原生质体,按1:1的比例混合(各约0.5 mL)。融合方法采用聚乙二醇(PEG)融合法[14],略作修改。加入PEG溶液0.425 mL(PEG-6000 250 g/L、Ca-Cl2·2H2O 1.025 g/L、甘露醇 45.5 g/L、山梨醇 45.5 g/L,pH 6.0)。然后再加入15%二甲基亚砜(DMSO)0.075 mL,室温下静置融合10 min。加入PEG洗液(PEG洗液A:甘氨酸7.5 g/L,pH 10.5;PEG洗液B:CaCl2·2H2O 14.7 g/L、甘露醇 91 g/L、山梨醇 91 g/L,pH 10.5),PEG 洗液 A、B 使用前按 1∶1 立即混匀。置30℃培养箱静置30 min,然后小心移除上清,加入 50 mmol/L CaCl2·2H2O,再次清洗 PEG,移除上清,用培养基(PJ1)清洗1次,最后每个培养皿加入2 mL(PJ1)进行融合原生质体的培养。

表1 原生质体培养基因素水平 (mg/L)
(3)融合体培养:25℃暗培养5~7 d,当观察到好的细胞分裂时,加入 0.5 mL 培养基(PJ2),3~5 d后,当观察到有小细胞团形成时,再加入0.5 mL培养基(PJ3),同时光照转为正常光照。此后每隔3 d加入1次培养基(PJ3),促使愈伤组织形成。同时以相同激素水平的培养基培养经UV处理过的“玉皇”原生质体,和经R-6G处理过的“优秀”原生质体作为对照。
1.2.4 愈伤组织分化与植株再生 当愈伤组织长到约5 mm大小时,将其转移至扩增培养基(PJ4),弱散射光下培养,促进芽生长。当幼苗的真叶形成时转移到无激素MS培养基中使再生植株正常生长。培养20 d左右,将正常生长植株转入生根培养基(PJ5)。原生质体培养、稀释、扩增和生根培养基的激素配比见表2。
2 结果与分析
2.1 UV射线对“玉皇”原生质体核失活的影响
从图1中可以看出,所有UV射线都会使原生质体的活力下降,并随着辐射剂量的加大,活力下降增多。与对照相比,除0.050 J/cm的处理外,其他处理剂量,原生质体活力下降都超过了50%,说明青花菜原生质体对UV射线处理较为敏感。对上述所设UV射线剂量处理的原生质体进行培养,培养2 d后,0.050~0.075 J/cm辐射的处理,原生质体均在培养中有细胞分裂,3~5 d开始第一次细胞分裂,培养13 d左右,倒置显微镜下可观察到细胞团,培养25 d左右可以发现肉眼可见愈伤组织或胚状体,但随着辐射剂量的加大,植板率明显下降。辐射剂量为0.15 J/cm,仅在培养中发现了少数几次细胞分裂,未见有细胞团形成。高于0.15 J/cm辐射处理的均未发现细胞分裂以及细胞团和胚状体的形成,试验采用剂量为0.10 J/cm。

表2 培养基的激素配比
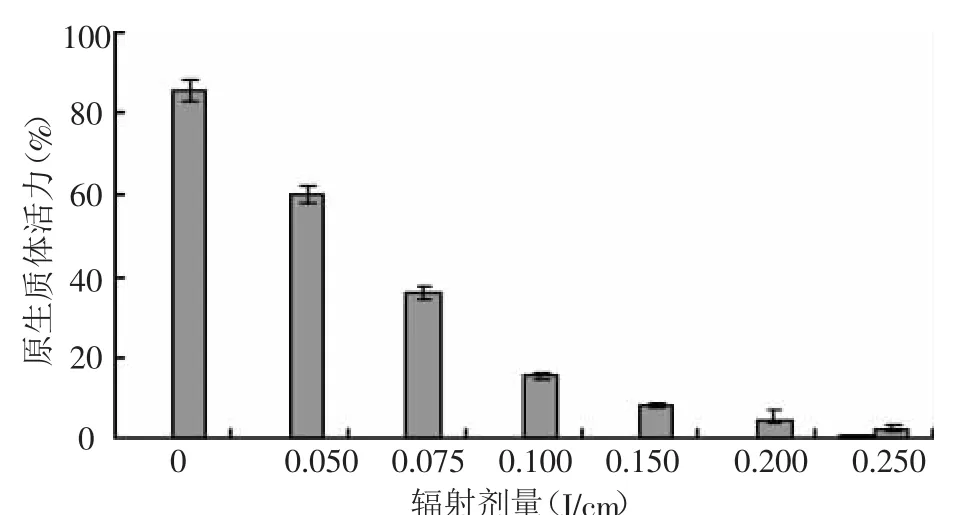
图1 UV射线对受体原生质体活力的影响
2.2 罗丹明(R-6G)对“优秀”原生质体失活的影响
如图2所示,罗丹明(R-6G)在10 μg/mL浓度下处理30 min(包括离心所用时间,25℃),“优秀”原生质体的植板率为14.6%;当浓度加倍为20 μg/mL时,植版率下降为6.7%;当浓度为50 μg/mL时,植板率为0。试验采用浓度为40 μg/mL,处理30 min。

图2 罗丹明(R-6G)对受体原生质体活力的影响
2.3 融合方法对原生质体融合率的影响
对比了姜淑慧等[14](方法1)、Ryshka[15](方法2)以及两种方法结和(方法3)对融合率的影响。方法1、2、3原生质体的融合率分别为 9%、12%、14%,方法3的融合效果要高于方法1和方法2。方法3的洗涤液中,不仅有Ca2+能够保证原生质体的质膜稳定,而且添加甘露醇能够保证稳定的原生质体渗透压。30℃培养箱中洗涤30 min,可以使原生质体膜融合更加充分。
2.4 不同激素组合对青花菜下胚轴原生质体培养的影响
采用正交试验,研究了不同激素组合对青花菜下胚轴原生质体培养的影响,结果如表3所示。对9个试验结果进行比较可以看出,组合4分裂频率最高,为 18.9%,为 A2、B1、C2。从表 3 中可以看出,极差值RA>RC>RB,说明6-BA激素水平变化对分裂频率的影响高于NAA、2,4-D。

表3 激素组合对原生质体分裂频率的影响
2.5 不同培养基对融合原生质体培养的影响
利用Km8p[16]改良的B5[17]以及笔者综合改良的培养基(PJ),3种培养基进行融合体培养的比较。结果表明同一激素水平下,笔者所采用的培养基融合体分裂频率相对较高,细胞团出现的时间相对较早,在进一步培养的过程中褐化程度相对较低(表4)。

表4 基本培养基对融合体的影响
2.6 融合体愈伤组织、胚状体的形成及植株再生
由于供体“玉皇”采用的是正常光照下培养的幼苗下胚轴作为原生质体分离材料,“优秀”采用的是暗培养的幼苗下胚轴,原生质体中不含有叶绿体。通过显微镜观察,结果如图3所示。融合体中含有不含叶绿体的融合,图3A为分离、纯化的原生质体;图3B说明供受体之间已发生融合;在融合体培养3~4 d发现细胞第一次分裂,6~7 d第二次分裂,12 d左右就可以观察到分裂形成的细胞团(图3C);18 d左右可以观察到胚体雏形(图 3D);25~30 d形成肉眼可见的愈伤组织或胚状体(图3E);当愈伤组织长到约5 mm时,转移愈伤组织到(PJ4)培养基促进芽生长;当幼苗的真叶形成时转移到无激素MS培养基中使再生植株正常生长,再将正常生长植株转入生根培养基中,促进再生植株生根(图3F、图 3G)。

图3 “优秀”、“玉皇”原生质体融合及再生植株
3 讨 论
笔者利用综合改进的PEG融合法将青花菜“玉皇”、“优秀”的原生质体进行融合,该方法明显提高了融合率。因为2种原生质体加入PEG融合液后,只发生粘连,在洗涤过程中才发生膜融合,核融合通常在第一次有丝分裂过程中发生[18],所以在加入PEG溶液使原生质体发生粘连后,洗涤过程才是是否发生融合的关键。
Km8p、B5是广泛运用于原生质体培养的培养基。近年来,在原生质体培养中也有很多在Km8p、B5的基础上通过改良得来的培养基[19]。笔者结合了Km8p的有机成分、B5的矿物质盐,利用甘露醇和山梨醇作为渗透压调节剂,以综合改进的培养基进行体细胞融合培养,进一步减少了培养过程中的褐化程度,提高分裂频率。在融合体培养过程中采用不断减小培养基渗透压的方法,减少了酚类物质对细胞的毒害作用。供受体材料分别用UV射线和罗丹明(R-6G)进行预处理,但处理剂量及浓度均小于原生质体失活的量,因为在处理过程中,细胞活力均会受到很大的影响,若均采用钝化剂量进行融合及培养,将会极大程度降低植板率。经过预处理作为对照培养的供、受体原生质体,在培养过程中很少发现有细胞分裂,未见有细胞团形成,继续培养1个月以后也未见愈伤组织或胚状体。由此再次说明,UV射线和罗丹明(R-6G)的处理抑制了供、受体原生质体的分裂和生长,融合后培养再生获得的愈伤组织和胚状体来源于融合细胞,再生植株能初步判定为杂种植株。
笔者在建立青花菜原生质体融合及培养的新体系的同时,还探究了原生质体融合、培养影响因素,获得了再生植株,并在原生质体融合初期及愈伤组织和胚状体形成时期进行了初步的杂种鉴定,为进一步分子细胞遗传研究,生物学鉴定工作提供了科学依据。
[1]陆信娟,杨 峰,樊继德.青花菜主要农艺性状的相关分析[J].江西农业学报,2011,23(1):49-51.
[2]惠志明.原生质体非对称融合向花椰菜转移Ougar萝卜胞质雄性不育性的研究[D].保定:河北农业大学,2002.
[3]Cocking E C.A method for the isolation of plant protoplast and Vacuoles[J].Nature,1960,187:962-963.
[4]Kartha K K,Michayluk M R,Kao K N,et al.Callus formation and plant regeneration form mesophyll protoplasts of rape plants(Brassica napus L.CV.Zphyr)[J].Plant science,1974,3(4):265-271.
[5]Schenck H R,Rbbelen G.Somatic hybrids by fusion protoplast form Brassica Oleracea and B.campestris [J].Can J Genet planzenz,1982,89:278-288.
[6]俞志华.芸薹属作物体细胞杂交研究[J].世界农业,1992,(5):17-19.
[7]丛建民,沈海龙,李玉花,等.植物体与植物体细胞无性系发育中的DNA甲基化及其表达调控研究进展 [J].安徽农业科学,2011,39(17):10170-10174,10196.
[8]Xie R,Yang Z L,Liu C Y,et al.RITSD analysis of the agronomic traits of somaclonal in rice[J].Agricultural Science&Technology,2010,11(1):36-41.
[9]周爱芬,夏光敏,陈惠民.普通小麦与簇毛麦不对称体细胞杂交的研究[J].中国科学,1996,26(1):31-37.
[10]Sjodin C,Glimelius K.Transfer of disease resistance within the genus Brassica through asymmetric somatic hybridization[J].Theor Appl Genet,1989,78:513-520.
[11]姚星伟,刘 凡,云兴福,等.非对称体细胞融合获得花椰菜与Brassica spinescens的种间杂种 [J].园艺学报,2005,32:1039-1044.
[12]Kao C M,.Keller W A,Gleddie S,et al.Efficent plant regeneration form hypocotyls protoplast of broccoli(Brassica oleracea L.ssp.italica Plenk)[J].Plant Cell Reports,1990,(9):311-315.
[13]侯喜林,曹寿椿,佘建明,等.碘乙酰胺和罗丹明对不接球白菜子叶原生质体线粒体失活效果的影响 [J].中国蔬菜,2002,(4):18-19.
[14]姜淑慧,管荣展,董海滨,等.播娘篙与甘蓝型油菜原生质体融合与植株再生[J].中国油料作物学报,2005,27(4):1-6.
[15]Ryshka U,Schumann G,Klocke E,et al.Somatic hybridization in Brassicaceae[J].Acta Hortic,1996,407:201-208.
[16]Kao K N,Michayluk M R.Nutrtional requirements for growth Vica hajastana cells and protoplast at a very low population density in liquid media[J].Planta,1975,126(2):105-110.
[17]Gamborg O L,Miuer R A,Ojima K.Naturient requirements of suspension cultures of soybean root cells[J].Exp cell Res,1968,50:151-158.
[18]梁 丹,丁 丹,王火旭.甘蓝与大白菜的原生质体融合[J].安徽农业科学,2009,37(8):3448-3449.
[19]侯喜林,曹寿椿,佘建明,等.不接球白菜原生质体培养再生植株[J].南京农业大学学报,2000,23(4):17-20.

