百合多糖的分离纯化及结构表征
吴 雄,何纯莲,陈 蓉
(湖南师范大学医学院,湖南 长沙 410006)
百合是传统药食兼用佳品,具有多种药理活性成分,其中多糖的含量高达6%[1]。现代医学研究表明百合多糖具有降血糖、抗肿瘤、抗氧化、抗疲劳、免疫调节等药理作用[2-6]。通过对百合多糖结构分析,从构效关系对百合多糖的药理活性进行系统研究,因此对百合多糖的纯化及结构表征具有重要的应用价值。
近年来国内外学者对百合多糖的研究已逐步开展起来,提取方法和条件已较为成熟,但是对其化学结构的研究仍然比较少,大多数对百合多糖的研究报道缺乏详尽的结构信息。本文采用水提醇沉,Sevag试剂脱蛋白法[7]得到百合多糖粗品;采用DEAE-52纤维素柱层析[8-9]、Sephadex G-100凝胶层析[10]纯化分离得到三种多糖,并应用HPLC法[11]对其分子量进行测定、应用红外光谱分析法[12]对其结构进行表征,旨在为百合多糖药理活性的深入研究和功能性食品的开发提供理论基础。
1 材料与方法
1.1 主要仪器与试剂
紫外可见分光光度计(北京莱伯泰科仪器有限公司,BlueStar);高效液相色谱仪 (日本岛津,LC-2010A HT);蒸发光散射器(天津埃文森科技有限公司,ELSD800);傅里叶红外光谱仪(北京第二光学仪器厂,WQF-310)。 百合 (湖南省龙山县提供);DEAE-52 纤维素 (Whatman);Sephadex G-100(Pharmacial);甲醇(色谱纯);咔唑、半乳糖醛酸标准品、葡萄糖标准品、无水乙醇、95%乙醇、冰醋酸、无水乙醚、丙酮、氯仿、正丁醇、苯酚等均为国药集团化学试剂。
1.2 百合多糖的提取分离纯化
1.2.1 百合多糖粗品提取工艺
新鲜百合→洗净切碎、称重→水提取→离心、过滤→4℃醇沉过夜→离心、过滤→复溶→Sevag法脱蛋白→ 醇沉、过滤→无水乙醇、无水乙醚、丙酮洗涤→烘干、得多糖粗品。
1.2.2 DEAE 52-纤维素柱层析
采用2.0×55cm层析柱,填料高度35cm,上样浓度8mg/mL,用250mL去离子水、250mL0.04MNaCl溶液、300mL0.1MNaOH溶液依次进行洗脱,10mL每管收集洗脱液。用苯酚-硫酸法在490nm下测定收集样中的糖含量,作出洗脱曲线图。根据洗脱曲线图,将各洗脱峰样品收集合并,经浓缩、透析后,加乙醇至70%沉淀后过滤得到三种多糖,烘干备用。
1.2.3 百合多糖的Sephadex G-100柱层析纯化
百合多糖I:采用2.0×55cm层析柱,填料高度36.5cm,流速 3min/ml,5ml每管收集;上样百合多糖I,用0.1M NaCl溶液进行洗脱。百合多糖II:采用1.0×58cm层析柱,填料高度33cm,流速2min/ml,3ml每管收集;上样百合多糖 II,用 0.1M NaCl溶液进行洗脱。百合多糖III:采用2.0×55cm层析柱,填料高度38cm,流速3min/ml,5ml每管收集;上样百合多糖III;用0.1M NaCl溶液进行洗脱。用苯酚-硫酸法在490nm下进行检测,以洗脱管数为横坐标,吸光值为纵坐标作图。
1.3 百合多糖理化性质及红外、紫外分析
1.3.1 理化性质分析
溶解性:取少量多糖样品于10mL的水、热水、乙醇、丙酮等溶剂中,2h后观察其溶解情况。
碘-碘化钾反应:于百合多糖溶液((1mg/mL)中加人碘-碘化钾溶液,观察颜色变化。以蒸馏水作阴性对照,淀粉溶液(1mg/mL)作阳性对照。
糖醛酸含量分析:采用咔唑-硫酸法测定多糖中糖醛酸含量。取8支具塞比色管,各加入12ml浓硫酸,置于冰水浴中,冷却依次加入浓度为0μg/mL、10μg/mL、20μg/mL、30μg/mL、40μg/mL、50μg/mL、60μg/mL、70μg/mL 的半乳 糖醛 酸标准 溶液2mL,充分混合后,再置冰水浴中冷却。然后在沸水浴中加热10min冷却到室温,各加入0.15%咔唑无水乙醇溶液lmL,摇匀,在室温下暗处放置2h,测定吸光度(A),建立线性回归方程,取样品液1mL,用同样的方法进行测定,通过线性计算糖醛酸含量。
1.3.2 红外分析
1.3.3 紫外分析
1.4 百合多糖分子量的测定
采用高效液相色谱法(HPLC)对百合多糖I、II、III进行分子量的测定。 色谱柱为TSK gelG2000SWXL柱,以超纯水为流动相,流速1.0mL/min,进样量 10μL。
建立回归方程:将系列葡聚糖标准品6000,11800,37500,112000,212000,402000 分 别配成浓度为0.2%的溶液,以1gMr(分子量对数)对TR(保留时间)绘制标准曲线,得到线性回归方程,计算其分子量。
2 结果
图1为百合多糖的DEAE52-纤维素柱洗脱曲线,用250mL去离子水洗脱得百合多糖I,后用250mL 0.04mol/L NaCl洗脱得百合多糖II,再用300mL 0.1mol/L NaOH洗脱得到百合多糖III。
2.1 百合多糖的分级纯化
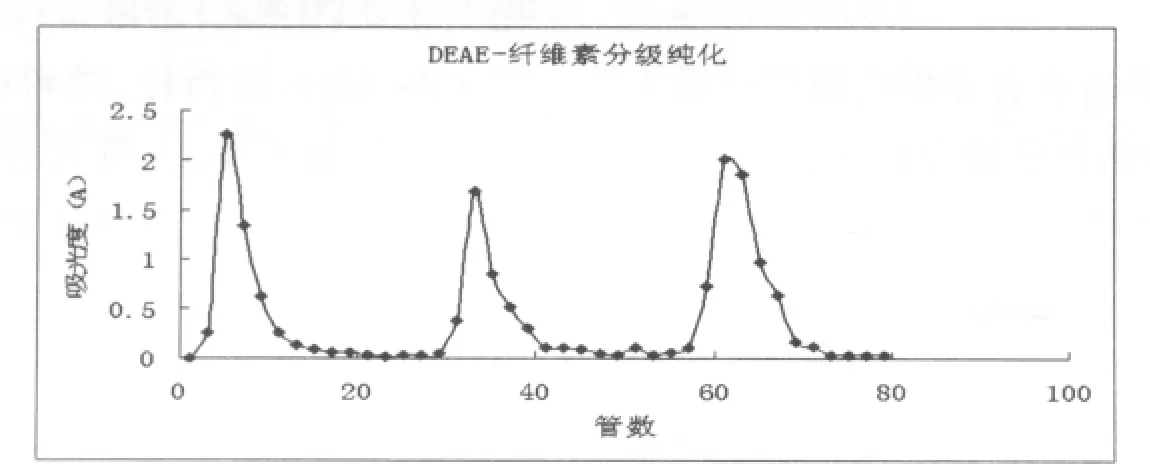
图1 百合多糖的DEAE52-纤维素柱洗脱曲线
由图 1 可知, 水、0.04mol/L NaCl、0.1 mol/L NaOH的洗脱曲线均为单一峰形,分别收集各洗脱峰主峰位置的洗脱液。重复上样,将收集到的样品浓缩、醇沉,获得多糖样品。
2.2 百合多糖的葡聚糖纯化
下图为经葡聚糖柱洗脱后所得三种多糖的葡聚糖G-100洗脱曲线
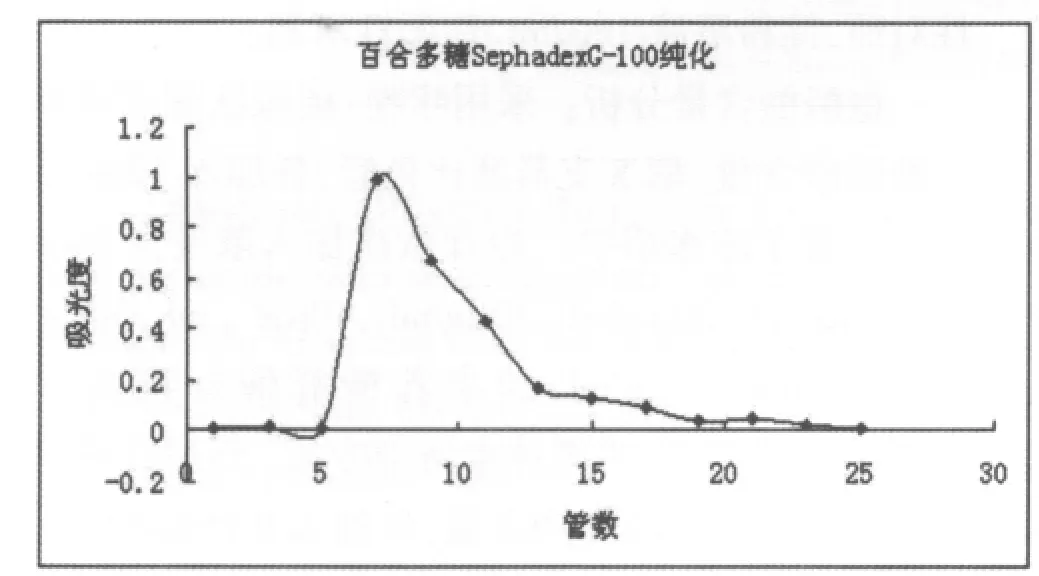
图2 百合多糖Ⅰ的葡聚糖G-100洗脱曲线
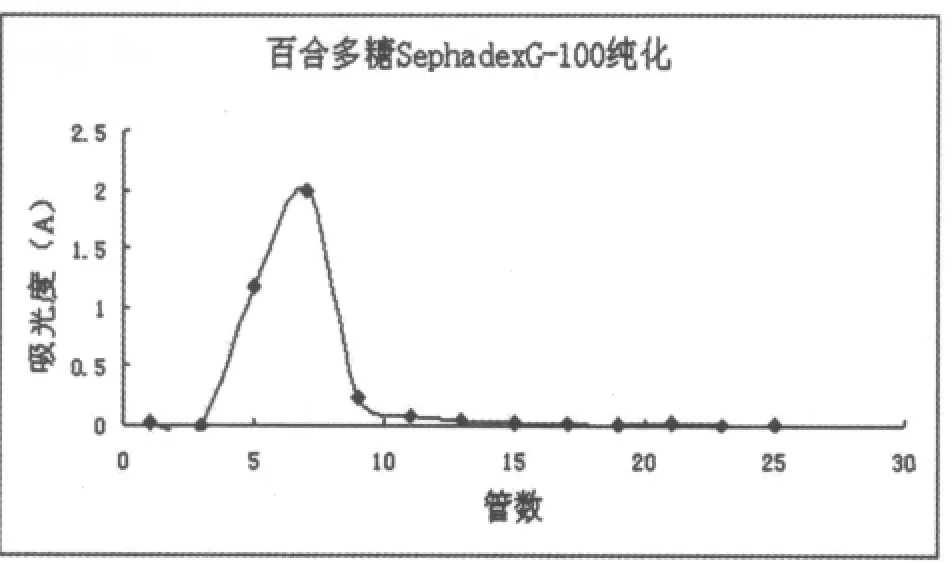
图3 百合多糖Ⅱ的葡聚糖G-100洗脱曲线
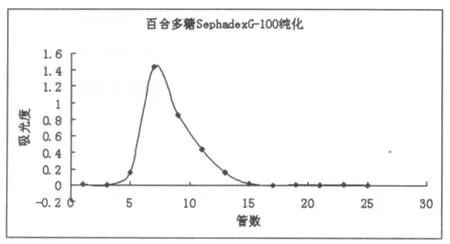
图4 百合多糖Ⅲ的葡聚糖G-100洗脱曲线
由图2、3、4可知,三条洗脱曲线均为单一峰形,分别收集各洗脱峰主峰位置的洗脱液浓缩、醇沉得百合多糖纯品。
2.3 理化性质
百合多糖I为浅黄色晶体,硬度高,不易吸潮,不溶于冷水和乙醇、乙醚等有机溶剂,微溶于热水。碘-碘化钾测试成阴性,说明不含淀粉。由表1咔唑-硫酸法测定其糖醛酸含量为13.64%。
百合多糖II为浅黄色晶体,硬度略低于百合多糖I,不易吸潮,不溶于乙醇、乙醚等有机溶剂,微溶于冷水,易溶于热水。碘-碘化钾测试成阴性,说明不含淀粉。由表1咔唑-硫酸法测定其糖醛酸含量为10.98%。
百合多糖III为浅黄色粉末,易吸潮,不溶于乙醇、乙醚等有机溶剂,易溶于冷水,尤其易溶于热水。碘-碘化钾测试成阳性,说明含淀粉。由表1咔唑-硫酸法测定其糖醛酸含量为14.55%。
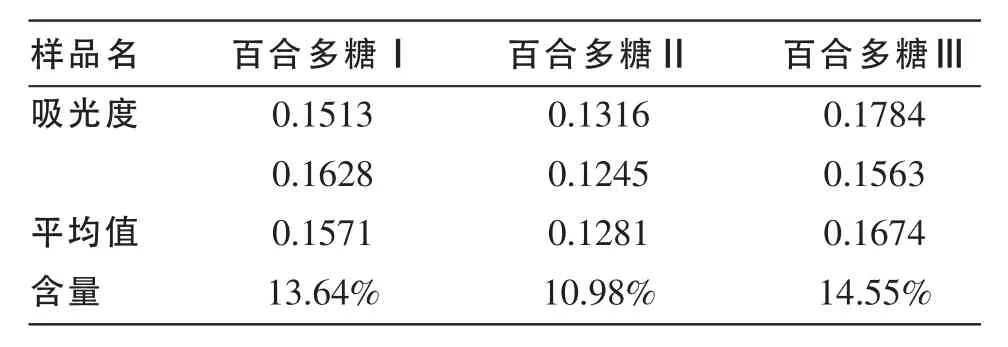
表1 百合多糖中糖醛酸含量
2.4 红外光谱分析
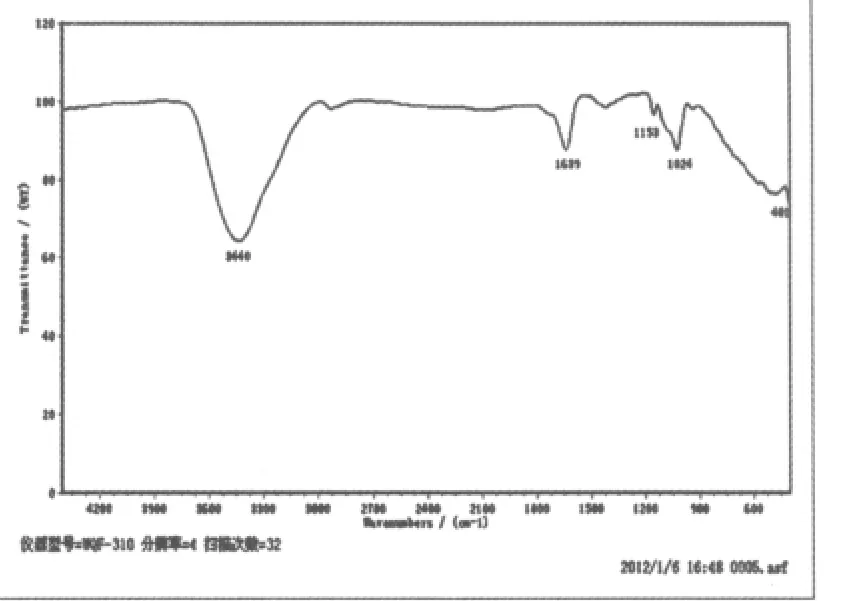
图6 百合多糖Ⅱ红外图谱
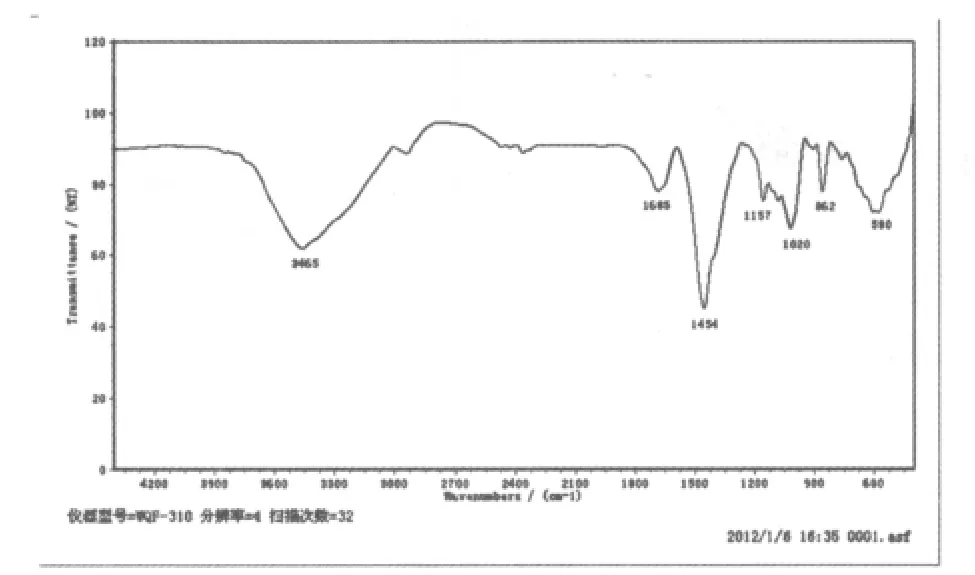
图7 百合多糖Ⅲ红外图谱
从图5可以看出百合多糖I在3456cm-1处为-OH伸缩振动的吸收峰;1651cm-1处为C=O非对称伸缩振动吸收峰;1100-11200 cm-1处有三个峰,为吡喃糖的特征吸收峰,则1024cm-1处为吡喃糖环的醚键C-O-C和-OH的变角振动的吸收峰。在700-1000 cm-1的吸收峰则是α-和β-吡喃单糖形成的特征吸收峰,则810cm-1,876cm-1处均为甘露糖残基吸收峰。
从图6可以看出百合多糖II在3440cm-1处为-OH伸缩振动的吸收峰,1639cm-1处为C=O非对称伸缩振动吸收峰,1100-1200 cm-1处只出现两个峰,为呋喃糖苷的特征吸收,1153 cm-1,1024cm-1处为呋喃糖环的醚键C-O-C和-OH的变角振动的吸收峰。900-100cm-1处的小峰为=C-H面外弯曲振动峰,1400-1485cm-1处不明显的峰为C-H面内弯曲振动峰。
从图7可以看出百合多糖III在3465cm-1处为-O-H伸缩振动的吸收峰,1454 cm-1处为C-H变角振动吸收峰,1685cm-1处为C=O伸缩振动吸收峰,是糖醛酸的特征吸收峰,也可能是有少量蛋白的残留。1100-1200 cm-1处有明显可见的三个峰,则1157 cm-1,1020cm-1处为吡喃糖环的醚键CO-C和-OH的变角振动的吸收峰,在700-1000 cm-1的吸收峰则是α-和β-吡喃单糖形成的特征吸收峰,862cm-1处的吸收峰是甘露糖残基吸收峰。
2.5 紫外光谱分析
多糖在190nm-200nm有一溶剂峰,无核酸(260nm)、蛋白质(280nm)特征峰,说明多糖中不含蛋白质和核酸成分。
2.6 百合多糖相对分子量的测定
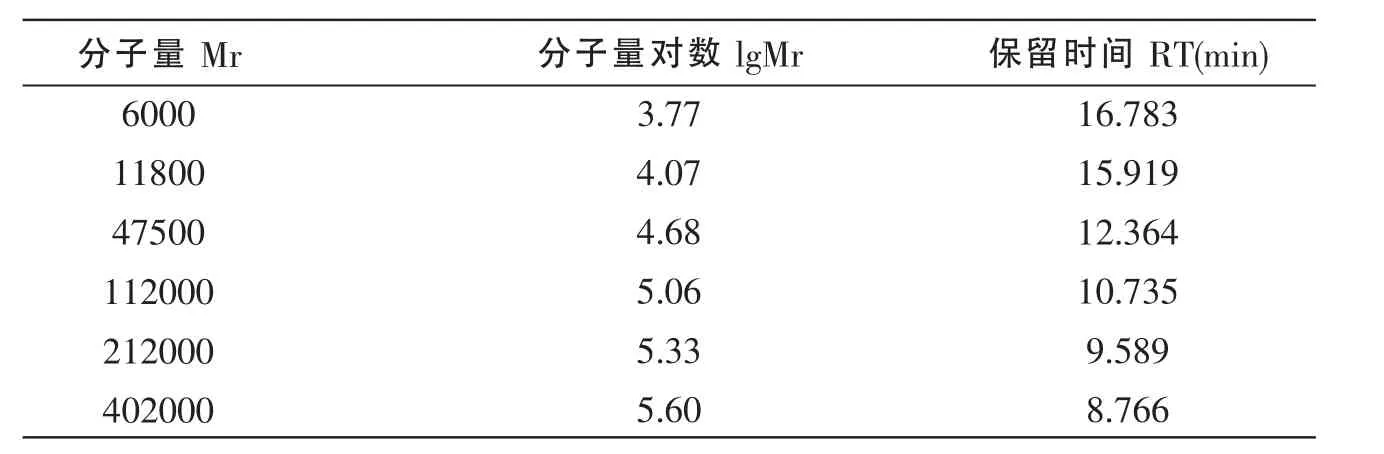
表2 不同分子量葡聚糖标准品的保留时间
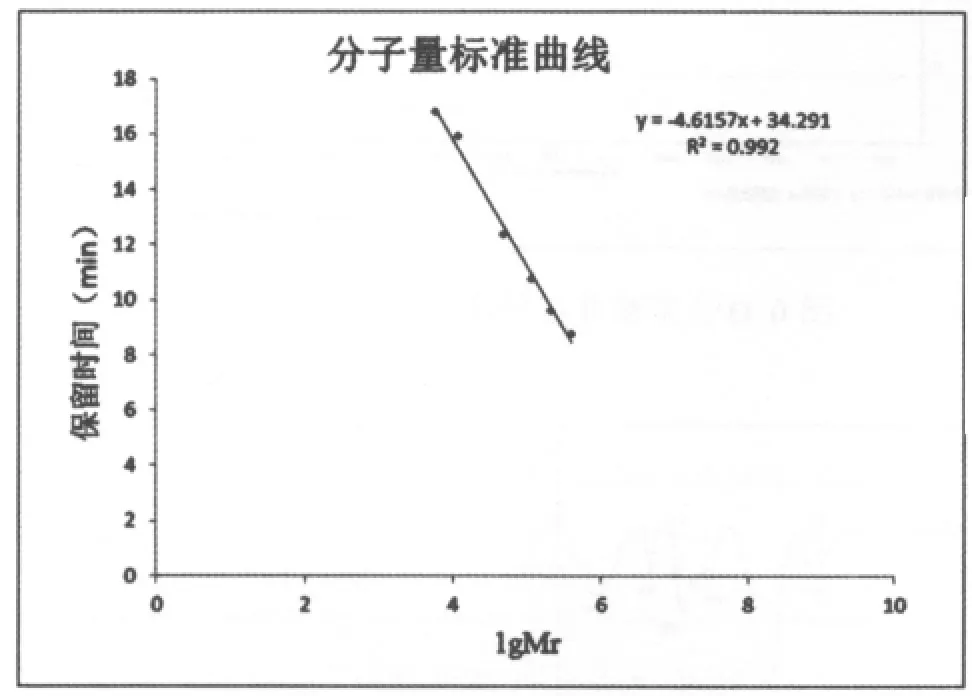
图8 分子量标准曲线图
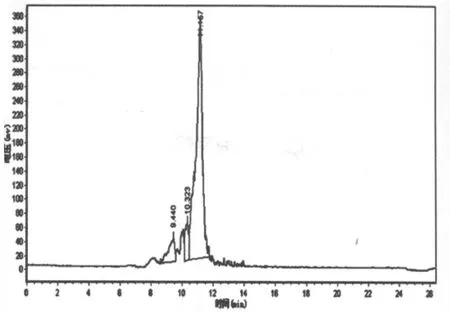
图9 百合多糖Ⅰ的液相图谱
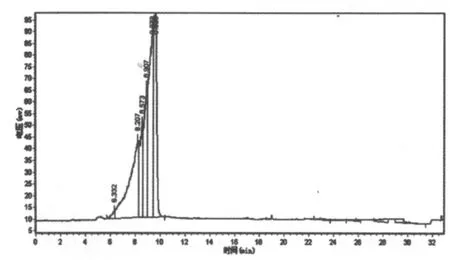
图10 百合多糖Ⅱ的液相图谱
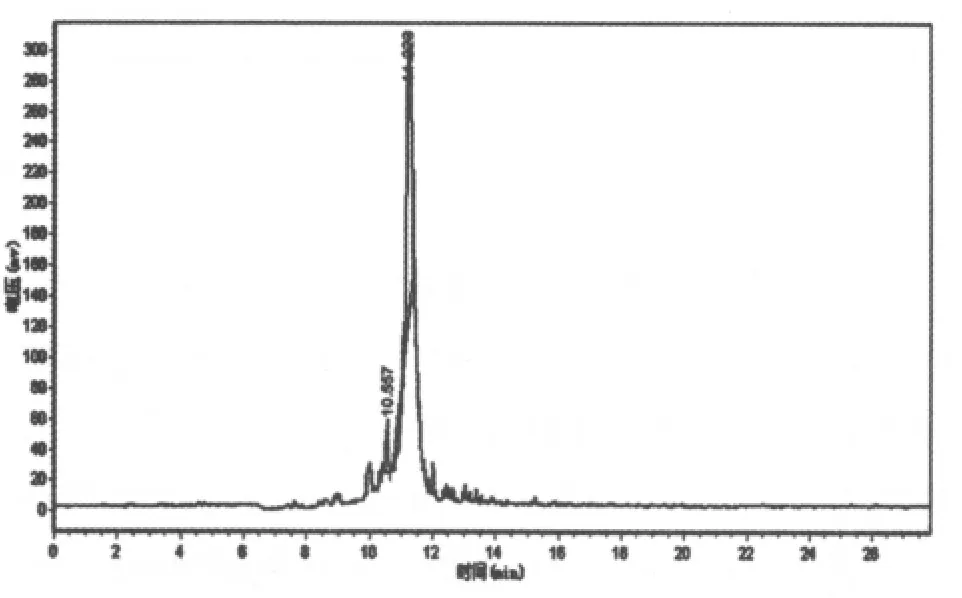
图11 百合多糖Ⅲ的液相图谱
由图9可知,百合多糖I有三个峰,且峰形有所重叠,说明多糖中由不同分子量的糖组成,且分子量比较接近而无法完全分开。三个峰的保留时间依次为 9.440,10.323,11.157,其中第 1、2 峰的峰面积较小,含量较低,故忽略不计。以11.157为该多糖的分子量计算,带入标准曲线中可得百合多糖I的分子量为97672。
由图10可知,百合多糖II有五个主峰,峰面积相近,且峰形重叠,表明分子量范围比较接近而无法完全分开,因此该多糖的分子量为一定范围内的数值。五个峰的保留时间依次为8.207,8.573,8.907,9.273,9.623,带入标准曲线中计算可得百合多糖II的分子量范围为219927-465232。
由图11可知,百合多糖III有二个峰,其保留时间依次为10.557,11.223,其中第1个峰的峰面积较小,故忽略不计。以11.223为该多糖的分子量计算,带入标准曲线中可得百合多糖III的分子量为94321。
3 讨论
采用水提醇沉得到的粗多糖,经DEAE 52-纤维素柱层析、Sephadex G-100凝胶柱层析分离纯化得到三种多糖。对纯化后的多糖进行理化性质的初步鉴定,发现百合多糖I为浅黄色晶体,不溶于冷水和乙醇、乙醚等有机溶剂,微溶于热水;不含淀粉;糖醛酸含量为13.64%;百合多糖II为浅黄色晶体,不溶于乙醇、乙醚等有机溶剂,微溶于冷水,易溶于热水;不含淀粉;其糖醛酸含量为10.98%;百合多糖III为浅黄色粉末,易吸潮,不溶于乙醇、乙醚等有机溶剂,易溶于冷水和热水;含淀粉;糖醛酸含量14.55%。
采用HPLC测量多糖分子量,显示百合多糖I的平均分子量为97000,百合多糖II的平均分子量范围220000-465000,百合多糖III的平均分子量94000。
红外光谱表征显示三种多糖都有-OH、C=O、C-O-C等多糖的特征吸收。
[1]张慧芳,蔡宝昌,张志杰,等.食用百合与药用百合的成分比较[J].中医药学刊,2006,(3):436-437.
[2]王慧芳,董玉山,喇万英.药食两用中药降血糖作用研究进展[J].中国煤炭工业医学杂志,2010,13(5):820-821.
[3]张典,弥曼,姜凤良,等.百合多糖对人肝癌HePG2细胞CyclinD1和COX-2的影响[J].细胞与分子免疫学杂志,2011,27(5):582-584.
[4]曾明,陈娟,汪波.兰州百合粗多糖抗氧化作用研究[J].卫生职业教育,2011,29(2):97-98.
[5]何纯莲,杨小红,黄浩,等.百合多糖的抗疲劳作用[J].湖南师范大学学报(医学版),2009,6(3):9-11.
[6]李新华,弥曼,李汾.百合多糖免疫调节作用的实验研究[J].现代预防医学,2010,37(14):2708-2709.
[7]周静华,万顺康.大理百合多糖的醇沉分离工艺及脱蛋白方法[J].食品研究与开发,2010,31(12):7-9.
[8]林卓坤.色谱法(一)[M].北京:科学出版社.1982,42-54
[9]Liu C,Fu G,Tu Z,et al.Functional polysaccharide from lilies[J].Transactions Of The ASAE,2005,48(1):257-261.
[10]王璞,林红,朱滨.凝胶过滤层析实验中Sephadex的溶胀与回收保存[J].实验技术与管理,2006,23(2):24-25.
[11]韩振泰,赵玉娟,刘惠文,等.高效液相色谱法测定灵芝多糖含量[J].中国农业科技导报,2009,11(S1):65-67.
[12]张惟杰主编.糖复合物生化研究技术(第二版).[M]浙江大学出版社.1999,193-198.

