比索洛尔对急性心肌梗死大鼠梗死周边区心肌组织中KCNE1和KCNE2表达的影响
刘旭帮,张丽华,李小威,牛少辉
郑州大学第二附属医院心血管内科 郑州 450014
急性心肌梗死(acute myocardial infarction,AMI)后室性心律失常是AMI早期严重的并发症和猝死的主要原因。心肌梗死后心律失常的发生机制尚不完全清楚,但是AMI后梗死周边区存活的心肌离子通道的电重构是心律失常发生的主要机制。研究[1]发现 KCNE基因家族成员中 KCNE1、KCNE2主要在心肌表达,作为β-亚单位与电压依赖性钾离子通道α-亚基形成完整的钾通道复合体并对其进行调节,稳定细胞膜电生理特性。另有研究[2]表明KCNE基因表达异常可导致心肌细胞电通道功能障碍,诱发各种恶性心律失常。作者观察了AMI后梗死周边区心肌组织中KCNE1、KCNE2 mRNA和蛋白表达的变化及β受体阻滞剂比索洛尔对上述指标表达的影响,为研究抗心律失常作用提供理论基础。
1 材料与方法
1.1 材料 健康清洁级SD大鼠,体质量200~250 g(郑州大学实验动物中心)。富马酸比索洛尔(5 mg/片,批号 105832,商品名康忻,Merck KGaA 公司);RNAiso Plus、RT-PCR试剂盒(北京全式金生物科技有限公司);兔抗鼠KCNE1一抗(Santa Cruz公司);兔抗鼠KCNE2一抗(Chem Icon公司);辣根过氧化物酶标记的羊抗兔二抗(北京中杉金桥生物技术有限公司)。小动物呼吸机(HX-300S,成都泰盟科技有限公司);生物信号采集分析系统(ASB240U,遨生电子有限公司)。
1.2 动物模型的制备、分组与处理 SD大鼠用100 g/L水合氯醛(35 mg/kg)腹腔注射麻醉后仰卧位固定,气管插管并连接小动物呼吸机及生物信号采集系统,标准肢体导联Ⅱ动态监测心电图。于胸骨左缘外四、五肋间心脏搏动最强处纵行切开皮肤,止血钳依次分离各层组织至肋骨,充分暴露心脏,在左心耳和肺动脉锥间距主动脉根部约2~3 mm处用6.0无创伤缝线穿过冠状动脉左前降支(left anterior descending of coronary artery,LAD)并结扎。结扎后,前壁心肌组织由鲜红色迅速变为暗红色,逐渐变为苍白,心电图监测肢体导联ST段较前上抬>0.2 mV为心梗模型制作成功。关闭胸腔后逐层缝合组织。术后存活的40只大鼠,按照随机数字表法分为AMI 24 h组、1周组、4周组和比索洛尔组,每组10只。假手术组于LAD下穿过缝合线,不结扎,余操作同AMI各组。假手术组大鼠共30只,随机分配到上述3个时间点,每个时间点10只。比索洛尔组给予比索洛尔0.5 mg/(kg·d)灌胃给药4周,其余各组给予等量生理盐水。术后于各时间点以100 g/L水合氯醛麻醉大鼠后迅速开胸取出心脏,用生理盐水冲洗后速取心梗区周围组织均分为2份,液氮中保存备用。
1.3 KCNE1,KCNE2 mRNA 表达的检测 采取RT-PCR法。取心肌标本组织约100 mg,加入液氮完全研碎。按试剂盒说明提取RNA,逆转录为cDNA。KCNE1上游引物:5’-GGCAGGAAACAGATGAGC-3’, 下 游 引 物:5’-GTGAAGAAGCCGAAGAAAC-3’;KCNE2 上游引物:5’-CACTTTAGCCAACTTGACGC-3’,下游引物:5’-ATACTTCTGCTGCCAATCCT-3’(北京赛百盛生物技术有限公司合成),扩增产物分别为127和283 bp;β-actin上游引物:5’-CCCATCTATGAGGGTTAC-3’,下游引物:5’-GGAAGGTGGACAGTGAG-3’,扩增产物为568 bp。PCR扩增体系:取逆转录产物2 μL,上、下游引物各 1 μL,酶缓冲液 5 μL,dNTPs 4 μL,Taq 酶0.5 μL,补水到50 μL。扩增条件:94 预变性2 min;94℃变性30 s,55℃退火30 s,72℃延伸2 min,共30个循环;72℃延伸6 min。取PCR产物,用20 g/L琼脂糖凝胶电泳,全自动凝胶成像分析系统对凝胶成像,Quantity One软件分析后分别计算KCNE1,KCNE2与 β-actin灰度值的比值代表其相对表达量。
1.4 KCNE1、KCNE2蛋白表达的检测 采用Western blot法。取心肌标本组织约100 mg剪切成小块,加入1 mL的全蛋白提取液匀浆15 min,4℃、14000 r/min 离心 20 min,取上清 20 μL,根据标准曲线计算出蛋白浓度,其余上清中按照1∶4加入上样缓冲液,100℃加热5 min。100 g/L SDS-PAGE凝胶电泳分离KCNE1,KCNE2蛋白,50 g/L脱脂奶粉封闭,弃去封闭液后,加入一抗,弃去一抗后,用TBS洗涤10 min,共3次。弃去TBS,加入二抗,37℃孵育1 h后弃去二抗,用TBS洗涤10 min,共3次。采用增强化学发光法显影,将胶片扫描后用 Bandscan5.0软件进行灰度分析。
1.5 统计学处理 应用SPSS 17.0处理数据,定量资料用¯x±s表示,各组间mRNA及蛋白的表达采用单因素方差分析和SNK-q检验,检验水准α=0.05。
2 结果
假手术24 h组、1周组及4周组大鼠左心室相应部位心肌组织KCNE1、KCNE2 mRNA及蛋白均有表达,但各组间差异无统计学意义(mRNA:F=2.980和 0.070,P=0.068 和 0.993;蛋白:F=0.802和0.115,P=0.459 和 0.891),故以假手术 4 周组用于比较分析。各组大鼠梗死周边区心肌组织中KCNE1、KCNE2 mRNA和蛋白的表达水平见图1、2及表1。

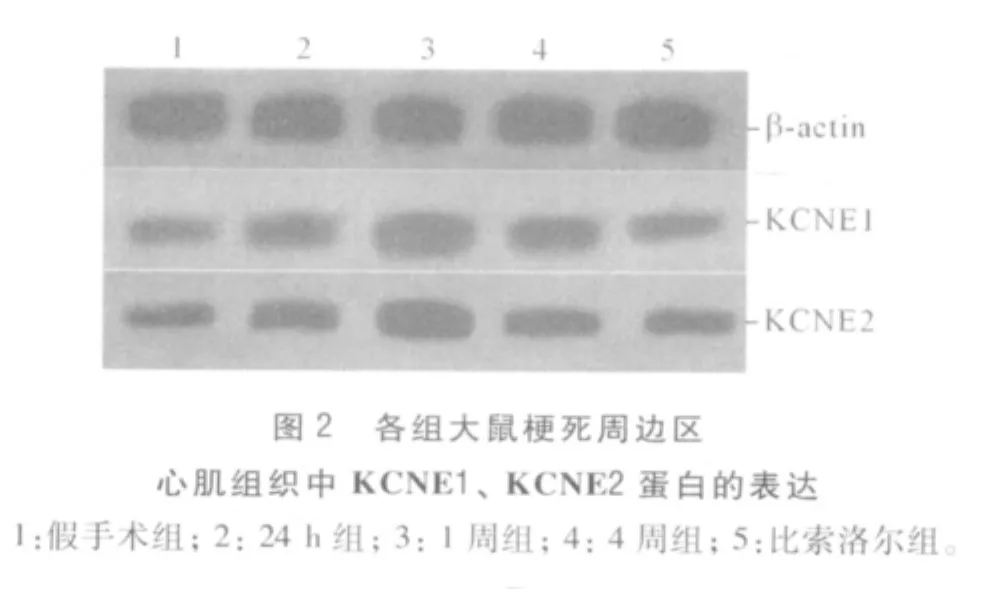
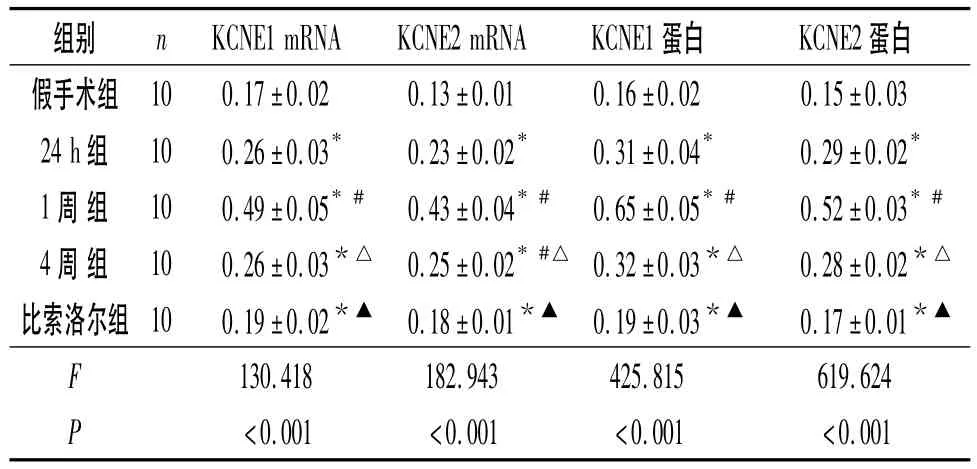
表1 各组大鼠梗死周边区心肌组织中KCNE1、KCNE2 mRNA和蛋白的表达
3 讨论
AMI后梗死周边区心室肌细胞动作电位时程(action potential duration,APD)缩短,延迟整流钾通道电流(delayed rectifier potassuim current,IK)密度增加以及心脏起搏通道(HCN)电流增加可能是心肌梗死后易发生心律失常的离子机制之一。Bendahhou等[3]的研究证实,将 KCNE1 与 KCNQ1、HERG(α-亚基)在体外进行共同表达,发现KCNE1使全细胞的电流密度升高,通道整体电导增加,电压依赖性增强,慢激活的IK和快激活的IK增加,最终导致平台期缩短,3相复极加速,APD时程缩短,进而诱发心律失常。KCNE2基因编码的 β-亚单位(MiRP1蛋白)参与HCN阳离子通道的构成并对其进行调节。有研究[4]报道KCNE2表达的增加伴随HCN电流增快,与心律失常密切相关;研究[5]也证实了在病理状态下,HCN通道与心律失常有关。
该研究发现,AMI后梗死周边区心肌组织KCNE1、KCNE2 mRNA和蛋白表达量明显升高,在心肌梗死1周,二者升至峰值,与已有研究[6]AMI 1周各种室性心律失常发生率最高相符。推测缺血心肌组织中KCNE1和KCNE2的表达上调,可能引起相应离子通道的动力参数发生改变,从而导致心肌细胞异常复极和自律性改变,诱导梗死后心律失常的产生;同时还可能通过肾上腺系统和肾素血管紧张素系统及内皮素、缺氧等多种刺激因素调节[7]。β受体阻滞剂如比索洛尔具有抗交感神经活性、下调血管紧张素Ⅱ水平等多种抗心律失常作用。该研究结果显示,AMI后4周,比索洛尔组和4周组KCNE1、KCNE2的表达虽高于假手术组,但比索洛尔组低于4周组,提示比索洛尔可抑制AMI后梗死周边区心肌组织KCNE1和KCNE2表达的上调,可能是其抗心律失常的机制之一。
[1]McCrossan ZA,Lewis A,Panaghie G,et al.MinK-related peptide 2 modulates Kv2.1 and Kv3.1 potassium channels in mammalian brain[J].J Neuro Sci,2003,23(22):8077
[2]Tsuji Y,Zicha S,Qi XY,et al.Potassium channel subunit remodeling in rabbits exposed to long-term bradycardia or tachycardia:discrete arrhythmogenic consequences related to differential delayed rectifier changes[J].Circulation,2006,113(3):345
[3]Bendahhou S,Marionneau C,Haurogne K,et al.In vitro molecular interactions and distribution of KCNE family with KCNQ1 in the human heart[J].Cardiovasc Res,2005,67(3):529
[4]Brandt MC,Endres-Becker J,Zaqidullin N,et al.Effects of KCNE2 on HCN isoforms:distinct modulation of membrane expression and single channel properties[J].Am J Physiol Heart Circ Physiol,2009,297(1):H355
[5]Plotnikov AN,Bucchi A,Shlapakova I,et al.HCN212-channelbiologicalpacemakersmanifesting ventricular tachyarrhythmias are responsive to treatment with I(f)blockade[J].Heart Rhythm,2008,5(2):282
[6]夏爽,张玉,邓松柏,等.大鼠缺血心肌中 KCNE1,KCNE2基因表达的变化[J].第四军医大学学报,2009,30(24):2974
[7]Mustapha Z,Pang L,Nattel S.Characterization of the cardiac KCNE1 gene promoter[J].Cardiovasc Res,2007,73:82

