哮喘小鼠肺和下丘脑组织中γ-氨基丁酸受体ARα的表达
朱亚蕊,刘剑波
郑州大学第二附属医院呼吸内科 郑州 450014
γ-氨基丁酸(γ-aminobutyric acid,GABA)是哺乳动物重要的抑制性神经递质之一,在中枢神经系统分布广泛,也存在于气道平滑肌细胞及气道上皮细胞等周围组织[1]。根据受体对激动剂和拮抗剂的敏感性,GABA受体可以分成 GABAAR、GABABR和GABACR 3种。GABAAR属受体门控离子受体超家族,α亚单位在GABAAR复合物的组装和功能中可能起主要作用[2]。GABAAR和GABA合成酶(GAD65/67)在支气管上皮细胞中均有表达,组成了完善的GABA系统。已有研究[3-4]表明,过敏性哮喘时GABA系统功能增强,雾化吸入GABAAR拮抗剂可抑制哮喘气道黏液分泌,抑制气道重塑。气道杯状细胞增生是哮喘的主要病理特征,MUC5AC是在气道杯状细胞表达的一种主要黏蛋白,反映了气道黏液分泌情况[5]。作者对哮喘小鼠肺组织和下丘脑内GABAARα、肺组织中MUC5AC进行了检测,旨在从分子水平探讨哮喘小鼠肺和脑组织中GABAARα的变化及其与气道黏液分泌的关系。
1 材料与方法
1.1 实验分组 6周龄清洁级雌性BALB/C小鼠30只,购于河南省实验动物中心,体质量(20±2)g,按随机数字表法分为3组,对照组、哮喘组、地塞米松组,每组10只。实验第1天和第8天,哮喘组和地塞米松组小鼠腹腔注射卵蛋白(OVA)/Al(OH)3混合液 1 mL(含 OVA 1 mg和 Al(OH)3100 mg,OVA购于Sigma公司)致敏,从实验第15天开始以用10 g/L OVA雾化吸入30 min/d激发,连续7 d。对照组致敏与激发均以生理盐水代替,地塞米松组在激发前腹腔注射地塞米松1 mg/kg。
1.2 标本的采集和处理 末次激发后24 h,水合氯醛腹腔注射麻醉小鼠,将生理盐水注入右心室冲洗2次以洗尽肺和脑内血液。暴露胸腔,切取左肺叶近肺门组织,多聚甲醛固定5~6 h后,转入体积分数70%乙醇,常规石蜡包埋切片备用。切取右肺叶迅速放入液氮中,速冻后转移至-80℃保存备用。打开颅腔,迅速取出全脑组织置于冰台上,分离出下丘脑,一侧放入甲醛,一侧速冻后放入-80℃冰箱保存备用。
1.3 肺组织病理学观察 取肺组织切片,常规HE染色,中性树胶封片,光学显微镜下观察组织形态、气道上皮损伤、气管及血管周围嗜酸性粒细胞浸润情况。
1.4 肺组织糖原(PAS)染色观察 将肺组织切片放入高碘酸水溶液氧化5 min,蒸馏水浸洗后在Schiff液中浸泡10~20 min,蒸馏水洗后用无水乙醇脱水,中性树脂封片,观察。
1.5 肺组织和下丘脑组织中GABAARα mRNA、肺组织中MUC5AC mRNA的检测 根据GenBank中GABAARα、MUC5AC和GAPDH的基因序列设计引物。MUC5AC引物序列:上游 5’-CAGCCGAG GAGGGTTTGATCT-3’,下 游 5’-AGTCTCTCTC CGCTCCTCTCAAT-3’,扩增产物大小 349bp。GABAARα 引物序列:上游 5’-TGGGAAGAA CAAATCTGTGG-3’,下 游 5’ -GTAGCCTTGGGT GAAGCAAT-3’,扩增产物大小636 bp。GAPDH引物序列:上游 5’-TCTTGGGCTACACTGAGGAC-3’,下游 5’-CATACCAGGAAATGAGCTTGA-3’,扩增产物大小126 bp。取约100 mg组织标本加液氮研磨后加入1 μL Trizol试剂(北京鼎国昌盛生物技术有限公司),参照说明提取总RNA,取4 μL逆转录合成cDNA。以2 μL cDNA为模板,行PCR扩增。扩增条件:94℃预变性2 min;94℃变性30 s,53℃(GABAARα和GAPDH)或52℃(MUC5AC)退火30 s,72℃延伸2 min,共30个循环;72℃总延伸6 min。取5 μL扩增产物行琼脂糖凝胶电泳,溴化乙啶显色,在紫外线投射仪下观察电泳条带,用D-140图像记录分析系统进行分析。以目的基因和β-actin扩增条带的灰度值之比表示目的基因mRNA的相对表达量。
1.6 肺和下丘脑组织中GABAARα蛋白的检测采用免疫组化SP法。小鼠抗GABAARα单克隆抗体(按50倍稀释)购自北京博奥森生物技术有限公司,SP试剂盒和DAB显色试剂盒购自北京中杉金桥生物技术服务有限公司。切片常规脱蜡水化,微波抗原修复,用体积分数3%H2O2除去内源性氧化酶,余步骤按试剂盒说明书进行。GABAARα蛋白染色阳性信号为棕黄色颗粒。用彩色图像分析系统测定5个200倍视野的光密度,取其平均值,表示目的蛋白表达强度。
1.7 统计学处理 采用SPSS 17.0进行分析。3组肺和下丘脑组织中GABAARα蛋白和mRNA的表达量、肺组织中MUC5AC mRNA表达量的比较采用单因素方差分析和LSD-t检验,哮喘组肺与下丘脑组织中GABAARα mRNA表达、GABAARα蛋白表达及肺组织中GABAARα与MUC5AC mRNA表达的关系分析采用Pearson相关分析,检验水准α=0.05。
2 结果
2.1 3组小鼠肺组织病理学表现 对照组小鼠气道黏膜正常,气道周围无炎性细胞浸润,肺泡壁结构完整;哮喘组小鼠气道黏膜充血水肿,黏膜层增厚,支气管壁及血管壁周围有较多炎症细胞浸润;地塞米松组黏膜水肿及炎症细胞浸润较哮喘组减轻。见图1。
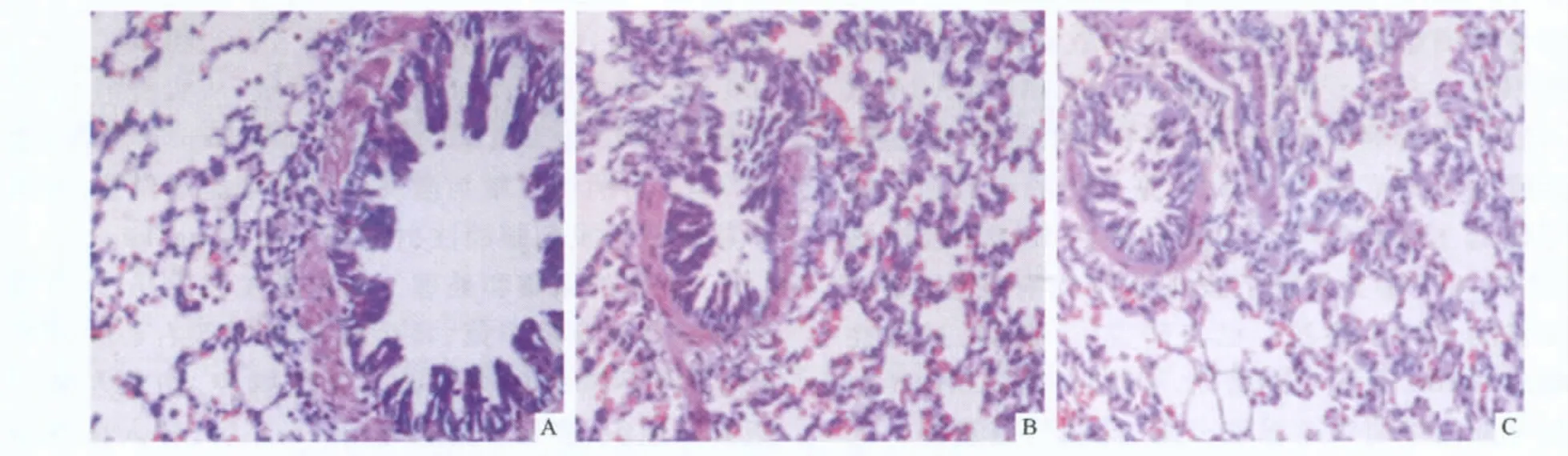
图1 3组小鼠肺组织病理学表现(HE,×200)
2.2 3组小鼠气道PAS染色情况 对照组可见气管及各级支气管黏膜纤毛柱状上皮细胞形态完整,在纤毛间极少见杯状细胞,肺泡大小正常。哮喘组、地塞米松组支气管、亚段支气管、细支气管管壁可见大量染成紫红色的杯状细胞;支气管黏膜上皮局部剥脱,黏膜下明显水肿;黏膜层、黏膜下层及肌层有嗜酸性粒细胞、淋巴细胞及浆细胞浸润;支气管管腔内分泌物增加,部分可见淋巴细胞。地塞米松组上述表现较哮喘组明显减轻。见图2。
2.3 3 组小鼠肺组织中 GABAARα、MUC5AC mRNA及GABAARα蛋白的表达 见图3和图4。肺组织中GABAARα蛋白主要表达于气道上皮,在基底部无表达,阳性表达产物定位于细胞膜。哮喘组小鼠肺组织 GABAARα、MUC5AC mRNA及GABAARα蛋白表达量较对照组增高,地塞米松组 较哮喘组明显降低,但仍高于对照组(表1)。
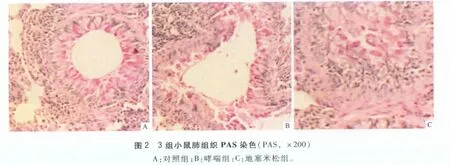



表1 3组小鼠肺组织GABAARα、MUC5AC mRNA及GABAARα蛋白的表达
2.4 3组小鼠下丘脑组织中GABAARα mRNA和蛋白的表达 见图3和图5。GABAARα蛋白在下丘脑组织中主要表达于神经元胞质、胞膜和凸起,胞核无染色。哮喘组小鼠下丘脑组织中GABAARα mRNA和蛋白的表达较对照组明显增高。地塞米松组小鼠下丘脑组织中GABAARα mRNA和蛋白的表达较哮喘组降低,但与对照组比较,两者的表达水平仍较高(表2)。
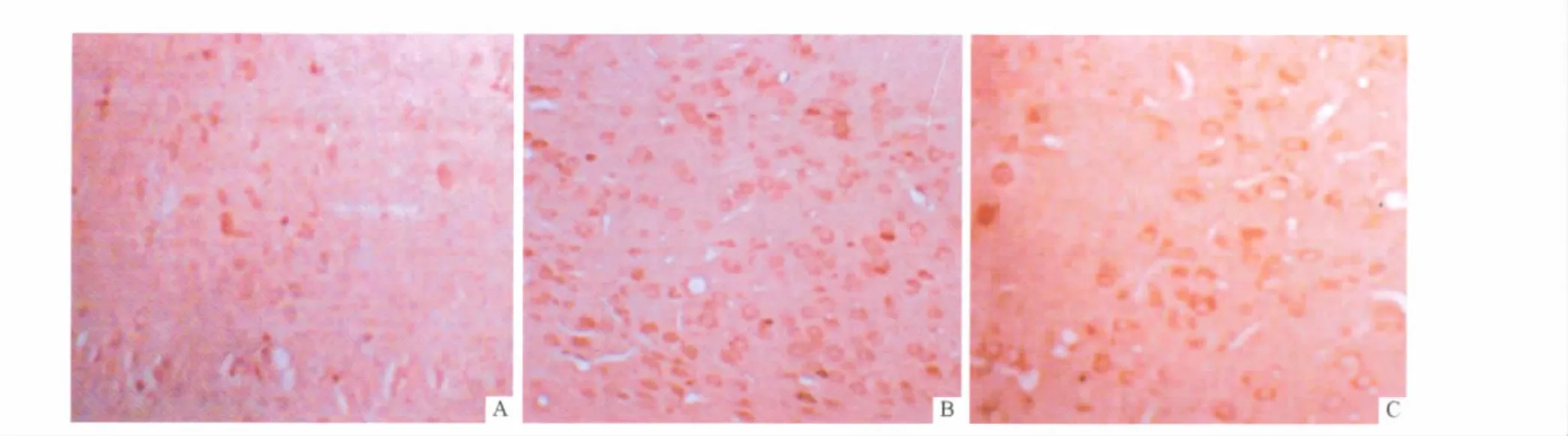
图5 3组小鼠下丘脑GABAARα蛋白的表达(SP,×200)
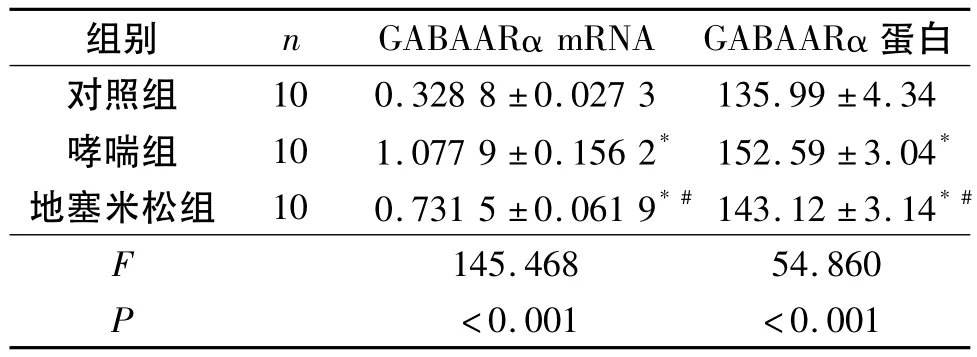
表2 3组小鼠下丘脑GABAARα mRNA和蛋白的表达
2.5 哮喘组小鼠各指标之间相关性分析 哮喘组小鼠肺组织GABAARα与MUC5AC mRNA的相对表达量呈正相关(r为 0.814,P=0.004)。哮喘组小鼠下丘脑与肺组织中GABAARα mRNA的相对表达量、蛋白表达水平均呈正相关(r分别为0.740、0.791,P 分别为 0.014、0.006)。
3 讨论
过敏性哮喘是有多种细胞和细胞成分参与的气道慢性炎症,发病机制不完全清楚。中枢神经系统在哮喘发作中发挥重要作用,有学者[6]提出了哮喘发病的中枢致敏机制及中枢免疫调节机制。下丘脑是边缘系统的重要核团,是免疫和应激反应的重要整合中枢[7],可直接或间接参与气道张力和过敏反应的调控[8]。作者观察到,哮喘小鼠下丘脑GABAARα蛋白表达增强,这就增加了GABA与其受体结合的机会,增强了GABA的抑制作用,表明GABA可能是参与哮喘病理生理过程的重要中枢性神经递质之一,进一步证实中枢神经系统在哮喘病理生理过程中发挥作用。哮喘小鼠脑组织中GABA受体增加的机制可能是:由于血清中增高的IL-13、IgE、IL-5等炎症因子通过血脑屏障到达中枢系统,或通过哮喘激发时由于缺氧或紧张导致神经兴奋上传到中枢,使中枢神经系统炎症因子增多,导致GABA受体增加。哮喘发作时机体处于一种应激状态,下丘脑-垂体-肾上腺轴(HPA轴)兴奋,大脑兴奋性神经递质大量释放,为平衡兴奋性神经递质,抑制性神经递质GABA释放亦增多,GABA受体表达上调是一种中枢神经保护机制。
气道黏液过度分泌是重症哮喘的特征之一。研究[9]表明 GABA系统和黏液分泌关系密切,阻断GABAAR后能够抑制哮喘急性发作期的黏液分泌和杯状细胞增生。该研究结果表明,过敏性哮喘小鼠被OVA激发后气道上皮细胞GABAAR mRNA表达增多,气道杯状细胞增生,MUC5AC mRNA表达亦增强,两者具有相关性。研究[10]证实,GABAAR的运输及细胞表面靶作用由PI3K调节,其可被不同的信号活化,包括胰岛素、生长因子及白介素。哮喘患者T细胞可产生大量白介素如IL-4、IL-13、IL-5、IL-10等,这些白介素可能通过活化上皮细胞的PI3K/Akt通路激发神经元细胞后突触区GABAAR[11],通过 GABA 引起气道黏液的大量分泌。
作者还观察到,地塞米松组小鼠肺和脑组织中GABAARα、肺组织中MUC5AC的表达均较哮喘组低,说明地塞米松治疗哮喘的机制包括抑制炎症因子释放,下调肺组织和脑组织GABA受体的表达,减轻黏蛋白的分泌。哮喘小鼠下丘脑与肺组织中GABAARα的表达均呈正相关,提示GABA系统可能与哮喘的中枢神经调节有关,但肺和脑组织中GABA的具体信号传导机制及脑内其他神经递质的变化还有待进一步研究。
[1]Fu XW,Wood K,Spindel ER.Prenatal nicotine exposure increases GABA signaling and mucin expression in airway epithelium[J].Am J Respir Cell Mol Biol,2011,44(2):222
[2]Fritschy JM,Mohler H.GABAA-recepter heterogeneity in the adult rat brain:Differential regional and cellular distribution of seven major subunits[J].J Comp Neurol,1995,359(1):154
[3]徐传芹,郑玉龙,程伟.GABA和一叶秋碱对哮喘小鼠肺功能和黏液的影响[J].中国现代医学杂志,2009,19(23):3541
[4]任旭斌,刘春涛,朱涛.荷包牡丹碱对哮喘小鼠肺组织α-SMA及气道重构的影响[J].四川大学学报:医学版,2010,41(4):626
[5]刘剑波,张珍祥,徐永健,等.地塞米松对哮喘小鼠肺组织MUc5ac mRNA和蛋白表达的影响[J].郑州大学学报:医学版,2004,39(4):610
[6]Mazzone SB,Canning BJ.Central nervous system control of the airways:pharmacological implications[J].Curr Opin Pharmacol,2002,2(3):220
[7]Cullinan WE.GABAAR receptor subunit expression within hypophysiotropic CRH neurons:a dual hybridization histo-chemical study[J].J Comp Neurol,2000,419(3):344
[8]Van Oosterhout AJ,Nijkamp FP.Anterior hypothalamic lesions decrease anaphylactic contractions in guinea pig trachea in vitro by reducing histamine and LTC4 reactivity[J].Int J Immunopharmacol,1986,8(8):975
[9]刘剑波,张珍祥,徐永健,等.白细胞介素13对小鼠支气管哮喘模型肺组织钙激活的氯通道gob-5和黏蛋白基因MUC5AC表达的作用[J].中华结核和呼吸杂志,2004,27(12):837
[10]Serantes R,Arnalich F,Figueroa M,et al.Interleukin-1beta enhances GABAA receptor cell-surface expression by a phosphatidylinositol 3-kinase/Akt pathway:relevance to sepsis-associated encephalopathy[J].J Biol Chem,2006,281(21):14632
[11]Lu WY,Inmany MD.γ-aminobutyric acid nurtures allergic asthma[J].Clin Exp Allergy,2009,39(7):956

