灯盏细辛对大鼠肾冷缺血再灌注损伤的保护作用
杨铁军,何朝宏#,曹新广,任君凯,陈小兵,王 跃
1)河南省肿瘤医院;郑州大学附属肿瘤医院泌尿外科 郑州 450008
2)郑州大学第一附属医院器官移植中心 郑州 450052
肾移植手术过程中,冷灌注、冷保存及复流热灌注等损伤因子对移植肾造成的冷缺血再灌注损伤(ischemia and reperfusion injury,IRI)无法避免,是影响移植肾功能恢复的重要因素。目前临床已应用一些防治IRI的药物,但是效果均不十分理想,且昂贵。灯盏细辛又名灯盏花,属菊科短亭飞蓬属植物。已有文献[1-2]证实其对脑、心等脏器的IRI具有保护作用。作者模拟临床肾移植术中移植肾经历的IRI过程,建立大鼠冷IRI模型,观察灯盏细辛对冷IRI导致的肾脏组织超微结构、功能和生化指标的影响,为寻找防治冷IRI的有效药物提供实验依据。
1 材料与方法
1.1 材料 灯盏细辛注射液(云南生物谷灯盏花药业有限公司),HC-A离体肾灌注液(上海长征医院)冰冻备用,超氧化物歧化酶(superoxide dismutase,SOD)活性与丙二醛(malondialdehyde,MDA)检测试剂盒(南京建成生物工程有限公司),日本日立公司日立H-7500透射电镜,显微手术器械(上海医疗器械厂),10倍手术显微镜(镇江光学仪器厂),自制大鼠手术台、肾脏冷保存袋等。
1.2 实验动物来源、分组及处理方法 雄性成年SD大鼠36只,体质量250~300 g(河南省实验动物中心提供)。术前24 h禁食,不禁水。实验前采用随机数字表将大鼠分为假手术组、模型对照组(给予冷IRI处理)和实验组(给予冷IRI+灯盏细辛处理)3组(n=12)。3组均在术前经鼠尾静脉采血标本。实验组术前15 min经尾静脉注射灯盏细辛注射液1.2 mL/100 g,假手术组与模型对照组按相应剂量注射生理盐水。假手术组处理方法:应用20 g/L戊巴比妥钠腹腔注射麻醉(30 mg/kg),正中切口打开腹腔,切除右肾并游离左肾蒂,60 min后关闭腹腔切口。模型对照组和实验组建立冷缺血再灌注模型[3]:①首次冷灌注。切除右肾,10倍显微镜下在右肾动脉残端插管,经过腹主动脉至左肾动脉内,原位灌注左肾HC-A离体肾灌注液8~10 mL(0~4℃),左肾立即变苍白,触之冰凉,为灌注成功。通过右肾静脉残端插管直接将灌注液引流出体外,约2 min完成冷灌注后,用无损伤血管夹阻断左肾蒂,结扎右肾蒂。②冷缺血保存:充分游离左肾,将其牵至腹腔外,向左侧倾斜手术台,在自制的保存袋中用冰水混合物浸泡左肾,实施冷保存。简单缝合腹壁切口,尽量减少腹腔暴露对机体的影响。③再灌注:60 min后再次打开腹腔,去除肾脏冷保存袋,开放左肾动静脉血管夹使左肾复灌,肉眼可见肾脏由苍白色变为鲜红色,表明再灌注成功。左肾复位,缝合切口。3组大鼠均在术后6 h开始给予100 g/L葡萄糖水喂养,自然光照,24 h后再次麻醉,原切口打开腹腔,下腔静脉采血标本,立即摘取左肾。
1.3 观察指标 采用透射电镜观察左肾超微结构的变化;制作肾脏组织匀浆,检测肾组织匀浆中SOD活性、MDA含量;手术前后取血标本,检测血清尿素氮(blood urea nitrogen,BUN)、肌酐(creatinine,Cr)。
1.4 统计学处理 采用SPSS 16.0进行分析,应用单因素方差分析和LSD-t检验比较3组大鼠肾组织匀浆中SOD活性、MDA含量的差异,应用重复测量数据的方差分析比较3组大鼠手术前后血浆BUN、Cr水平的差异,检验水准α=0.05。
2 结果
2.1 3组大鼠左肾电镜观察结果 假手术组:近曲小管上皮细胞结构完整,微绒毛位置正常,排列整齐;细胞核结构清晰,染色质分布均匀;线粒体形态正常,呈长圆形或卵圆形,无肿胀,嵴清晰,基质均匀丰富(图1A)。模型对照组:近曲小管上皮细胞排列尚规律,较多微绒毛脱落至管腔中;胞质内可见大量空泡变性;线粒体肿胀明显,形态失常,嵴结构紊乱,部分线粒体膜破裂;细胞核结构改变,可见染色质边集,电子密度增高,部分细胞核消失(图1B)。实验组:近曲小管上皮细胞排列规整,多数微绒毛在正常位置,有少部分微绒毛脱落至管腔中;线粒体轻度肿胀,其膜完整,部分嵴结构紊乱;胞质内可见少量空泡样变性,细胞器局部排列疏松,多数细胞核内染色质尚均匀(图1C)。

图1 3组大鼠左肾近曲小管上皮细胞的电镜结果(×5000)
2.2 3组大鼠肾组织匀浆中SOD活性与MDA水平比较 见表1。
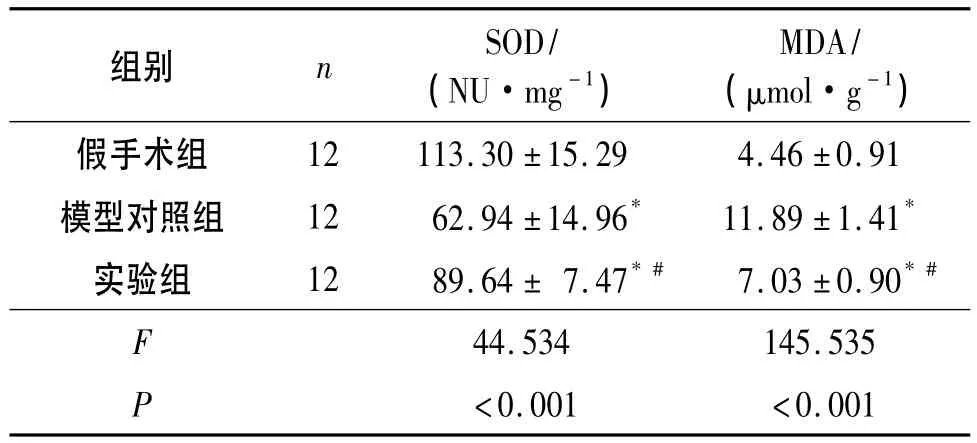
表1 3组大鼠肾组织匀浆中SOD活性与MDA水平比较
2.3 3组大鼠手术前、后血浆BUN、Cr水平比较见表2。

表2 3组大鼠手术前、后血浆BUN、Cr水平比较(n=12)
3 讨论
肾移植是治疗终末期肾病的有效治疗方法,随着精确的基因配型与强效免疫抑制药物的应用,排斥反应对移植物的威胁不断减少。而缺血再灌注在肾移植过程中不可避免。文献[4]报道IRI触发受体固有免疫,与移植物长期生存有关[5],因此器官移植领域愈加重视IRI对移植物存活的影响,一直在致力寻找防治IRI的有效药物。灯盏细辛主要分布在我国云南地区,文献[6]报道灯盏细辛中含有丰富的咖啡酸乙酯等黄酮类物质,具体成分尚未完全查明,具有抗血栓、抑制凝血、促进纤溶活性及改善血液的高凝状态和微循环等作用。
作者应用大鼠肾冷缺血再灌注观察灯盏细辛对肾脏IRI的保护作用。肾组织匀浆生化结果显示:实验组中SOD活性高于模型对照组,MDA含量低于模型对照组,差异均具有统计学意义。SOD对机体的氧化与抗氧化平衡起着至关重要的作用,此酶能清除超氧阴离子自由基,保护细胞免受损伤。MDA是脂质过氧化物,测试MDA的含量常常可反映机体内脂质过氧化的程度,间接地反映细胞损伤的程度。肾脏缺血再灌注前应用灯盏细辛可以明显提高SOD的活性,提高机体清除氧自由基的能力,且MDA含量降低,提示氧化损伤减轻。血生化结果显示:实验组缺血再灌注后24 h的BUN、Cr低于模型对照组,差异均具有统计学意义,证实应用灯盏细辛后冷缺血再灌注对肾脏功能的损害减轻。透射电镜观察发现,假手术组肾脏正常,模型对照组肾脏组织中的线粒体等细胞器形态失常,胞质内空泡样改变。实验组较模型对照组损伤明显减轻,2组在肾曲小管的差异最大(该部位是产生氧自由基最多的地方)。氧化损伤是IRI中最重要的途径,在超微结构中线粒体的损伤最明显,该研究中线粒体形态学变化符合IRI过程中该细胞器的功能变化。
有研究报道三七总苷[7]、苦菜总黄酮[8]对肾、心等器官IRI的保护作用也是通过其抗氧化作用实现的。该研究结果表明灯盏细辛能够减轻大鼠肾脏冷IRI中的氧化损伤,证实该药物对靶器官肾脏亦具有保护作用。作者将进一步研究该药物对IRI过程中肾小管上皮细胞的信号传导与细胞凋亡等分子生物学机制的影响。
[1]杨淑艳,钟秀宏,郑中华,等.灯盏花素对脑缺血再灌注损伤的细胞和分子保护机制研究现状[J].中国药房,2009,20(9):714
[2]王利果,李树青.灯盏细辛对大鼠心肌缺血再灌注心律失常和细胞凋亡的影响[J].中西医结合心脑血管病杂志,2009,7(1):52
[3]杨铁军,谢小娟,陈小兵,等.大鼠肾冷缺血再灌注损伤模型的建立[J].中华实验外科杂志,2011,28(6):998
[4]McKay DB.The role of innate immunity in donor organ procurement[J].Semin Immunopathol,2011,33(2):169
[5]Timsit MO,Yuan X,Floerchinger B,et al.Consequences of transplant quality on chronic allograft nephropathy[J].Kidney Int Suppl,2010,119:S54
[6]谷党英.灯盏细辛的研究进展及临床应用[J].河北中医药学报,2009,24(2):48
[7]张可,李华,王军.三七总苷对大鼠缺血再灌注肾损伤的保护作用[J].郑州大学学报:医学版,2006,41(6):1165
[8]刘仰斌,李启华,刘欣.苦菜总黄酮对大鼠心肌缺血再灌注损伤的保护作用[J].郑州大学学报:医学版,2010,45(1):107

