不同膳食脂肪酸构成对大鼠肝脏脂代谢相关基因表达的影响*
时皎皎,糜漫天,韦 娜,王 斌,易 龙,张乾勇△
(1.成都军区总医院营养科,成都 610083;2.第三军医大学营养与食品安全研究中心/重庆市营养与食品安全重点实验室,重庆 400038)
随着经济的发展和人们生活方式的改变,心血管疾病(cardiovascular disease,CVD)已成为危害人类健康的主要疾病[1],而脂质代谢紊乱引起的动脉粥样硬化(atherosclerosis,AS)是CVD的重要诱因[2-3]。有研究发现,不同种类的膳食脂肪酸对血脂的变化存在不同程度的影响,而在相同膳食脂类摄入量下各种脂肪酸的构成比不同也会对血脂调节以及CVD等慢性病的发生、发展产生不同的效应。本研究前期观察到在总脂肪含量为15%(wt/wt)的膳食干预下,与对照组比较,饱和脂肪酸(saturated fatty acid,SFA)的摄入有显著升高血脂的作用,单不饱和脂肪酸(monounsaturated fatty acid,MUFA)和多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)则对血脂有显著降低的作用,而1∶1n-6/n-3组的降血脂作用更加显著且全面[4]。由于在机体脂质代谢的调节过程中,FAS、PPARα等在脂肪酸和胆固醇的合成与代谢、胆固醇转运、载脂蛋白水平等诸多方面都有重要的调控作用[5-6]。有研究也证明,不同种类的脂肪对这些脂代谢关键基因表达存在调节作用[7-8]。现将本研究不同膳食脂肪酸对大鼠肝脏组织中脂质代谢关键基因FAS、PPARα的mRNA表达的影响报道如下。
1 材料与方法
1.1 动物模型与分组 选择清洁级雌性Sprague-Dawley大鼠(45d龄)48只,体质量140~170g(购自第三军医大学野战外科研究所实验动物中心),适应性喂养3d后,按照随机分组设计方法分为6组各8只,即SFA组、MUFA组、n-6PUFA组、n-3PUFA组、1∶1n-6/n-3组和对照组。持续喂养18周。将大鼠置于(22±2)℃、50%湿度及正常昼夜节律的环境中分笼饲养,自由饮水。
1.2 试剂 n-6PUFA由四川嘉里粮油工业公司的“金龙鱼”牌葵花籽油(主要含亚油酸)提供;n-3PUFA采用山东鸿祥神生物公司的鱼油(主要含二十碳五烯酸和二十二碳六烯酸);MUFA由北京神州油橄榄技术开发公司生产的特级初榨橄榄油(主要含油酸)提供;SFA由自炼猪油提供。上述油脂经气相色谱法分析其脂肪酸构成。Trizol分离试剂购自Invitrogen公司,RNA酶抑制剂、dNTP、Olig-(dT)18购于上海生工生物工程技术有限公司,M-MuLV逆转录酶、Taq DNA聚合酶购于Promega公司,溴化乙啶购于Sigma公司,PCR marker购于北京天为时代科技公司。
1.3 肝脏组织总RNA的提取 实验结束时,活杀大鼠,取肝脏组织0.1g,制备组织匀浆,利用Trizol试剂常规提取总RNA。每个样品取1μL,ddH2O稀释200倍后用核酸蛋白定量仪测定RNA含量与纯度。整个过程所有使用的器械及液体均经0.1%焦矿酸二乙酯(diethylpyrocarbonate,DEPC)水处理,戴消毒手套操作,防止RNA酶污染。
1.4 逆转录-聚合酶链反应(reverse transcription,RT-PCR)检测FAS和PPARαmRNA表达水平 取上述提取的总RNA 3 μg,65℃水浴5min和0℃冰浴5min后,依次加入RNA酶抑制剂20U、10mmol/L dNTP 2μL、Oligo(dT)18 1μg、5×反应缓冲液4μL、M-MuLV逆转录酶200U,加Erasol处理的去离子水至20μL,37℃孵育1h,再于70℃放置10min终止反应。取逆转录产物1.5μL进行PCR反应。引物序列根据基因率(Genebank)设计,由上海生工生物工程技术有限公司合成,引物序列、退火温度及产物长度见表1。扩增的反应参数为95℃预变性5min,94℃变性45s,60℃退火、45s,72℃延伸1min,共30个循环,72℃延长10min。反应结束后,各取5 μL PCR扩增产物,以含0.5μg/mL溴化乙啶的1.2%琼脂糖凝胶进行电泳,Bio-Rad成像分析仪观察并照像。PCR的特异条带以相对吸光度(intensity)×面积(mm2)表示,用各组校正吸光度与β-actin校正吸光度的比值表示其表达强弱。
1.5 统计学处理 应用SPSS11.0统计软件对数据进行分析,计量资料以±s表示,实验结果进行单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 不同膳食脂肪酸构成对FAS基因表达的影响 与对照组比较,SFA组大鼠肝脏组织FAS mRNA表达显著升高(P<0.05),MUFA组、n-6PUFA组、n-3PUFA 组和1∶1n-6/n-3组大鼠肝脏组织FAS mRNA表达显著降低(P<0.05),见图1~2。

图1 不同脂肪酸构成比喂饲对各组大鼠肝脏组织FAS mRNA表达的影响
2.2 不同膳食脂肪酸构成对PPARα基因表达的影响 与对照组比较,SFA组和 MUFA组大鼠肝脏组织PPARαmRNA表达均无明显变化(P>0.05)。n-6PUFA组、n-3PUFA组和1∶1n-6/n-3组大鼠肝脏组织PPARαmRNA 表达显著升高(P<0.05)。同时,与n-6PUFA组比较,n-3PUFA组和1∶1 n-6/n-3组大鼠肝脏组织 PPARαmRNA 表达显著增加(P<0.05),见图3~4。
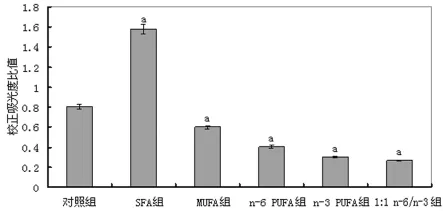
图2 各组大鼠肝脏组织FAS mRNA表达电泳结果的灰度值分析
图3 不同脂肪酸构成比喂饲对各组大鼠肝脏组织PPARα mRNA表达的影响
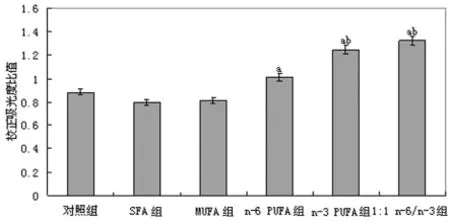
图4 各组大鼠肝脏组织PPARαmRNA表达电泳结果的灰度值分析
3 讨 论
FAS是脂肪酸合成的限速酶,主要存在于肝脏、脂肪等组织中,在体内起催化丙二酸单酰CoA连续结合成长链脂肪酸的反应,其活性高低将直接控制着体内脂肪合成的强弱,从而对机体的脂质代谢调节起着重要的作用。有研究发现,PUFA对FAS基因的表达具有较强的抑制作用。Clarke等[9]研究结果表明,n-6PUFA和n-3PUFA使肝脏中的FAS mRNA表达降低了75%~90%,而SFA和MUFA对FAS mRNA的表达则无显著的抑制作用。此外,成廷水[10]研究发现,SFA对FAS酶的活性影响不大,而不饱和脂肪酸对动物FAS的活性具有较明显的抑制作用,这种抑制作用与不饱和脂肪酸的含量、不饱和程度、链的长短、双键位置等多种因素有关。
本研究观察到SFA组大鼠肝脏组织FAS mRNA的表达显著升高(P<0.05),而 MUFA 组、n-6PUFA 组、n-3PUFA组、1∶1n-6/n-3组大鼠肝脏组织的FAS mRNA 表达均显著降低(P<0.05)。这表明在同脂肪含量的情况下,n-3PUFA与n-6PUFA抑制FAS表达方面的功能要强于SFA和MUFA,与文献[9]报道基本一致。本研究发现,SFA干预能导致大鼠肝脏组织FAS mRNA表达显著升高,与韦娜和康漫天[11]研究结果一致。对于Clarke等[9]报道的SFA对FAS的表达没有抑制作用,实验结果的差异可能与本研究未对碳水化合物的摄入量做特别调整,同时动物实验之间所选取的大鼠类型、干预饲料中的脂肪供能比、膳食干预时间以及脂肪酸的配比不一致等原因有关。
PPAR是核受体超家族成员中的一员,PPARα是肝脏中PPAR的主要形式,对体内脂肪酸和胆固醇代谢、胆固醇转运以及血浆载脂蛋白水平均有调控作用,因此,在脂质代谢的调节过程中起着重要作用。PPARα能与视黄醇X受体α(retinoid X receptor alpha,RXRα)形成异源二聚体,识别靶基因上游的过氧化物酶体增殖剂反应元件(peroxisome proliferator response element,PPRE),并启动靶基因的转录,从而引起过氧化物酶体增殖以及脂肪酸途径相关基因的活性和表达增强。有研究发现,PPARα激活后可促进胆固醇向胆酸的转化以降低血胆固醇水平,并可以通过调节脂蛋白代谢而改变血浆中脂肪酸和胆固醇的转运水平。Clarke[12]研究发现,膳食SFA与MUFA干预对PPARα的表达无显著影响,但PUFA尤其是n-3系的PUFA能有效升高PPARα的表达。进一步研究表明,PUFA是PPARα的内源性配体[13],可有效激活PPARα并诱导PPARαmRNA的高表达[14],从而促进乳糜微粒、LDL-C和VLDL-C的代谢以及脂肪酸的β-氧化,并通过增加肝脏ApoA-I的表达来有效升高HDL-C的水平。
本研究发现,不同种类及配比的膳食脂肪酸对大鼠肝脏组织PPARαmRNA表达的影响不同。与对照组比较,SFA组和MUFA组大鼠的PPARαmRNA表达无明显变化(P>0.05);n-6PUFA组、n-3PUFA组和1∶1n-6/n-3组大鼠肝脏组织PPARαmRNA表达显著增加(P<0.05),说明n-6PUFA、n-3 PUFA膳食能明显促进PPARαmRNA的表达。同时,与n-6 PUFA组比较,n-3PUFA组和1∶1n-6/n-3组大鼠肝脏组织PPARαmRNA表达增加更显著(P<0.01)。因此,SFA和MUFA对PPARα的基因表达没有显著的调控作用,而PUFA作为PPARα的内源性配体能够有效增强PPARαmRNA的表达。在相同的总脂肪含量下,n-3PUFA 和1∶1n-6/n-3配比的膳食干预效果优于n-6PUFA。这与以往的实验结果基本一致。
综上所述,SFA、MUFA主要是通过FAS途径来调控机体的脂质代谢,它们对PPARα的表达无明显影响。与对照组比较,SFA能非常显著地升高FAS mRNA的表达(P<0.05),而MUFA能显著降低FAS的基因表达(P<0.05)。PUFA调节血脂的效应更加全面,能够显著降低脂质合成中的关键酶FAS的表达同时升高PPARα的表达。
[1] He J,Gu D,Wu X,et al.Major causes of death among men and women in China[J].N Engl J Med,2005,353(11):1124-1134.
[2] Tattersall MC,Karmali KN,Gangnon RE,et al.The population effects of the global cardiovascular risk model in United States adults:findings from the National Health and Nutrition Surveys,2005-2006[J].J Clin Lipidol,2011,5(3):166-172.
[3] Genser B,Dias KC,Siekmeier R,et al.Lipoprotein(a)and risk of cardiovascular disease——a systematic review and meta analysis of prospective studies[J].Clin Lab,2011,57(3/4):143-156.
[4] 时皎皎,糜漫天,韦娜,等.不同脂肪酸构成比对大鼠血脂影响的研究[J].第三军医大学学报,2007,29(9):824-827.
[5] 于红燕,李燕.多不饱和脂肪酸与肝脏脂质代谢的调控[J].国际药学研究杂志,2008,35(2):120-123.
[6] 艾正琳,陈东风,刘重阳,等.固醇调节元件结合蛋白-1c在大鼠非酒精性脂肪性肝炎中的表达及意义[J].重庆医学,2007,36(8):695-697.
[7] Yang ZH,Miyahara H,Takemura S,et al.Dietary saury oil reduces hyperglycemia and hyperlipidemia in diabetic KKAy mice and in diet-induced obese C57BL/6Jmice by altering gene expression[J].Lipids,2011,46(5):425-434.
[8] Hiller B,Herdmann A,Nuernberg K.Dietary n-3fatty acids significantly suppress lipogenesis in bovine muscle and adipose tissue:a functional genomics approach[J].Lipids,2011,46(7):557-567.
[9] Clarke SD,Armstrong MK,Jump DB.Dietary polyunsaturated fats uniquely suppress rat liver fatty acid synthase and S14mRNA content[J].J Nutr,1990,120(2):225-231.
[10]成廷水.日粮PUFA对脂肪酸合成酶(蛋白)基因表达作用研究[J].中国饲料,2004,15(7):11-13.
[11]韦娜,糜漫天.n-6/n-3多不饱和脂肪酸不同比例对乳腺癌细胞脂代谢调控基因的影响[J].第三军医大学学报,2006,28(7):652-655.
[12]Clarke SD.Polyunsaturated fatty acid regulation of gene transcription:a molecular mechanism to improve the metabolic syndrome[J].J Nutr,2001,131(4):1129-1132.
[13]Sampath H,Ntambi JM.Ployunsaturated fatty acid regulation of gene expression[J].Nutr Rev,2004,62(9):333-339.
[14]叶华,王继文,罗辉.PUFA对脂肪代谢基因表达的影响及其作用机制[J].安徽农业科学,2006,34(15):3689-3691.

