骨桥蛋白抑制FHIT表达促进结肠癌细胞增殖存活*
骨桥蛋白抑制FHIT表达促进结肠癌细胞增殖存活*
王 丽1,刘晓燕1,李 娟1,杨志惠2△
(泸州医学院:1.医学分子生物学实验室;2.病理学教研室,四川泸州 646000)
目的构建骨桥蛋白(OPN)基因真核表达载体,转染人结肠癌细胞SW480,研究其对SW480细胞增殖及生存能力的作用机制。方法构建重组表达载体pEGFP-N1/OPN,转染人结肠癌SW480细胞。采用RT-PCR及免疫印迹法(Western blotting)分别检测SW480细胞OPN基因及蛋白表达量;Cell Counting Kit-8(CCK-8)测定细胞增殖;软琼脂克隆形成实验观察细胞的锚定非依赖性生长能力。Western blotting检测脆性组氨酸三联体基因(FHIT)和蛋白激酶B(PKB/Akt)蛋白在SW480细胞中的表达。结果重组质粒pEGFP-N1/OPN转染SW480后,OPN基因获得很好转录,OPN蛋白表达增高,细胞增殖率(光吸收值)显著高于转染阴性组(P<0.05),细胞软琼脂克隆形成速度增快,数量明显多于对照组和空载体组(P<0.05);FHIT蛋白在实验组表达降低,Akt蛋白在各组中的表达无显著性差异。结论 OPN基因通过抑制FHIT基因表达,促进SW480细胞增殖、独立存活能力。
骨桥蛋白质;结肠肿瘤;脆性组氨酸三联体基因
骨桥蛋白(osteopontin,OPN)是一种磷酸化、带负电荷、亲水性的分泌型糖蛋白[1]。OPN蛋白分子结构内有精氨酸-甘氨酸-天冬氨酸(RGD)结构域,其通过RGD序列能与多种整合素受体结合,促进细胞趋化、黏附和迁移。研究发现,乳腺癌、胃癌和肺癌等肿瘤组织OPN高表达,并且与肿瘤进展、预后相关[2-3],但具体作用机制不明确,有待进一步研究。本研究拟构建OPN基因真核表达载体,转染结肠癌SW480细胞株,探讨OPN对结肠癌细胞增殖及存活能力的影响及机制,现将结果报道如下。
1 材料与方法
1.1 材料 SW480细胞株购自中国科学院细胞库,E.coli TG1菌株及pEGFP-N1载体为本实验室保存。
1.2 试剂 脂质体Lipofectamne2000、LA Taq with GC Buffer PCR试剂盒、限制性内切酶、连接酶购自Takara公司;DNA片段快速回收试剂盒、质粒抽提试剂盒购于Qiagen公司;Cell Counting Kit-8(CCK-8)购自上海同仁化学研究所;OPN 鼠抗人多克隆抗体、脆性组氨酸三联体基因(fragile histidine triad gene,FHIT)兔抗人多克隆抗体购自美国Bioworld Technology公司;蛋白激酶B(protein kinase B,PKB/Akt)兔抗人多克隆抗体购自上海康成生物工程有限公司;β-actin兔抗人多克隆抗体购自北京博奥森生物技术有限公司;其他所用试剂均为国产或进口分析纯。
1.3 方法
1.3.1 重组表达载体pEGFP-N1/OPN的构建与鉴定
1.3.1.1 OPN基因的扩增 提取结肠癌细胞株HCT116总RNA,按说明书合成cDNA。根据OPN序列NM_001040060设计引物,上游添加XhoⅠ酶切位点,下游添加BamHⅠ酶切位点,引物序列为F:ACC TCG AGG CCA TGA GAA TTG CAG TGA TTT G,R:TAG GAT CCC GAT TGA CCT CAG AAG ATG CAC T,产物长度为863bp。
1.3.1.2 OPN基因的克隆与测序 PCR产物经1%琼脂糖凝胶电泳后,回收863bp处DNA带,与7Z载体连接,转化TG1感受态细胞,筛选白斑,提取质粒,菌落PCR鉴定及BamHⅠ和XhoⅠ双酶切鉴定后,阳性克隆送上海生物工程有限公司测序。
1.3.1.3 重组表达载体pEGFP-N1/OPN的构建与鉴定 用XhoⅠ和BamHⅠ双酶切7Z/OPN,酶切产物与同样的酶双酶切的克隆载体pEGFP-N1连接,构建重组表达载体pEGFPN1/OPN,转化E.coli TG1。筛选重组质粒的转化子并提取重组质粒,PCR和酶切鉴定后,阳性克隆送上海生物工程有限公司进行序列分析。
1.3.2 pEGFP-N1/OPN质粒转染人结肠癌SW480细胞株以含10%胎牛血清的L-15培养液,在37℃5%的CO2培养箱中培养人结肠癌SW480株,转染前1天以3×105密度接种对数期SW480于6孔培养板中,当达到90%融合时,随机分为3组:空白组(用无菌水代替质粒),对照组(加空载体pEGFP-N1)和实验组(pEGFP-N1/OPN)。每孔加入2mL 无血清培养基,分别配制溶液1(240μL无血清培养基及10μL lip 2 000per well,温育5min)和溶液2(240μL无血清培养基及4 μg质粒per well),混合溶液1、2于室温下放置20min后逐滴加入孔中,摇动培养板,轻轻混匀,在37℃、5%CO2中保温6 h,之后更换含有血清的全培养基,在37℃、5%CO2中培养48~72h,荧光显微镜下检测转染效率。RT-PCR检测SW480细胞转染后OPN表达;免疫印迹法(Western blotting)检测SW480细胞转染后OPN蛋白表达量。
1.3.3 转染OPN后SW480生物学功能研究
1.3.3.1 CCK-8测定细胞增殖 取对数生长期SW480细胞,以5×104密度接种于96孔培养板中,待细胞贴壁后随机分为空白组,空载体组和实验组,每组3复孔,按常规方式进行转染,更换含有血清的全培养基后分别培养24、48、72h,在各对应时间点取出培养板,每孔加入10μL CCK-8,37℃下继续孵育2h,酶联免疫检测仪上以450nm为检测波长,630nm为参考波长测量各孔的吸光度值(A)。
1.3.3.2 软琼脂克隆形成实验 取对数生长期SW480细胞,0.25%胰蛋白酶消化吹打成单细胞,用含20%胎牛血清的L-15培养基调整细胞密度为1×106/L。制备0.7%和1.2%的低熔点琼脂糖液,等比例分别与2×L-15培养基混合成上层和下层,加1.5mL下层培养基于6孔板凝固后,将约2 000个细胞与1.5mL上层培养基混合,加到已凝固的底层琼脂上,形成双琼脂层,置于5%CO2、37℃饱和湿度条件下培养10d,倒置显微镜下观察,镜下(×40)随机挑选10个视野计数细胞克隆数,实验重复3次。
1.3.3.3 Western blotting检测FHIT蛋白和 Akt蛋白 按Western blotting常规操作对3组转染细胞行FHIT、Akt、βactin蛋白检测,结果以累积光密度比值(FHIT IOD/β-actin IOD)表示。
1.4 统计学处理 采用SPSS 13.0统计软件进行分析,实验计量数据以±s表示,组间比较采用方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 SW480细胞转染后OPN基因及蛋白表达 转染48h后检测OPN基因在SW480中的表达,结果显示,空白组和空质粒转染组有非常微弱的目的条带,而重组质粒pEGFP-N1/OPN转染组可见850bp左右目的条带,3组细胞均在263bp处出现GAPDH目的条带,表明重组质粒pEGFP-N1/OPN转染之后外源OPN获得很好转录。转染72h后检测OPN基因在SW480中的表达,检查结果显示,SW480细胞经pEGFP-N1/OPN转染后OPN蛋白表达增高,而空白组和空载体组OPN蛋白表达弱,表明细胞转染成功,见图1、2。
2.2 细胞增殖分析 CCK-8法检测3组转染细胞增殖情况,结果显示,随培养时间延长,细胞增殖活性逐渐增强,转染pEGFP-N1/OPN质粒组与对照组和空载体组相比,任何时间段转染细胞增殖程度均出现明显增强,表明OPN具有促进SW480细胞增殖的作用,而对照组和空载体组间的差异无统计学意义(P>0.05),见表1。
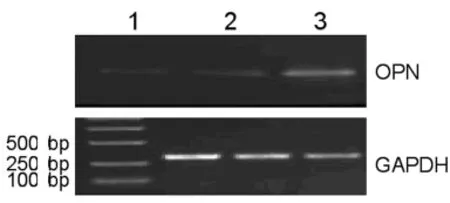
图1 RT-PCR检测OPN转染SW480细胞后的表达

图2 Western blotting检测OPN转染SW480细胞后的表达
2.3 软琼脂克隆形成实验 本实验发现,转染pEGFP-N1/OPN后,SW480细胞软琼脂克隆形成速度增快,数量明显多于对照组和空载体组,3组细胞每视野平均克隆个数分别为:21.00±3.16,14.40±2.30,14.60±1.14,差异有统计学意义(F=12.74,P<0.05)。

图3 Western blotting检测OPN转染SW480细胞后FHIT和Akt蛋白的表达
2.4 Western blotting检测FHIT蛋白和Akt蛋白 FHIT IOD/β-actin IOD在空白组、空载体组和实验组分别为0.156±0.008、0.165±0.008、0.044±0.006,比较差异有统计学意义(F=248.47,P=0.000),两两比较显示实验组与空白组、空载体组均有显著性差异,空白组和空载体组间变化不明显(P=0.186);Akt蛋白在3组间的表达分别为0.022±0.004、0.024±0.003、0.024±0.002,组间差异无统计学意义(F=0.205,P=0.820),见图3。
表1 CCK-8法检测转染对人结肠癌细胞SW480增殖的影响±s)
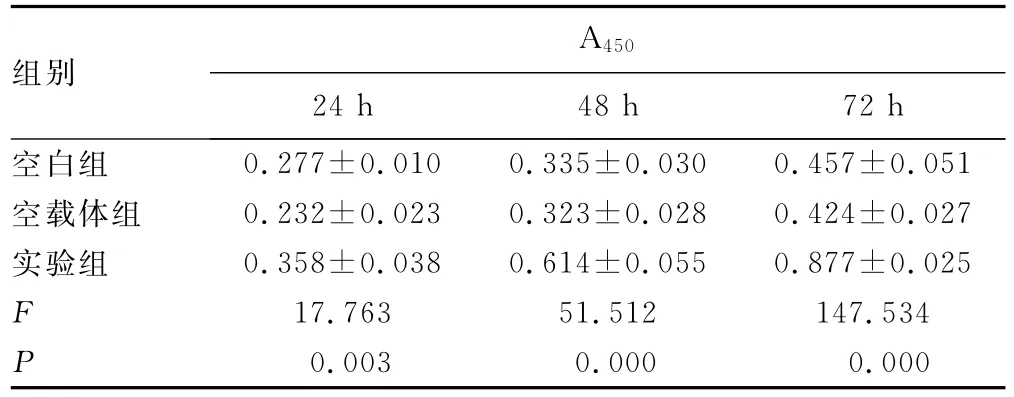
表1 CCK-8法检测转染对人结肠癌细胞SW480增殖的影响±s)
组别A450 24h 48h 72h空白组0.277±0.010 0.335±0.030 0.457±0.051空载体组 0.232±0.023 0.323±0.028 0.424±0.027实验组 0.358±0.038 0.614±0.055 0.877±0.025 F 17.763 51.512 147.534 P 0.003 0.000 0.000
3 讨 论
肿瘤的发生、发展与所处的微环境密切相关,因此细胞外基质蛋白对肿瘤的发生、发展至关重要。新近发现一些细胞外基质蛋白如OPN等,在促进肿瘤细胞生长、存活、侵袭和抗凋亡等方面都发挥着重要的作用。OPN与其受体结合后激活细胞内相应的信号通路引起相应基因表达的改变,促进肿瘤侵袭转移[4-5]。OPN与结肠癌侵袭转移密切相关,但OPN促进结肠癌侵袭转移的机制仍不明确,有待进一步研究[6]。
本研究结果显示,重组质粒pEGFP-N1/OPN转染SW480后,OPN基因获得很好转录,OPN蛋白表达增高,OPN能促进SW480细胞增殖,软琼脂克隆形成速度增快,数量明显增多。为研究其分子机制,Western blotting检测FHIT蛋白和Akt蛋白在转染OPN后SW480细胞中的表达。结果显示,与空白组和空载体组相比,FHIT蛋白在实验组中表达显著降低;而Akt蛋白在各组中的表达差异无统计学意义(P>0.05)。
Akt是PI3K的主要下游效应分子之一,可通过调节包括核因子-κB在内的转录因子参与多种生命活动。研究表明,PI3K/Akt途径的活化参与多种肿瘤的发生,抑制该通路可诱导细胞程序性死亡和抑制肿瘤的生长。有研究显示,肿瘤细胞在面临生存压力时,OPN通过与αvβ3整合素结合,增强Akt Ser473位点的磷酸化作用,激活PI3K/Akt途径,拮抗生存压力,提升细胞存活能力。根据本实验结果,OPN并没有引起Akt蛋白表达量增加。
FHIT位于人类3号染色体短臂3p14.2。研究表明,FHIT在人类许多肿瘤组织或细胞系中呈现高频率异常,在许多肿瘤组织或肿瘤细胞株中,FHIT基因呈现多发性、广泛性的纯合性或杂合性缺失,为多种肿瘤的候选抑制基因[7-8]。作为肿瘤抑制基因,它的缺失或失活将导致肿瘤的发展和恶性度的升高,与肿瘤的发生、发展有关。本实验结果显示,OPN转染组FHIT蛋白表达降低,故推测OPN通过抑制FHIT表达而促进结肠癌细胞增殖、存活。
本研究构建真核表达载体pEGFP-N1/OPN,转染人结肠癌SW480细胞。结果显示OPN通过降低FHIT蛋白表达促进人结肠癌细胞SW480增殖存活能力,促进肿瘤发生、发展。
[1]Denhardt DT,Guo X.Osteopontin:aprotein with diverse functions[J].FASEB J,1993,7(15):1475-1482.
[2]Coppola D,Szabo M,Boulware D.Correlation of osteopontin protein expression and pathological stage across a wide variety of tumor histologies[J].Clin Cancer Res,2004,10(1Pt 1):184-190.
[3]Uhlmann ME,Georges RB,Boleij A,et al.Influence of osteopontin expression on the metastatic growth of CC531 rat colorectal carcinoma cells in rat liver[J].Cancer Gene Ther,2011,18(11):795-805.
[4]Chakraborty G,Jain S,Behera R,et al.The multifaceted roles of osteopontin in cell signaling,tumor progression and angiogenesis[J].Curr Mol Med,2006,6(8):819-830.
[5]Rittling SR,Chambers AF.Role of osteopontin in tumour progression[J].Br J Cancer,2004,90(10):1877-1881.
[6]Georges R,Adwan H,Zhivkova M,et al.Regulation of osteopontin and related proteins in rat CC531colorectal cancer cells[J].Int J Oncol,2010,37(2):249-256.
[7]Siprashrili Z,Sozzi G,Barnes LD,et al.Replacement of Fhit in cancer cells suppresses tumorigenicity[J].Proc Natl Acad Sci USA,1997,94(25):13771-13776.
[8]卢德成,罗佐杰,冼晶.肾上腺皮质肿瘤增殖抗原和脆性组氨酸二联体表达的相关性及意义[J].中国综合临床,2008,24(8):753-754.
OPN regulates the FHIT protein expression to promote the proliferation and survival of SW480*
Wang Li1,Liu Xiaoyan1,Li Juan1,Yang Zhihui2△(
1.Medical Molecular Biology Laboratory;2.Pathology Teaching and Research Section;Luzhou Medical College,Luzhou,Sichuan646000,China)
ObjectiveTo construct an OPN eukaryotic expression vector,and evaluate its effects on proliferation and survival in SW480colon cancer cells in vitro,exploring the possible mechanism.MethodsOPN gene was cloned into the eukaryotic expression vector pEGFP-N1,after sequencing,the vector was then transfected into SW480cells.The OPN gene and protein expression in transfected cells were demonstrated by RT PCR and Western blotting respectively.The impact on proliferation in transfected SW480cells were investigated by CCK-8method,anchorage independent growth was measured using soft agar assay.Western blotting was used to analyzing the protein of fragile histidine triad gene(FHIT)and protein kinase B(PKB/Akt).ResultsThe levels of OPN gene and protein in colon cancer SW480cells were distinctly increased after transfection with pEGFP-N1/OPN.The OD450 value of OPN transfection group was higher than negative control group showed by CCK-8method(P<0.05).They could also significantly increase anchorage independent growth in vitro.FHIT protein was significantly increased in SW480cells transfected with pEGFP-N1/OPN.ConclusionIn SW480colon cancer cells,OPN was involved in promotion proliferation and survival,by regulating the FHIT protein expression.
osteopontin;colonic neoplasms;fragile histidine triad gene
10.3969/j.issn.1671-8348.2012.34.003
A
1671-8348(2012)34-3583-03
四川省科技厅科研项目(07JY029-134);四川省教育厅科研项目(07ZB110)。 △
,Tel:(0830)3160331;E-mail:yzhih73@126.com。
2012-06-13
2012-09-12)

