丁型肝炎病毒ORF5基因片段的原核表达及在ELISA 中的初步应用
王云龙,王 娟,李玉林,董彩文,孙新城,张怡青,王国强,李恒思,刘旺根
(1.河南师范大学,河南新乡453007;2.郑州职业技术学院,河南郑州450001;3.河南省生物工程技术研究中心,河南郑州450001)
丁型肝炎病毒(Hepatitis delta virus,HDV)感染呈全球分布,尤其是与乙型肝炎病毒(Hepatitis B virus,HBV)共感染或联合感染,会迅速暴发并可能发展成肝癌或肝硬化[1]。目前,对于丁型肝炎的治疗还没特效药物和有效的治疗手段[2],早期诊断和预防是防止病毒感染的主要措施。早期诊断主要是检测血清中Ig M抗体,获得特异性抗原是建立检测方法的主要难题。
丁型肝炎病毒基因组全长1.7 kb,含有多个开放阅读框,其中一个开放阅读框(ORF5)表达蛋白与HDAg功能性有关[3-4]。目前 HDAg在原核、真核细胞和昆虫病毒中均有表达[5-7]。本研究扩增 HDAg表达基因,构建原核表达载体,经诱导表达和纯化,获得了纯度较高的蛋白,可为建立丁型肝炎早期检测试剂盒提供材料来源。
1 材料与方法
1.1 材料
1.1.1 质粒和宿主菌 p ETHD质粒由中国疾病预防控制中心惠赠,含有ORF5编码区基因。表达载体PET-30a购自Novagen公司,克隆菌TG1,表达宿主菌BL21(DE3)本实验室保存。
1.1.2 引物设计 根据表达质粒和HDAg编码区设计 引 物,上游引物5′-CGCGGATCCCAT AT-GAGCCGCTCCGAATCGAGGAAACAT-3′ (含Bam H Ⅰ 酶 切 位 点 ), 下游引物 5′-CCCAAGCTTGCTAGCCCCGGGCGCTCCCCTCGAT-3′(Hin dⅢ酶切位点),由上海生工生物工程技术服务有限公司进行合成。
1.1.3 主要试剂 Bam HⅠ、Hin dⅢ限制性内切酶、T4 DNA ligase购自宝生物工程(大连)有限公司;DNA胶回收试剂盒购自Axygen;异丙基硫代-β-D-半乳糖苷(IPTG)购自Sigma公司;丁型肝炎病毒(HDV)阳性血清、阴性血清,人免疫缺陷病毒(HIV)、丙型肝炎病毒 (HAV)、甲型肝 炎病毒(HCV)、成型肝炎病毒(HEV)阳性血清,抗人Ig M(μ链)单克隆抗体,由河南省生物工程技术研究中心提供;其他试剂均为国产分析纯产品。
1.2 方法
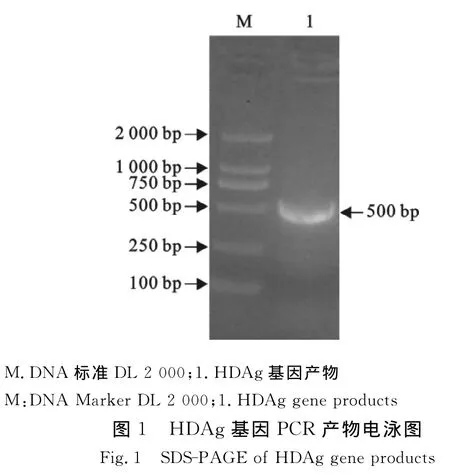
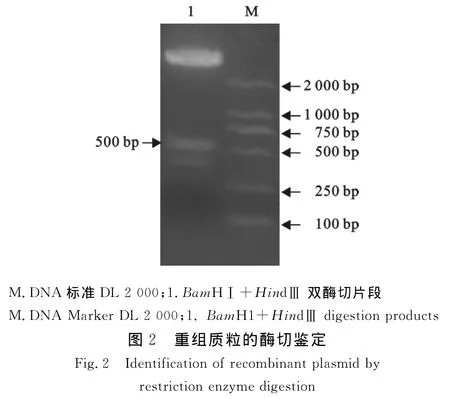
1.2.1 表达载体的构建 建立30μL PCR反应体系(20×buffer,1.5μL;MgCl2,0.6μL;d NTP,0.3μL;上游引物,0.2μL;下游引物,0.2μL;DNA 聚合酶,0.3μL;p ETHD,0.5μL ;dd H2O,26.4μL),反应条件:94 ℃ 5 min,94 ℃ 1 min,58 ℃ 1 min,72 ℃ 1 min,36个循环;72℃5 min。得到HDAg基因片段,预期扩增片段500 bp,用限制性内切酶Bam HⅠ、Hin dⅢ分别酶切PCR产物和质粒pET-30a,15 g/L琼脂糖凝胶电泳,切取目的条带,用DNA胶回收试剂盒回收目的条带和载体片段。T4连接酶16℃连接过夜。连接产物转化感受态细胞大肠埃希菌TG1中,涂LB平板(含Kana 30 mg/L),37℃过夜培养,挑取 LB平板上单个菌落做菌落PCR。挑取菌落PCR阳性的菌落培养18 h后提取质粒,Bam HⅠ、Hin dⅢ双酶切鉴定。酶切正确的质粒送上海生工生物工程技术服务有限公司进行测序。
1.2.2 HDAg的小量原核表达条件优化 将测序正确的阳性质粒转入宿主细胞BL21(DE3)中,涂LB平板(含Kana 30 mg/L)。从平板上挑取单菌落,接种于3.5 mL LB液体培养基中(含 Kana 30 mg/L),37℃摇床培养12 h。取菌液100μL转接3.5 mL LB培养基中(含Kana 30 mg/L)。当培养至 OD600 nm约为0.3~0.5,分别加入IPTG至其终浓度为0.05、0.1、0.2 mmol/L,另取一支不加IPTG,作为对照,37℃振荡培养4 h,随后取1.0 mL菌液以1 200 r/min破碎离心2 min,离心后取上清和沉淀加上样缓冲液进行SDS-PAGE,确定最佳IPTG诱导浓度。在3.5 mL培养基中加入IPTG至最佳诱导浓度,于37℃振荡培养,取不同时间段(诱导表达2、4、6、8 h)的表达产物各1.0 mL以1 200 r/min破碎离心2 min,离心后取上清和沉淀加上样缓冲液进行SDS-PAGE。最后在最佳诱导浓度和最佳诱导时间确定后,分别于25、30、37℃不同温度诱导,表达产物各1.0 mL以1 200 r/min破碎离心2 min,离心后取上清和沉淀加上样缓冲液进行SDS-PAGE。
1.2.3 HDAg的大量诱导表达 按照优化最佳诱导条件,取稳定表达的菌液500μL接于500 mL LB液体培养基(含 Kana 30 mg/L),进行大样诱导表达,收集菌液,8 000 r/min离心10 min,弃培养液,加入0.05 mmol/L PB洗涤沉淀,8000 r/min离心10 min,弃上清,收集沉淀液于-20℃冻存。
1.2.4 HDAg的制备及纯化 将冻存的菌液用0.05 mmol/L PB溶解,在冰浴条件下超声波破碎,将破碎的菌液以8 000 r/min离心10 min,取上清,用饱和硫酸铵沉淀,至终浓度为400 mL/L。将沉淀液以8 000 r/min离心10 min。弃上清,留沉淀,用去离子水透析过夜除去硫酸铵,再用4 mol/L尿素溶解,将溶液按照Ni-NTA亲和层析柱产品使用说明纯化蛋白。
1.2.5 方阵滴定法确定最佳酶标抗原浓度 对纯化的抗原进行辣根过氧化物酶标记(改良过碘酸钠法),作为酶标抗原 HRP-HDAg,按照 1/500、1/1 000、1/1 500、1/2 000进行稀释,用0.05 mol/L p H 9.5~9.6的碳酸盐缓冲液稀释抗人Ig M(μ链)单克隆抗体200、100、50 ng/100μL包被聚苯乙烯板。采用方阵滴定法确定单抗最佳包被浓度和酶标最佳稀释度。
1.2.6 阴阳性判定 用建立捕获法,根据ELISA检测方法临界值(Cut off)的经验公式:临界值=2.1×阴性对照孔吸光度值均值;通过对15例病理样本的检测,检验参考值的合理性。
1.2.7 交叉反应试验 用建立的捕获法分别与HIV、HAV、HCV、HEV阳性血清反应(血清经医院检测HDV为阴性,使用前已经灭活),同时选取HDV阳性血清和阴性血清作为阳性对照和阴性对照,每孔做复孔 。
2 结果
2.1 目的片段的扩增和重组质粒构建
应用PCR方法从pETHD质粒中扩增到约500 bp的DNA条带,片段与预期设计相符(图1)。将回收片段连接于pET-30a表达质粒,获得pET-30a/HDAg重组表达质粒。经转化TG1宿主菌,提取质粒进行Bam HⅠ、Hin dⅢ 双酶切鉴定(图2)。
2.2 目的蛋白的诱导表达
SDS-PAGE显示IPTG的最佳诱导浓度为0.1 mmol/L,最佳诱导时间为6 h,最佳诱导温度为37℃。表达产物大小约为27 ku,与设计相符。此条件下目的蛋白表达量最大,在上清和沉淀中均有蛋白HDAg,扫描分析上清表达量占总体电泳蛋白条带的25%左右(图3)。

2.3 表达产物纯化及SDS-PAGE电泳分析
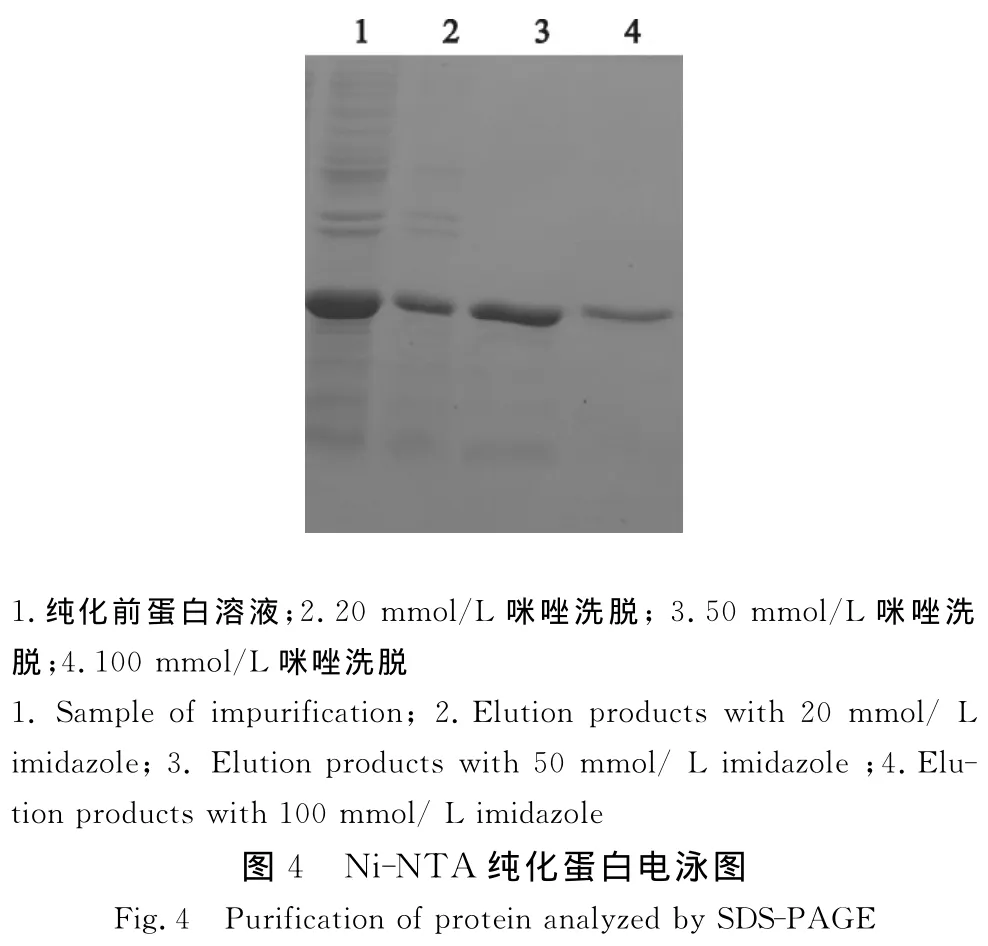
从SDS-PAGE电泳结果可以看到,经过20 mmol/L咪唑洗脱收集的目的蛋白含有少许杂蛋白;经过50 mmol/L咪唑洗脱收集的蛋白纯度较高,含量较高。扫描分析其纯度可达95%以上(图4)。
2.4 方阵滴定法确定最佳酶标抗原浓度和抗体包被浓度
通过方阵滴定包被抗体最佳工作浓度为100 ng和酶标抗原工作浓度为1/1 000组合时,P/N比值最大(表1)。
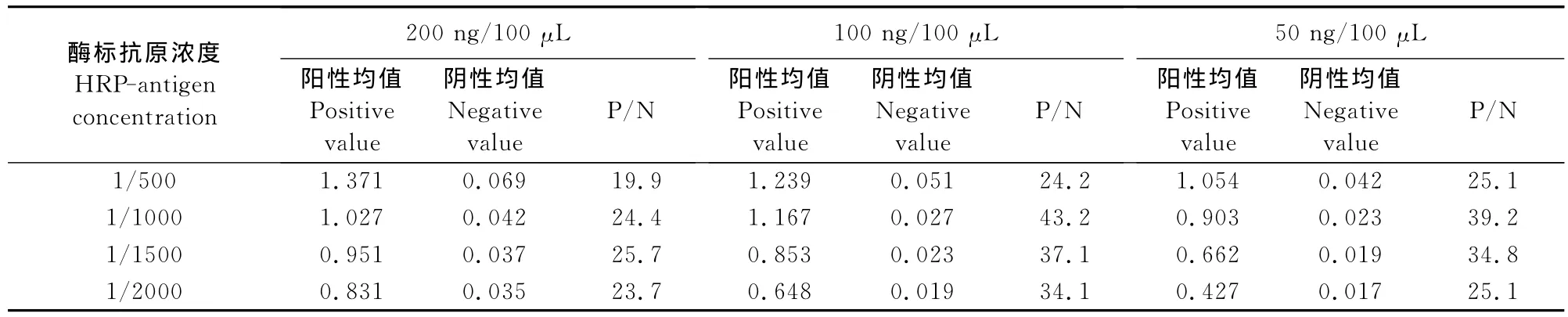
表1 包被单抗和酶标抗原的确定Table1 Determination for optimal concentration of Mc Ab and HRP-HDAg
2.5 阴阳性判定
根据酶免检测方法临界值(Cut off)的经验公式:临界值=2.1×阴性对照孔吸光度值均值。当阴性对照吸光度值均值小于0.05以0.05计算;当阴性对照吸光度值大于等于0.05以实际值计算。一般阴性对照吸光度值均值小于0.05(参照表1,阴性均值),因此确定阴性血清HDV Ig M正常值上限为0.105。检测值低于0.105判为阴性,检测值高于0.105判为阳性,通过对15例病理样本的检测,均在0.2以上。
2.6 交叉反应试验
用建立的捕获法分别与 HIV、HAV、HCV、HEV阳性血清反应,结果均为阴性,说明表达的HDAg对丁型肝炎病毒Ig M具有特异性(表2)。

表2 交叉反应结果Table2 The results of cross-reaction
3 讨论
目前利用基因工程表达HDAg已有不少报道[8-10],表达的抗原编码区基因在230 bp~680 bp之间,表达蛋白以融合蛋白[9]或包涵体[10]形式存在,蛋白纯度达到90%,均具有抗原性[11]。本研究扩增编码区500 bp,与p ET-30a载体连接,重组表达质粒pET-30a/HDAg,经转化 BL21(DE3)诱导,经SDSPAGE分析,蛋白分子质量为27 ku,蛋白在破碎后菌液上清和沉淀中均有。选择上清溶液用400 g/L过硫酸铵沉淀目的蛋白,后用Ni-NTA亲和层析纯化,蛋白的纯度达到95%以上,通过ELISA和交叉反应试验,表明反应原性和特异性较高。
p ET-30a中的S·Tag标签是高度可溶的多肽,可增强一些蛋白的可溶性,并且p ET-30a在N端编码6个连续的His-Tag作为亲和臂(Affinity-Tag),使所得的重组蛋白能通过金属离子(Ni2+)配体亲和层析快速纯化。
目前对于丁型肝炎病毒的检测有PCR法、分子杂交法和ELISA法,前两种方法主要是检测HDVRNA,目前对此尚无统一的标准。ELISA主要是检测Ig M和IgG,IgG在丁型肝炎病毒感染后可检出,Ig M抗体在丁型肝炎病毒早期感染可检出。对HDV感染尚无特效治疗药物,切断HDV的传播途径是主要预防措施之一,早期诊断对HDV感染的预防和控制有着重要意义。谢立等[12]对表达的抗原进行HRP标记,检测丁型肝炎病毒Ig M抗体,灵敏度高,特异性好。本研究利用表达的抗原初步建立捕获法,通过方阵滴定确定包被抗人Ig M(μ链)单克隆抗体最佳工作浓度为100 ng和HRP-HDAg工作浓度为1/1 000组合时,P/N比值最大,通过交叉反应试验,结果表明,表达的抗原具有很好的反应原性和特异性,可为建立丁型肝炎病毒早期检测试剂盒提供材料来源。
[1]Su C W,Huang Y H,Huo T I,et al.Genotypes and viremia of hepatitis B and D viruses are associated with outcomes of chronic hepatitis D patients[J].Gastroenterology,2006,130:1625-1635.
[2]Grazia Anna N,Domenica G,Rosanna F.Hepatitis delta virus infection:Open issues[J].Digestive and Liver Disease,2011,43:19-24.
[3]Chao Y C,Lee C M,Tang H S,et al.Molecular cloning and characterizat ion of an isolate of hepatitis delta virus from Tai wan[J].Hepatology,1991,13:345-352.
[4]刘善虑,易炎杰,丛旭,等.中国人丁型肝炎病毒抗原编码区基因的DNA克隆和序列分析[J].病毒学报,1998(9):27-33.
[5]Macaughton T B ,Gowans E J,Reinboth B ,et al.Stable expression of hepatitis delta virus antigen in a eukaryotic cell line[J].J Gen Virol,1990,71:1339-1345.
[6]Kos T,Molijn A ,Blau W B,et al.Baculovirus-directed high level expression of the hepatitis delta antigen in spodoptera frugiperda cell[J].J Gen Virol,1991,72:833-842.
[7]Chiang Y W,Wu J C,Wang K C,et al.Efficient expression of histidine-tagged large hepatitis delta antigen in baculovirustransduced baby hamster kidney cells[J].World J Gastroenterol,2006,12(10):1551-1557.
[8]Huang Y H,Wu J C,Peng W L,et al.Generation of cytotoxicity against hepatitis delta virus genotypes and quasispecies by epitope modification[J].J Hepatol,2009,50:779-788.
[9]江永珍,张明程,田瑞光,等.丁型肝炎病毒抗原的原核表达及抗原性分析[J].中华实验和临床病毒学杂志,2006,20(2):38-41.
[10]谢 立,黄德庄,贺立香,等.丁型肝炎病毒抗原的表达纯化和抗原性分析[J].中国病毒学,2005,20(4):444-446.
[11]Xie L,Huang D Z,He L X,et al.Detection of antibody to hepatitis delta virus in human serumby double antigen sandwich ELISA[J].Virol Sinca,2009,24(1):45-51
[12]谢 立,黄德庄,贺立香,等.用基因重组丁型肝炎病毒抗原检测丁肝病毒Ig M 抗体及其初步应用[J].天津医药,2004,32(7):423-424.

