猪瘟病毒E2蛋白主要抗原区的原核表达及其间接ELISA检测方法的建立与应用
李文良,毛 立,江杰元,李 彬,茅爱华,甘 源
(江苏省农业科学院兽医研究所,农业部兽用生物制品工程技术重点实验室,国家兽用生物制品工程技术研究中心,江苏南京210014)
猪瘟(Classical swine fever,CSF)是由猪瘟病毒(Classical swine fever virus,CSFV)引起的一种猪的高度接触性传染病,是世界动物卫生组织(OIE)规定的必须报告的疫病,对世界养猪业造成严重的危害。CSFV属于黄病毒科(Flaviviridae)瘟病毒属(Pestivirus),基因组为单股正链RNA,长约12.3 kb,编码1个由3 900个氨基酸组成的多聚蛋白[1]。在宿主和病毒蛋白酶作用下裂解成为形成4个结构蛋白(C、E0、E1、E2)和8 个非结构蛋白(Npro、p7、NS2、NS3、NS4A、NS4B、NS5A、NS5B)[1]。其中囊膜糖蛋白E2介导病毒的感染入胞、可以诱导机体产生中和抗体,保护机体抵抗病毒的感染,是重要的保护性抗原之一[2-4]。E2蛋白 N 端包含 A、B、C、D4个抗原区,其中A1、B、C可以诱导产生中和抗体[4],只有 A1亚区在不同毒株之间是保守的[5]。因此,E2蛋白是研制新型活载体疫苗、亚单位疫苗以及建立血清学诊断方法的候选抗原,先前报道多将 A-D 区进行表达用于建立 ELISA 方法[1,4,6-10]。
抗体检测对于猪瘟流行情况监测、疫苗免疫效果评价及免疫程序的优化至关重要。目前常用的方法有中和试验、间接血凝试验和ELISA,其中中和试验操作繁琐;间接血凝操作简便,但敏感性稍低;而ELISA方法具有操作简便、敏感性高、适于大规模样品检测的优点,在临床上得到广泛应用[10]。用于ELISA的抗原主要有全病毒和重组蛋白;原核表达系统以其独特的优势成为人工大量生产重组蛋白的有效工具,成为ELISA抗原制备的有力工具[11]。
本研究扩增包含E2抗原A区的基因片段,克隆入p ET32a(+)中,构建了重组大肠埃希菌,将目的蛋白纯化鉴定后建立了IgG抗体ELISA检测方法,该方法特异、敏感、重复性好,临床样品的检测进一步证明了该方法可以应用于免疫抗体的监测和流行病学调查。
1 材料与方法
1.1 材料
p ET32a(+)载体由农业部兽用生物制品工程技术重点实验室保存;限制性内切酶为宝生物工程(大连)有限公司产品;Trizol试剂为Invitrogen公司产品;反转录试剂盒、Taq酶、大肠埃希菌DH5α、BL21感受态细胞为北京全式金生物技术有限公司产品;质粒提取试剂盒和琼脂糖凝胶回收试剂盒为杭州Axygen公司产品;HRP标记的兔抗猪IgG和兔抗鼠IgG为北京博奥森生物技术有限公司产品;DAB显色试剂盒为武汉博士德生物工程有限公司产品;其他常规用试剂为国产或进口分析纯。His标签单抗为 Abmart公司产品;PRRSV、PCV-2、PRV阳性标准血清农业部兽用生物制品工程技术重点实验室保存,BVDV阳性血清为中国兽医药品监察所生产,待检血清由农业部兽用生物制品工程技术重点实验室在江苏、河北、山东、安徽、新疆等地猪场采集。
1.2 方法
1.2.1 E2基因片段的PCR扩增 根据CSFV-E2基因序列设计引物:F:CCGGAATTCCGGCTGTGCCCGTT-TGATACGAGTC;R:CAAGCTTGTCTTTAGGTCTGCATGGCATAGG,预计扩增片段560 bp,上下游引物引入Eco RⅠ和Hin dⅢ位点,以上引物由南京思普金生物科技有限公司合成。
取200μL猪瘟兔化弱毒疫苗毒(南京天邦生物科技有限公司提供),加入1 mL Trizol试剂,振荡混匀,静置10 min,加入200μL氯仿,剧烈振荡,4℃、12 000 r/min离心10 min,小心吸取上清,加入等体积异丙醇混匀,在-20℃放置2 h,4℃、12 000 r/min离心15 min,弃上清,加入750 mL/L乙醇洗涤,干燥,加入10μL无Rnase的双蒸水溶解RNA。
按照反转录试剂盒操作说明用引物R进行反转录,具体为:2×ES Reaction Mix 10μL;Easy Script RT/RI Enzyme Mix 1μL;引物R 1μL;RNA 5μL;无Rnase的双蒸水补足至20μL。42℃反应45 min,85℃加热5 min灭活反转录酶,以反转录产物为模板,进行PCR扩增。PCR反应体系为:上游、下游 引 物 (10 pmol/L)各 1 μL;d NTPs(2.5 mmol/L)2μL;10×PCR buffer 2.5μL;模板4μL;Taq酶(5 U/μL)0.5μL;灭菌双蒸水补至25μL。循环参数:94℃5 min;94℃30 s,52℃30 s,72℃45 s,进行35次循环;72℃10 min,4℃终止反应。10 g/L的琼脂糖凝胶电泳鉴定PCR产物。
1.2.2 重组质粒的构建和鉴定 按照试剂盒说明回收PCR产物,将回收的目的基因用Eco RⅠ和Hin dⅢ双酶切,回收纯化之后与同样酶切处理的p ET32a(+)连接,连接产物转化E.coli DH5α感受态细胞,涂布含氨苄青霉素的LB平板,37℃培养。挑取平板上的菌落,在含氨苄青霉素的LB培养基培养,提取质粒,经PCR和Eco RⅠ和Hin dⅢ双酶切鉴定,阳性质粒p ET32a-e2获得目的条带。阳性质粒送南京思普金生物科技有限公司进行测序。
1.2.3 重组表达菌株BL21-△E2的构建与蛋白表达经序列测定正确的重组质粒pET32a-e2转化大肠埃希菌BL21(DE3)感受态细胞,挑取单菌落接种于含有氨苄青霉素的LB培养基中,37℃过夜培养。取过夜培养的菌液接种于新的培养基中,37℃培养至OD600 nm达到0.6,加入终浓度为0.5 mmol/L的IPTG诱导表达4 h,4℃、8 000 r/min离心10 min收集细菌,PBS重悬菌体沉淀,超声波裂解细菌,直至菌液变得清澈,4℃、8 000 r/min离心10 min,沉淀与上清进行SDS-PAGE鉴定。蛋白的纯化参照按照GE公司His Trap HP亲和纯化柱操作说明进行。分光光度计测定蛋白浓度,分装后-20℃保存。
1.2.4 重组蛋白的 Western blot鉴定 SDSPAGE结束后,采用半干转印的方法将蛋白转印至NC膜(Pall)上,用含50 g/L脱脂乳的PBST封闭2 h;加入稀释的His标签单抗和阳性猪血清,室温孵育2 h;PBST洗涤3次;加入1∶2 000稀释的兔抗鼠IgG-HRP或兔抗猪IgG-HRP,室温轻摇1.5 h;PBST洗涤3次,用DAB显色试剂盒显色。
1.2.5 ELISA方法的建立
1.2.5.1 抗原最佳包被浓度和血清最佳稀释度的选择 按方阵法进行,以p H 9.6的碳酸盐缓冲液将抗原蛋白分别稀释至终浓度为2.0、1.0、0.5、0.25 μg/mL,4℃过夜包被酶标板(Nunc)。洗涤后加入以1∶50、1∶100、1∶200、1∶400、1∶800、1∶1 600稀释的猪瘟病毒阳性血清和阴性血清,每个稀释度重复一次,取其平均值,计算各条件下P/N值,选择阳性血清OD值接近1、P/N值最大的反应条件作为ELISA最佳反应条件。
1.2.5.2 封闭液的选择 以1.2.5.1中确定的最佳抗原浓度包被酶标板,洗涤后,分别用含50 g/L脱脂乳、10 g/L BSA、5 g/L BSA和10 g/L明胶的PBST 200μL/孔37℃封闭2 h,检测7份阳性血清和1份阴性血清。计算P/N值,以筛选最佳封闭液。
1.2.5.3 待检血清作用时间的选择 按上述条件包被、封闭酶标板,加入阴阳性血清,37℃分别作用0.5、1.0、1.5、2.0 h,对其进行 ELISA 测定,计算P/N值,以筛选血清最佳作用时间。
1.2.5.4 二抗浓度的选择 按上述条件进行包被、封闭、加样,洗涤后分别加入1∶2 000、1∶4 000、1∶6 000稀释的兔抗猪IgG-HRP,100μL/孔,进行ELISA测定,以计算P/N值,以筛选二抗工作浓度。
1.2.5.5 二抗作用时间的选择 按上述条件进行包被、封闭、加样,加入二抗后37℃分别作用0.5、1、1.5 h,进行ELISA测定,比较P/N值,以选择合适的作用时间。
1.2.5.6 显色时间的选择 按照前面筛选条件进行ELISA试验,加入TMB后分别显色5、10、15、20 min,计算P/N值筛选最佳显色时间。
1.2.6 ELISA临界值的确定 将经IDEXX和武汉科前CSFV抗体ELISA试剂盒检测均为阴性的猪血清样品70份,用建立的ELISA方法检测。计算平均值(¯X)和标准差(SD),以¯X+3SD作为阳性判定标准,¯X+2SD作为阴性判定标准。
1.2.7 特异性试验 用建立的ELISA 方法对PCV-2、PRV、PRRSV、BVDV 阳性血清进行检测,检验本方法的特异性。
1.2.8 重复性试验 使用5批蛋白包被酶标板,选用5份猪血清进行批内和批间重复性试验,计算变异系数,以验证本方法的重复性。
1.2.9 临床血清样品的检测 应用本研究建立的ELISA方法对350份临床血清进行检测,以1.2.6中确定的判定标准为依据对检测结果进行判定,与IDEXX试剂盒进行比较,计算二者的符合率。
2 结果
2.1 重组质粒的构建
经过RT-PCR扩增得到目的基因,克隆入p ET32a(+)载体,提取质粒,将PCR鉴定阳性的质粒进一步经酶切鉴定(图1),可以得到相应的条带,证明克隆成功,该质粒经测序证明基因序列正确符合载体阅读框。
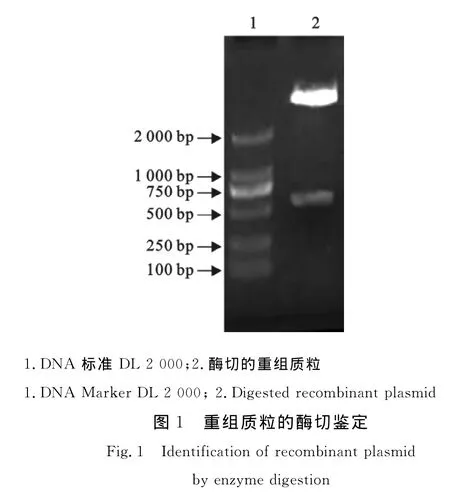
2.2 重组蛋白的表达与鉴定
挑取重组菌进行蛋白的诱导表达,收集菌体,裂解后分离包涵体和上清,与空质粒转化的BL21诱导产物一起进行SDS-PAGE,在38 ku处有明显的目的蛋白条带,且主要以包涵体形式存在,空质粒对照无相应条带;对目的蛋白进行纯化,可以得到高纯度的重组蛋白(图2),蛋白浓度为1.2 mg/mL。
采用His单抗以及阳性猪血清对目的蛋白进行Western blot鉴定,均可检测到特异的条带,证明重组蛋白具有良好的反应原性(图3)。


2.3 ELISA反应条件的优化及判定标准的确定
经方阵法测定,选取阳性血清OD值接近1,P/N最大的条件最终确定抗原最佳包被浓度为0.5 μg/mL(0.05μg/孔),血清最佳稀释度为1∶100(表1)。通过设置不同反应条件,检测7份阳性血清和1份阴性血清,以阴阳性血清OD值和P/N值为判定依据,最终确定:5 g/L BSA为最佳封闭液;待检血清反应时间为1 h;洗涤后加入1∶2 000稀释的兔抗猪IgG-HRP作用45 min;充分洗涤后加入TMB显色10 min(表2~表6)。
按上述反应条件进行ELISA检测70份阴性血清,计算平均值为0.21,SD为0.06。因此,血清OD≥0.21+3SD=0.39为阳性,≤0.21+2SD=0.33为阴性,介于二者之间为可疑,重复检测一次,如仍为可疑,则判为阳性。

表1 抗原最佳包被浓度和血清最佳稀释度的选择Table1 Determination of optimal concentration of antigen and dilution of serum
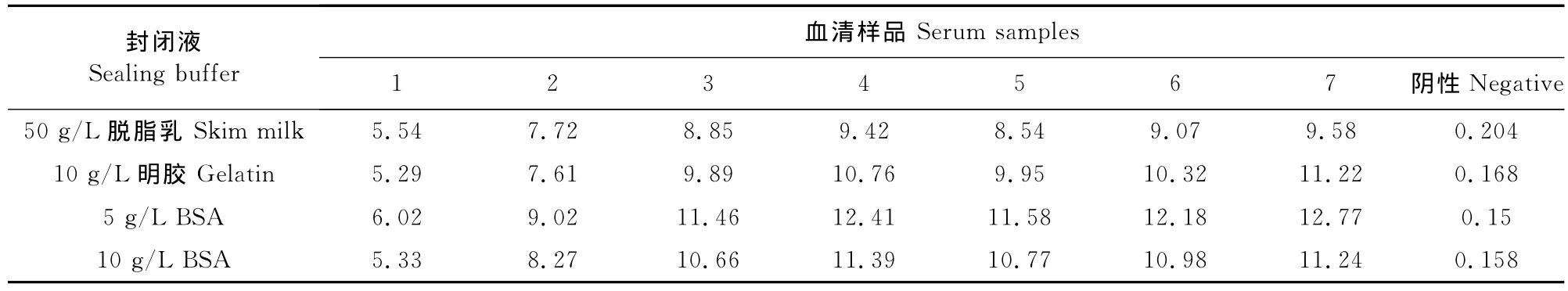
表2 封闭液的选择Table2 Determination of optimal sealing buffer
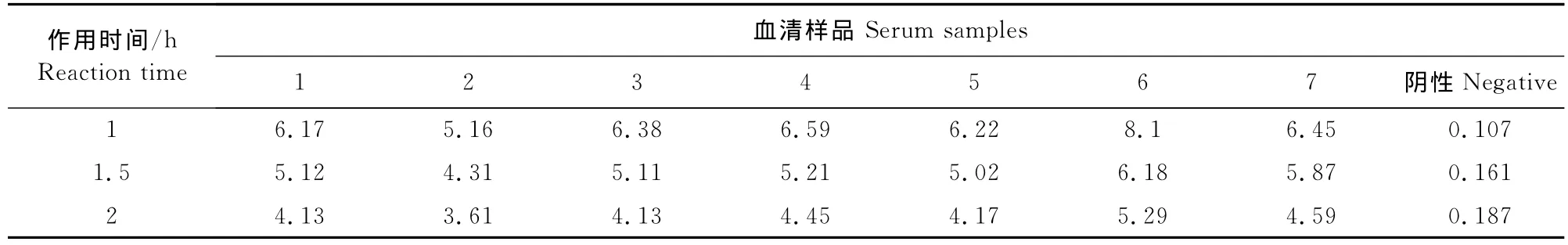
表3 待检血清作用时间的选择Table3 Determination of optimal serum reaction time

表4 二抗浓度的选择Table4 Determination of optimal dilution of rabbit anti-pig IgG-HRP
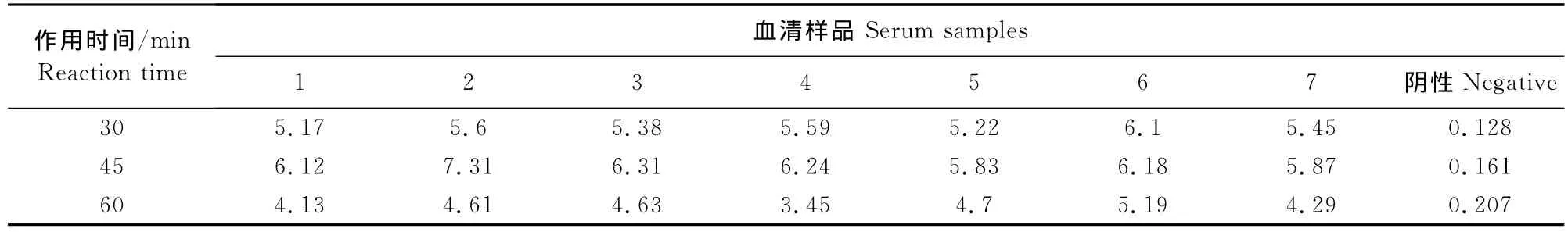
表5 二抗作用时间的选择Table5 Determination of optimal reaction time of rabbit anti-pig IgG-HRP
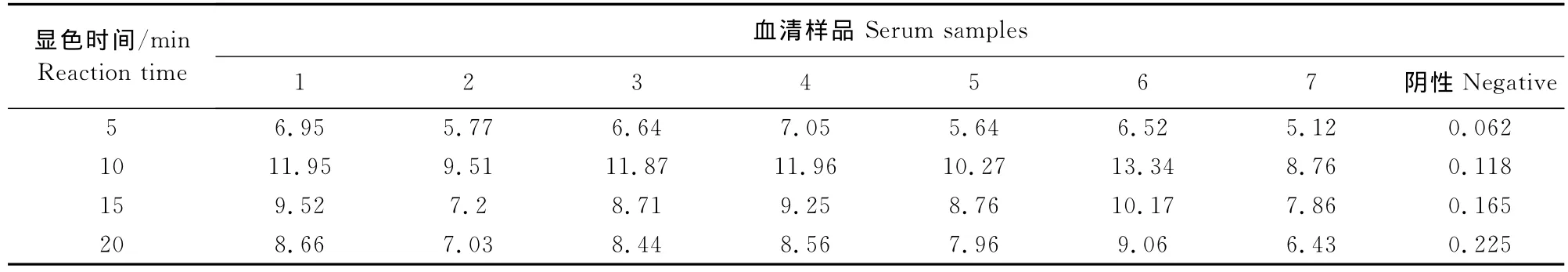
表6 显色时间的选择Table6 Determination of optimum reaction time of substrate
2.4 特异性与重复性
应用本方法检测 PCV-2、PRV、PRRSV、BVDV阳性血清,OD值均小于0.15,为阴性,证明本方法具有很高的特异性。用同一批蛋白以及3批不同的蛋白包被酶标板检测5份血清,批内变异系数<5%,批间变异系数<8%,证明本方法具有良好的重复性。
2.5 临床样品的检测
用建立的△E2-ELISA方法与IDEXX ELISA试剂盒对350份不同地区猪场的血清样品进行检测。△E2-ELISA 检 测 阳 性 率 为 77.71% (272/350),IDEXX 试剂盒检测阳性率为67.14%(235/350),△E2-ELISA与IDEXX试剂盒阳性符合率91.06%(214/235),阴性符合率50%(57/115),总符合率77.43%(271/350)。

表7 临床样品的检测结果Table7 Results of field pig serum detection
3 讨论
E2是CSFV主要的保护性抗原,含有B细胞表位,可以诱导中和抗体的产生;且含有T细胞表位[12]。E2蛋白690~866位氨基酸包含A~D4个抗原区,其中A、B、C区对于中和抗体的产生发挥主要作用,且A区在不同毒株之间是保守的[5]。先前国内报道大都选择包含A~D抗原区的片段进行原核表达,本研究中我们只扩增了包含抗原区A的基因片段,克隆入原核表达载体进行表达,经阳性猪血清进行Western blot鉴定显示重组蛋白具有良好的反应原性。
CSFV与BVDV同属瘟病毒属成员,其E2蛋白在抗原性方面存在同源性,诱导的抗体存在交叉反应,BVDV可以感染猪,造成亚临床感染并且干扰猪瘟疫苗免疫效果,所以血清学诊断方法的特异性对CSFV抗体的检测十分重要。先前许多报道建立ELISA方法没有对此进行检测,有的出现弱阳性反应,不能完全排除交叉反应。因此,本方法是否与BVDV血清存在交叉反应是我们所关注的,用△E2-ELISA方法检测BVDV标准阳性血清,结果为阴性,表明所表达的重组蛋白具有良好的特异性。这可能与本试验选择的表达区域位置有关,只包含抗原区A,从而避免了交叉反应的出现。同时对PCV-2、PRV、PRRSV 的阳性血清进行检测,均为阴性,表明建立的方法具有良好的特异性。
将建立的△E2-ELISA方法用于临床样品的检测,阳性率为77.71%,IDEXX ELISA试剂盒检测阳性率为67.14%,阳性符合率91.06%,阴性符合率50%,总符合率77.43%。阳性检出率高于试剂盒的检出率,可能原因是IDEXX试剂盒采用阻断ELISA方法,检测的是针对单抗识别的单一表位,而△E2-ELISA检测的是针对蛋白上所有表位的抗体。本试验中还有部分血清(21份)经试剂盒检测为阳性,但△E2-ELISA检测为阴性,这种现象与先前一些报道结果类似[13-14],具体原因有待进一步试验证实。
综上所述,本研究成功构建了表达E2主要抗原区的原核表达载体,以纯化的△E2蛋白为包被抗原,通过反应条件的优化,建立了CSFV E2蛋白IgG抗体ELISA检测方法,特异性、敏感性高,重复性好。对大量临床血清检测,与IDEXX阻断ELISA抗体检测试剂盒进比较,结果较为理想,这为临床免疫效果的监测和研制CSFV抗体ELISA检测试剂盒奠定了基础。
[1]Dong X N,Chen Y H.Marker vaccine strategies and candidate CSFV marker vaccines[J].Vaccine,2007,25(2):205-230.
[2]Weiland E,Stark R,Haas B,et al.Pestivirus glycoprotein which induces neutralizing antibodies forms part of a disulfidelinked heterodimer[J].J Virol,1990,64(8):3563-3569.
[3]Wang Z,Nie Y,Wang P,et al.Characterization of classical swine fever virus entry by using pseudotyped viruses:E1 and E2 are sufficient to mediate viral entry[J].Virology,2004,330(1):332-341.
[4]Dong X N,Chen Y H.Candidate peptide-vaccines induced immunity against CSFV and identified sequential neutralizing determinants in antigenic domain A of glycoprotein E2[J].Vaccine,2006,24(11):1906-1913.
[5]张富强,李志华,张念祖.猪瘟病毒囊膜结构(糖)蛋白Erns和E2的生物学特性研究[J].中国预防兽医学报,2005,27(6):465-468.
[6]Sun Y,Liu D F,Wang Y F,et al.Generation and efficacy evaluation of a recombinant adenovirus expressing the E2 protein of classical swine fever virus[J].Res Vet Sci,2010,88(1):77-82.
[7]Ganges L,Nunez J I,Sobrino F,et al.Recent advances in the development of recombinant vaccines against classical swine fever virus:cellular responses also play a role in protection[J].Vet J,2008,177(2):169-177.
[8]谢金文,李 娇,董 林,等.猪瘟病毒E2基因原核表达及间接ELISA检测方法的初步建立[J].中国兽医杂志,2011,47(3):28-30.
[9]Li G X,Zhou Y J,Yu H,et al.A novel dendrimeric peptide induces high level neutralizing antibodies against classical swine fever virus in rabbits[J].Vet Microbiol,2012,156(1-2):200-204.
[10]尹双辉,尚佑军,刘艳红,等.可溶性E2蛋白作为抗原的检测猪瘟病毒血清抗体间接ELISA方法的建立[J].中国兽医学报,2009,29(12):1529-1533.
[11]Sorensen H P,Mortensen K K.Advanced genetic strategies for recombinant protein expression in Escherichia coli[J].J Biotechnol,2005,115(2):113-128.
[12]Ceppi M,de Bruin M G,Seuberlich T,et al.Identification of classical swine fever virus protein E2 as a target for cytotoxic T cells by using mRNA-transfected antigen-presenting cells[J].J Gen Virol,2005,86:2525-2534.
[13]温国元,李 坤,邵华斌,等.猪瘟病毒E2蛋白的原核表达及抗体间接ELISA检测方法的建立[J].湖北农业科学,2009,48(11):2632-2635.
[14]张险朋,潘 杰,温清萍,等.猪瘟间接血凝试验与ELISA试验结果的相关性探讨[J].中国畜牧兽医,2007,34(6):89-90.

