口服生化黄腐酸抗炎镇痛作用初步研究
高金岗,石习霞,周连宁,郝清玉
(海南师范大学生命科学学院 热带动植物生态学省部共建教育部重点实验室,海南海口571158)
生化黄腐酸(biochemical fulvic acid ,BFA)是模拟自然界腐殖酸形成环境,将特定的多种微生物菌种接种到植物培养基中,生成的高纯度腐植酸制剂。1992年,我国出现以秸杆为原料的发酵黄腐酸(生化黄腐酸)。与矿源黄腐酸(MFA)相比,其分子量更小,因生产中未经高温、高压、强酸、强碱等处理,保留了多种氨基酸、多糖、核酸和微量元素,故生物活性更高[1-2]。动物试验表明,BFA 作为饲料添加剂能明显提高动物的抗炎能力[3-4],尤其对奶牛乳房炎、隐性乳房炎的防治效果特别明显,有效率达100%,治愈率达80%[5]。在临床上,马庆凯等[6]用黄腐酸钠来进行灌肠治疗慢性非特异性结肠炎,其临床短期疗效肯定,总有效率达96.1%。
由于BFA出现的时间较MFA晚,目前主要是作为外敷辅助抗炎制剂和饲料添加剂使用,而作为口服制剂用于抗炎及镇痛的研究报道尚不多见。因此,本文通过建立动物炎症模型,观察口服BFA对小鼠急慢性炎症模型的影响及小鼠在镇痛扭体试验中的反应,初步研究口服BFA的抗炎镇痛作用,从而为BFA的抗炎镇痛研究提供参考资料。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组 试验选用健康同龄纯种小鼠80只,其中,雌雄各40只,体重18 g~20 g,由第一军医大学实验动物中心提供。小鼠随机分为8组,每组10只,雌雄各半。其中,1组~4组为添加BFA的试验组(二甲苯致小鼠耳廓肿胀试验;小鼠腹腔毛细血管通透性试验;小鼠琼脂肉芽肿试验;小鼠镇痛扭体试验);5至8组为相应添加生理盐水对照组。
1.1.2 主要药品和试剂 BFA由河北深州市特种化工厂出产,纯度为99%以上;伊文思蓝为Fluka进口分装品。
1.1.3 主要仪器 紫外可见光分光光度计(UV-2000,上海尤尼科),电子天平(TP-214,德国赛多利斯),离心机(RI-2C,湖南星科)等。
1.2 方法
将小鼠按照分组在普通级实验室条件下分笼(雌雄分开)饲养30 d。试验组和对照组均正常饮水及喂食。30 d后,对4组试验组小鼠灌胃给药[7]。每只给BFA溶液0.2 mL,用量为每天50 mg/kg(经预试验确定),每天1次,连续给药10 d。对照组小鼠平行灌胃给等量的生理盐水溶液。然后,进行以下试验。
1.2.1 二甲苯致小鼠耳廓肿胀试验 试验小鼠在末次灌胃给药30 min后,对照组和BFA组均用0.03 mL二甲苯均匀涂抹在小鼠右耳廓两面致炎,左耳不涂为对照,致炎1 h后,可见右耳廓增厚、微红,略微透明。用8 mm打孔器沿耳缘打下相应部位的左右耳片,在电子分析天平上称重,计算肿胀度和抑制率。计算公式[8]如下:


1.2.2 小鼠腹腔毛细血管通透性试验 试验小鼠在末次灌胃给药1 h后,对照组和BFA组均腹腔注射6 mL/L醋酸溶液0.2 mL/只,在醋酸的刺激下形成腹腔内炎症,导致腹腔内毛细血管通透性增加。30 min后给尾静脉注射20 g/L依文思蓝溶液,0.1 mL/10 g。20 min后颈椎脱臼处死小鼠,打开腹腔,用10 mL生理盐水分多次冲洗小鼠腹腔,收集冲洗液合并后加入生理盐水至10 mL,离心,取上清液于590 nm比色,以吸光度(OD)值判断小鼠腹腔毛细血管的通透性[9]。
1.2.3 小鼠琼脂肉芽肿试验 对照组和BFA组的试验小鼠在末次灌胃给药前,均于背部皮下注入经高压灭菌的20 g/L琼脂(0.2 mL/只)。于末次灌胃给药1 h后,颈椎脱臼处死小鼠,剪开背部皮肤,剥离出琼脂肉芽肿块,在电子分析天平上称重,计算肉芽湿重(mg/10 g)和抑制率。公式[10]如下:

1.2.4 小鼠镇痛扭体试验 对照组和BFA组试验小鼠在末次灌胃给药1 h后,均腹腔注射6 mL/L醋酸溶液0.2 mL/只,在醋酸的刺激下会形成腹腔内炎症,导致渗出,而使小鼠产生疼痛扭体反应(腹部收缩内凹、臀部抬高、扭动等)。观察记录小鼠20 min内的扭体次数,作为试验镇痛指标并计算镇痛百分率。计算公式如下:

1.2.6 统计方法 试验数据应用SPSS 13.0软件作统计学处理。结果用平均值±标准差(¯X±s)表示,显著性差异用两样本平均数差异t检验。检验结果以P<0.05代表差异显著。
2 结果
2.1 二甲苯致小鼠耳廓肿胀试验
根据公式(1)计算的小鼠耳廓肿胀度见表1。试验结果显示,添加BFA的试验组耳廓肿胀度明显低于对照组,肿胀度平均值分别为1.96 mg和3.78 mg;根据公式(2)计算的肿胀度抑制率为34.06%。数据经统计学处理,BFA试验组与对照组相比差异显著(P<0.05),表明BFA对二甲苯所致小鼠耳廓肿胀有显著地抑制作用(表1)。
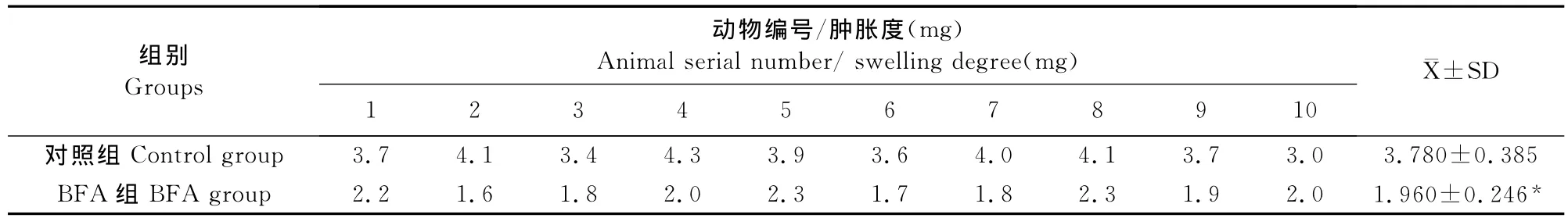
表1 BFA对二甲苯所致小鼠耳肿胀的影响Table1 Effect of BFA on Xylene-induced ear swelling in mice
2.2 小鼠腹腔毛细血管通透性试验
试验结果显示,添加BFA试验组的腹腔液的OD值明显低于对照组,OD值平均值分别为0.195和0.306。数据经统计学分析,BFA试验组与对照组相比差异显著(P<0.05),表明BFA对醋酸所致小鼠腹腔毛细血管的通透性增高有明显抑制作用(表2)。
2.3 小鼠琼脂肉芽肿试验
根据公式(3)计算的小鼠肉芽湿重见表3。试验结果显示,添加BFA的试验组肉芽肿湿重明显低于对照组,肉芽湿重平均值分别为0.157和0.208;根据公式(4)计算的肉芽抑制率为24.52%。数据经统计学分析,BFA试验组与对照组相比差异显著(P<0.05),表明BFA对琼脂所致的慢性皮下肉芽肿的形成具有一定的抑制作用(表3)。
2.4 小鼠镇痛扭体试验
如表4所示,添加BFA试验组小鼠的扭体次数明显少于对照组,扭动次数的平均值分别为26.10和44.20;根据公式(5)计算的BFA镇痛百分率为40.95%。数据经统计学处理,BFA试验组与对照组相比有显著性差异(P<0.05),表明BFA对醋酸所致小鼠疼痛有明显镇痛作用。

表2 BFA对小鼠腹腔毛细血管通透性的影响Table2 Effect of BFA on celiac capillary permeability in mice

表3 BFA对小鼠皮下琼脂肉芽肿生成的影响Table3 Effect of BFA on weight of agar granuloma in mice(mg/10g)

表4 BFA对小鼠镇痛试验中扭体次数的影响Table4 Effect of BFA on writhing times in analgesic experiments in mice
3 讨论
二甲苯致小鼠耳廓肿胀试验是研究动物早期急性炎症的常用方法。试验结果显示,预防给药的BFA试验组耳廓肿胀度明显低于对照组(P<0.05)。表明BFA对二甲苯所致小鼠耳廓肿胀有显著地抑制作用。
小鼠腹腔毛细血管通透性试验也是研究动物早期急性炎症的常用方法。给小鼠腹腔内注射6 mL/L醋酸溶液,在H﹢的刺激下,腹腔内毛细血管通透性增加,血液内液体成分从血管内渗出。当静脉注射20 g/L依文思蓝(染料)溶液时,依文思蓝可与血浆蛋白瞬间结合,且牢固不易脱落,而随液体成分渗入腹腔。测量腹腔液OD值可表示炎性渗出量,即可间接反应血管通透性的高低。试验结果表明,预防给药的BFA试验组的腹腔液的OD值显著低于对照组 (P<0.05),说明BFA对醋酸所致小鼠腹腔毛细血管的通透性增高有对抗作用,可减少炎症部位血管内容物渗出,从而减轻水肿。
小鼠琼脂肉芽肿模型是用于研究以肉芽结缔组织增生为主的慢性炎症模型。结果显示,预防给药的BFA试验组肉芽肿湿重明显低于对照组(P<0.05)。表明BFA对琼脂所致的慢性皮下肉芽肿的形成有较明显的抑制作用。陈霞等[11]采用外敷的方法给药,证明了黄腐酸钠对小鼠琼脂肉芽肿的抑制作用,当黄腐酸钠的浓度达10 g/L时,抑制率最高,为22%,略低于本试验的24.52%的抑制率。这可能是因为BFA比MFA的生物活性更高所致,也可能是由于试验条件、操作方法等不同导致的试验误差所致。至于预防口服给药是否比外敷给药效果更好,这有待进一步研究确认。其抗慢性炎症的机理可能是:BFA一方面使胸腺增大,增加淋巴细胞数量,增强了机体的细胞免疫功能;另一方面,激活单核巨噬细胞系统,增加巨噬细胞的吞噬活性,增强机体的非特异性免疫力[12],从而提高了动物整体的体质及免疫水平,减轻了慢性炎症的反应。
小鼠镇痛扭体试验是一个直观的试验。给小鼠腹腔内注入6 mL/L醋酸溶液,在H﹢的刺激下形成腹腔内炎症,血管内物质渗出引起水肿,导致小鼠产生疼痛扭体反应。本试验观察到BFA试验组小鼠的扭体次数明显少于对照组(P<0.05),镇痛百分率为40.95%。表明BFA对醋酸所致小鼠的疼痛有明显镇痛作用。认为这是由于BFA可对抗腹腔毛细血管通透性增加,减少因水肿引起的压迫性疼痛的缘故。
早在北宋末年,我国就已经将腐植酸用于医药。明代《本草纲目》中记载了主要成分为腐植酸的城东朽木和乌金散壳可治疗多种炎症及镇痛。本试验表明,灌胃给药使用BFA,对动物急性、慢性炎症模型及镇痛试验中小鼠的疼痛均有不同程度的抑制作用。提示BFA作为口服制剂用于抗炎及镇痛是有效的。
自从BFA问世以来,许多学者对其安全性进行了全面的研究。通过对BFA急性毒性试验、慢性毒性试验、三致试验以及BFA对动物血象、肝、肾功能等方面的影响的研究,发现BFA毒副作用极小,具有较好的安全性[13-14]。这是BFA作为口服制剂的一个必要条件,也是BFA可用于预防给药的一个基础。相信在深入研究的基础上,有望开发出BFA类抗炎镇痛的口服新药。
[1]何立千.生物技术黄腐酸(BFA)的界定[J].腐植酸,1999(2):6-10.
[2]杨晓玲,朱京涛,张建文.生化黄腐酸的提取及其理化性质的研究[J].吉林农业大学学报,2003,25(1):18-20.
[3]李红玉.生化黄腐酸在畜牧业中的应用[J].中国畜牧兽医,2006,33(2):18-19.
[4]谷子林,任文社,黄仁录,等.生化黄腐酸在奶牛生产中的应用[J].养殖技术顾问,2004(10):4-5.
[5]杨晓松,于大力,高丽娟,等.应用生化黄腐酸对奶牛乳房炎和生产性能的影响[J].吉林畜牧兽医,2008,29(1):7-9.
[6]马庆凯,王 虹.黄腐酸钠灌肠治疗慢性非特异性结肠炎180例[J].中国冶金工业医学杂志,2002,19(5):285.
[7]赵明德.常用小型实验动物灌胃给药技术方法介绍[J].泸州医学院学报,2004,27(3):258-259.
[8]侯安继,彭施萍,项 荣.茯苓多糖抗炎作用研究[J].中药药理与临床,2003,19(3):234.
[9]曾 南,沈映君,刘旭光,等.荆芥挥发油抗炎作用研究[J].中药药理与临床,1998,14(6):24-26.
[10]陈 奇,邓文尤,张世纬.中药药理研究方法学[M].北京:人民卫生出版社,1993:272-273,353-362.
[11]陈 霞,李 红,刘 芬,等.黄腐酸钠抗炎作用的初步研究[J].白求恩医科大学学报,1997,23(4):361-362.
[12]高金岗,周连宁,张英才,等.生化黄腐酸对小鼠非特异性免疫功能的影响[J].腐植酸,2010(2):11-15.
[13]何立千,薄 芯,高天洲,等.对生物技术黄腐酸(BFA)安全性的初步探讨[J].腐植酸,1999,13(2):16-21.
[14]杨 耀.生化黄腐酸应用简介[J].腐植酸,2000(1):45-46.
——护肾

