影响坏死梭杆菌分泌白细胞毒素因素的研究
冯二凯,陈立志*,刘晓颖,汪孙杰,2,曹 阅,徐 晶,2
(1.中国农业科学院特产研究所 特种经济动物分子生物学省部共建国家重点实验室 ,吉林吉林132109;2.江苏科技大学生物与环境工程学院,江苏镇江212018)
坏死杆菌病是由坏死梭杆菌(Fusobacterium necrophorum)引起的牛、羊、鹿等家养和野生动物常见的一类传染病的总称,主要包括牛肝脓肿[1]、犊牛白喉[2]和羊腐蹄病等。坏死杆菌病临床发病率高、危害严重,给世界反刍动物养殖业造成巨大经济损失,并正在成为制约我国反刍动物养殖业健康发展的重要因素。
目前,坏死杆菌病的临床治疗以抗生素预防为主,并辅以临床处置,然而该措施并未彻底控制该病发生,反而增加了人们对食品公共安全的担忧。而据多年临床经验证实,疫苗免疫才是预防和控制坏死杆菌病的根本措施。因为坏死梭杆菌灭活苗在腐蹄病的早期治疗过程中发挥了积极作用,但也暴露其毒副作用大、免疫效果差等缺陷。因而急需开发一种针对性强、免疫效果好且毒副作用小的亚单位疫苗,以减轻坏死杆菌病给养殖业造成的巨大经济损失。
坏死梭杆菌属于条件性致病菌,能释放包括内毒素、血凝素、溶血素在内多种毒力因子,造成其致病机理非常复杂。近年来,一种对反刍动物白细胞,特别是对多形核白细胞(polymorph nuclear leukocytes,PMNs)有特异性细胞毒性作用的外毒素—白细胞毒素(leukotoxin,Lkt),因具有良好的免疫原性[3-4]而成为了研制治疗坏死梭杆菌病高效疫苗的靶标[5-7],但目前有关坏死梭杆菌白细胞毒素报道存在严重问题,内容涉及白细胞毒素的稳定性、分子质量、生物学特性等方面[8-10],这给体外制备坏死梭杆菌天然白细胞毒素疫苗造成很大困难。本研究基于已分离的坏死梭杆菌国内流行株,体外考察细菌培养条件对坏死梭杆菌分泌白细胞毒素能力的影响,为研制坏死梭杆菌天然白细胞毒素亚单位疫苗和研究白细胞毒素致病机理提供基础数据。
1 材料与方法
1.1 材料
1.1.1 细菌菌株 坏死梭杆菌FN(2)株和FN(AB)株以及抗坏死梭杆菌白细胞毒素BSBSE重组蛋白的兔血清由中国农业科学院特产研究所省部共建特种经济动物分子生物学国家重点实验室提供。
1.1.2 试剂 Ex Taq DNA聚合酶和 DL2 000为宝生物工程(大连)有限公司产品;酶标二抗为北京博奥森公司产品;其他试剂为分析纯。
1.2 方法
1.2.1 坏死梭杆菌生物型鉴定 取出-80℃贮藏的坏死梭杆菌冻干粉,1 mL灭菌生理盐水溶解后接种10 mL新鲜配制厌氧、无菌脑心浸液肉汤培养基(prereduced anaerobically sterilized brain heart infusion media,PRAS-BHI),37℃厌氧复壮培养48 h。革兰染色确认无杂菌污染。
牛源F.necrophorum流行株的生物亚型鉴定参照专利[11]完成。提取坏死梭杆菌基因组DNA,结合引物P1、P2和P3完成牛源坏死梭杆菌流行株生物型鉴定。P1和P2分别位于F.necrophorum subsp.necrophorum 亚种(Fnn)和F.necrophorum subsp.funduliform亚种(Fnf)的白细胞毒素启动子区,P3为下游公共引物(表1)。
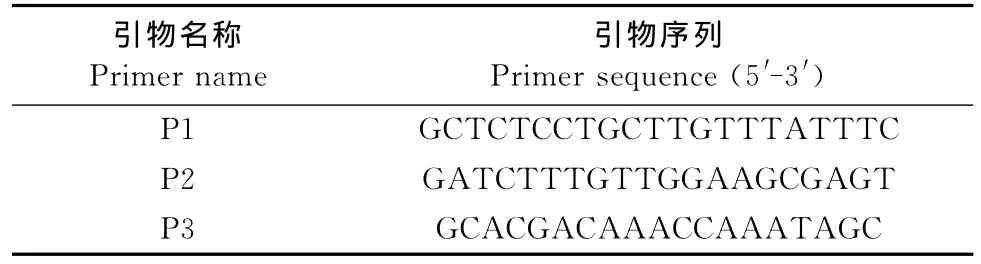
表1 坏死梭杆菌生物亚型鉴定的特异性引物Table1 The specific primers for subtype identification of F.necrophorum
反应条件:95℃10 min;94℃1min,56℃50 s,72℃1 min,30个循环;72℃10 min。反应结束后,10 g/L琼脂糖电泳检测结果。
1.2.2 坏死梭杆菌上清液白细胞毒性检测 取已复壮培养48 h的坏死梭杆菌菌液,按1∶50比例接种新配制PRAS-BHI培养基,37℃厌氧培养细菌至对数生长期(OD600 nm= 0.8 ~1.0);4℃,8 000 r/min离心30 min,收集上清,0.2μm 滤器滤过除菌,分装成小份,置-80℃保存,用于测定白细胞毒性。
无菌采集10 mL牛颈静脉血,裂解红细胞制备PMNs。RPMI-1640(100 mL/L 胎牛血清)调整细胞密度至6×106cells/mL,100μL/孔铺96孔细胞培养板,同时设空白对照,PBS填充边缘孔,置37℃、体积分数为5%的CO2培养箱中过夜培养。
培养物上清液白细胞毒性测定参照Tan Z L等[12]报道的方法,并加以改良。其过程为:次日,取出过夜培养PMNs细胞,小心吸出残留RPMI-1640,每孔加入2倍比稀释的坏死梭杆菌培养物上清液(100μL),混匀后置37℃培养箱中继续培养1 h,吸出残留培养物,PBS清洗2次,每孔加入RPMI-1640(100μL)和20μL MTS[3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium,内盐],避光继续培养4 h以形成甲瓒,492 nm处测定各孔吸光度。
1.2.3 细菌生物型对坏死梭杆菌上清液细胞毒性的影响 在PRAS-BHI培养基上,分别厌氧培养FN(2)和FN(AB)至对数生长期(OD600 nm=0.93),8 000 r/min离心制备细菌培养物上清液,并参照1.2.2检测FN(2)和FN(AB)培养物上清液的白细胞毒性,以分析细菌生物型对细菌培养物上清液白细胞毒性的影响。
1.2.4 培养基对坏死梭杆菌上清液白细胞毒性的影响 为考察培养基对培养物上清液白细胞毒性的影响,FN(2)和FN(AB)被分别在PRAS-BHI和改良MEB培养基中厌氧培养至对数生长期,离心收集培养物上清液,检测其各自培养物上清液白细胞毒性,筛选最适制备白细胞毒素的细菌培养基。
1.2.5 p H对坏死梭杆菌上清液白细胞毒性的影响分别配制p H 7.3和p H 8.0 两个梯度 PRASBHI培养基,分别接种已筛选最适坏死梭杆菌,制备培养物上清液,参照1.2.2检测其各自培养物上清液白细胞毒性,筛选最适制备白细胞毒素的细菌培养基p H(p H 8.0培养物上清液在测定活性前,用2N HCl将p H调至7.3)。
1.2.6 培养时间对坏死梭杆菌上清液白细胞毒性的影响 取已复壮最适生物型F.necrophorum接种PRAS-BHI(100 mL),37℃厌氧培养;分别在6、12、24 h取5 mL细菌培养物用于测定白细胞毒素活性。白细胞毒素制备与活性测定参照1.2.2完成。
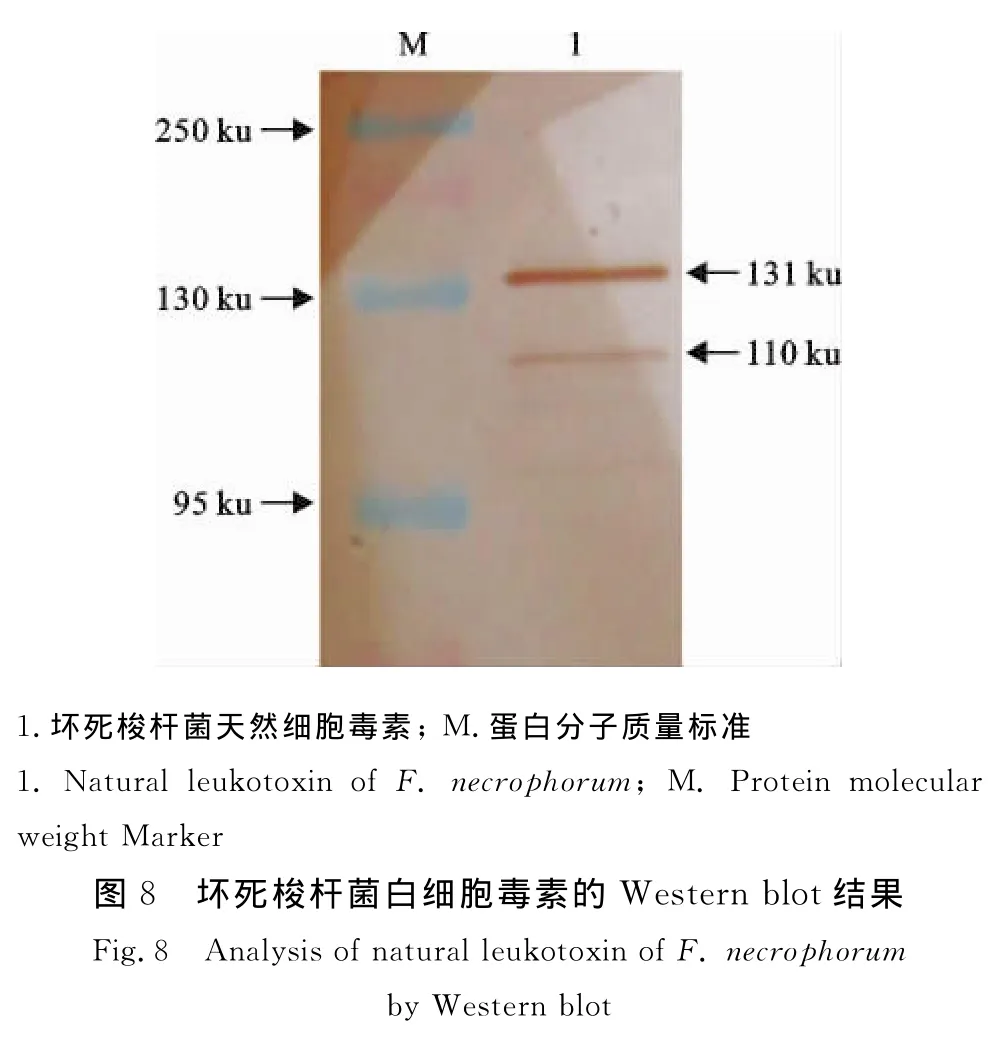
1.2.7 Western blot分析 基于已筛选的坏死梭杆菌白细胞毒素最适制备参数条件,制备坏死梭杆菌上清液3 500 mL,4℃超滤浓缩100倍(截留分子质量100 ku),并将截留产物定义为坏死梭杆菌天然白细胞毒素,分装成小份,-20℃保存备用。
坏死梭杆菌天然白细胞毒素经SDS-PAGE电泳后,半干转移至NC膜上,以抗白细胞毒素BSBSE重组蛋白兔血清为一抗,偶联辣根过氧物酶的山羊抗兔IgG为二抗,进行 Western blot分析,DAB显色,记录结果。
2 结果
2.1 坏死梭杆菌生物型鉴定
图1显示的是坏死梭杆菌生物型鉴定结果。从图中可以看出FN(AB)扩增出片段约为1 076 bp,属于A型,也就是Fnn;FN(2)株扩增片段大约为809 bp,属于B型,即Fnf。
2.2 细菌生物型对坏死梭杆菌上清液白细胞毒性的影响
细菌生物型对坏死梭杆菌培养物上清液白细胞毒性的影响如图2所示。在培养物上清液被稀释1倍~4倍范围内,FN(AB)培养物上清液的白细胞毒性要显著高于FN(2)培养物上清液的白细胞毒性(P<0.05)。
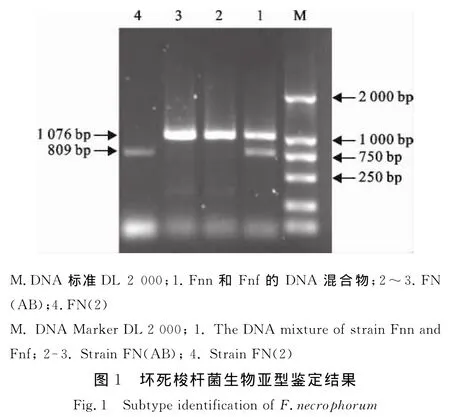
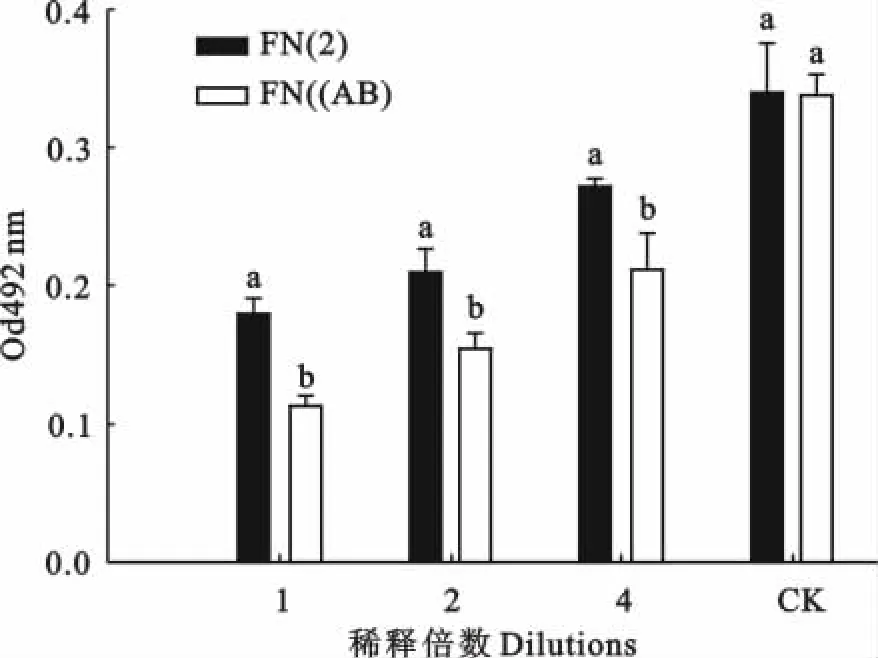
图2 细菌生物型对坏死梭杆菌上清液白细胞毒性的影响Fig.2 Effect of subtype on leukotoxicity of supernatant of F.necrophorum
2.3 培养基对坏死梭杆菌上清液白细胞毒性的影响
改良MEB培制备的细菌培养物上清液的细胞毒性低于PRAS-BHI制备的细菌培养物上清液的细胞毒性,二者差异显著(p<0.05),这种差异在FN(2)和FN(AB)上清液毒性检测过程中都存在(图3和图4)。
2.4 p H对坏死梭杆菌上清液的影响
p H为7.3的培养基制备的坏死梭杆菌上清液对PMNs的细胞毒性作用要高于p H 8.0培养基制备的细菌培养物上清液对PMNs的细胞毒性,但二者之间的差异并不显著(图5)。
2.5 培养时间对坏死梭杆菌上清液白细胞毒性的影响
坏死梭杆菌上清液的白细胞毒性自接种细菌开始呈逐渐增强趋势(图6),12 h左右时,上清液白细胞毒性达到最大值,然后开始下降,24 h时的培养物上清液白细胞毒性与6 h时的培养物上清液白细胞毒性相似。
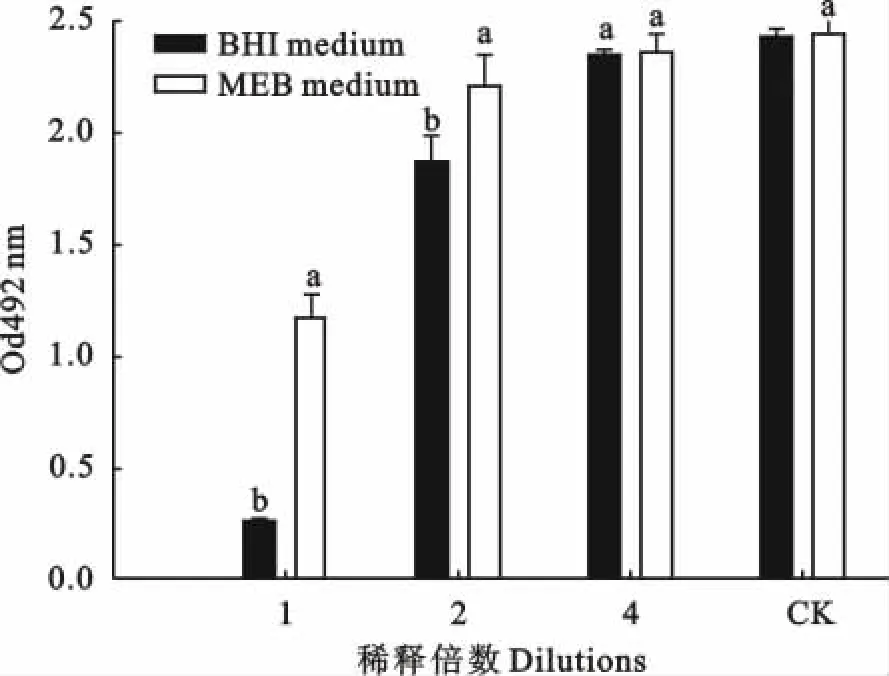
图3 培养基对FN(2)培养物上清液白细胞毒性的影响Fig.3 Effect of media on leukotoxicity of supernatant of F.necrophorum
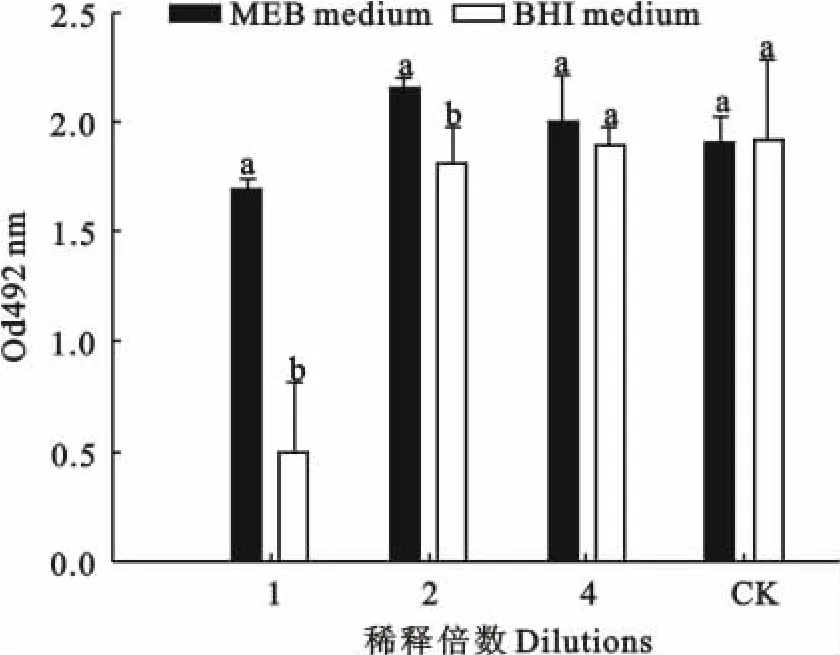
图4 培养基对FN(AB)培养物上清液白细胞毒性的影响Fig.4 Effect of media on leukotoxicity of supernatant of F.necrophorum strain AB
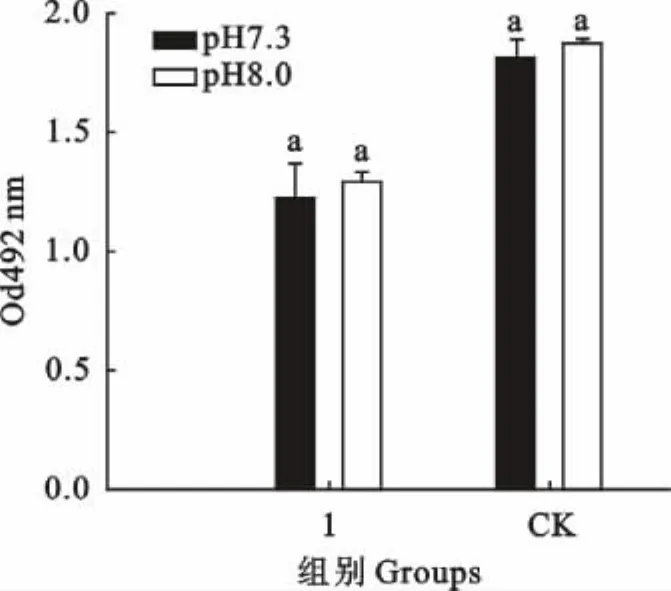
图5 p H对细菌培养物上清液白细胞毒素的影响Fig.5 Effects of p H on leukotoxicity of supernatant of F.necrophorum
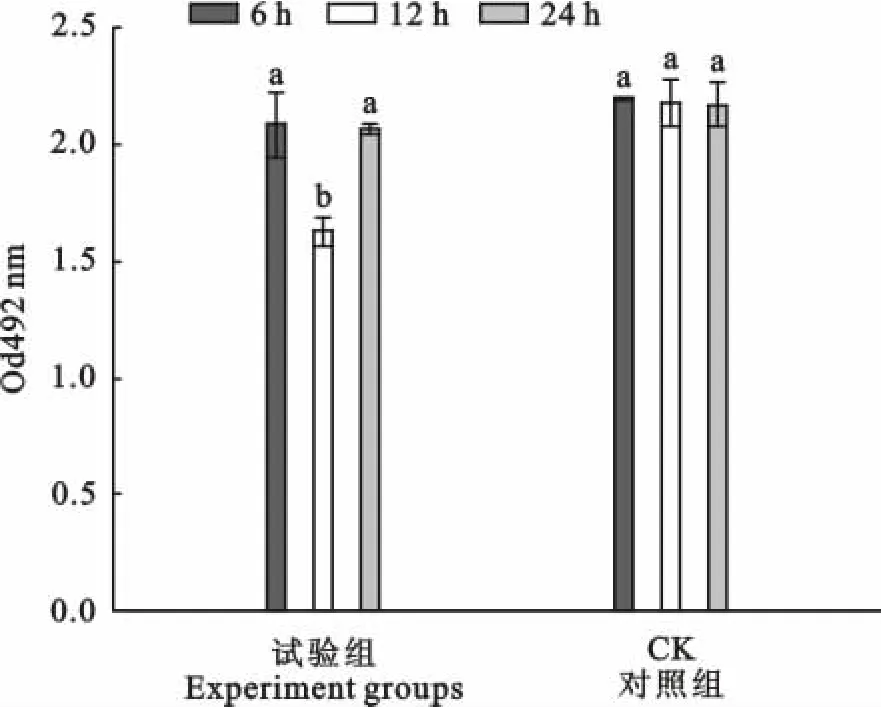
图6 培养时间对培养物上清液细胞毒性的影响Fig.6 Effects of culture time on leukotoxicity of supernatant of F.necrophorum
2.6 SDS-PAGE电泳与 Western blot分析结果
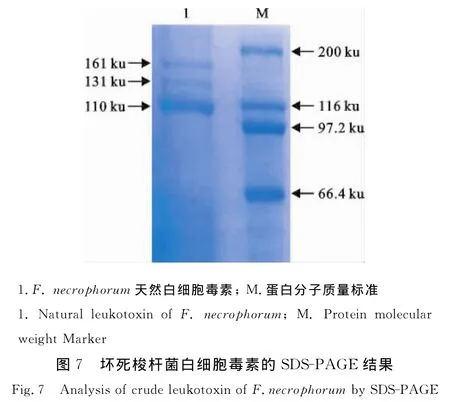
坏死梭杆菌天然白细胞毒素经SDS-PAGE后(图7),转移至NC膜上进行免疫活性分析,结果如图8所示。基于BHI培养基制备的坏死梭杆菌天然白细胞毒素,有2条带能被抗重组白细胞毒素BSBSE蛋白片段的兔血清所识别,其中131 ku蛋白质与抗重组白细胞毒素BSBSE血清反应强烈。
3 讨论
白细胞毒素是坏死梭杆菌在增殖过程中分泌至细胞外的一种毒素,因其与坏死梭杆菌致病性密切相关[13],而被认为是坏死杆菌感染宿主发病的重要毒力因子[14-15]。研究表明坏死梭杆菌分泌白细胞毒素的能力受细菌生物型、细菌浓度和培养周期等多种因素的综合影响[16]。如Sanlan C M 等[10]报道 A型坏死梭杆菌分泌白细胞毒素能力最强,AB型次之,B型最少。在本研究中,为考察细菌生物型对坏死梭杆菌培养物上清液白细胞毒性的影响,首先利用坏死梭杆菌生物型鉴定专利技术对本研究室早期分离保存的坏死梭杆菌临床分离株的生物型进行了鉴定,并根据鉴定结果比较了各自生物型细菌上清液的白细胞毒性。结果发现FN(AB)对PMNs的细胞毒性显著高于FN(2)(B型)(图2),并且这种毒性差异不因培养基的改变而改变。因而在制备类坏死梭杆菌类白细胞毒素疫苗时,应选择生物型A细菌作为生产用种子菌。
除细菌生物型外,培养基类型对培养物上清液的白细胞毒性也有很大影响。有研究表明,比起营养肉汤培养基或硫乙醇酸盐肉汤培养基,Eugon broth培养基或改良Eugon broth培养基更适合于制备白细胞毒素[17]。但本研究结果显示,无论是在以FN(AB)为种子菌的试验中,还是在FN(2)的试验中,改良MEB培养基制备的培养物上清液的白细胞毒性要远低于PRAS-BHI培养基制备的细菌培养物上清液的白细胞毒性(图3和图4),而MEB培养基以Eugon broth为主要营养成分。这表明PRAS-BHI更适合于制备坏死梭杆菌天然白细胞毒素疫苗;推测培养基影响细菌培养物上清液白细胞毒性的原因可能与培养基支持细菌生长能力差异有关。
影响培养物上清液白细胞毒性的因素还包括培养基p H和细菌培养时间。从本试验获得的结果看,培养基p H对细菌培养物上清液白细胞毒性影响并不显著(图5),但考虑到白细胞毒素的不稳定性,高p H可能会导致白细胞毒素发生降解,因此制备白细胞毒素的细菌培养基p H范围建议选择7.3;培养时间对坏死梭杆菌培养物上清液白细胞毒性的影响表现出明显地生长周期依赖性(图6)。细菌培养物上清液白细胞毒性最大值出现在对数生长期后期(10 h~12 h),然后开始下降,至24 h时,细菌培养物上清液的白细胞毒性与6 h时的细菌培养物上清液的白细胞毒性相似。推测引起细菌培养物上清液白细胞毒性下降的原因可能是进入衰老期的细菌发生裂解,释放出大量的蛋白质水解酶,导致白细胞毒素被降解[16]。
坏死梭杆菌天然白细胞毒素是一种低稳定性细胞外蛋白质,这在本研究中也得到了验证。Western blot结果发现有2条蛋白条带能被抗白细胞毒素重组蛋白BSBSE的兔血清所识别(图7),说明白细胞毒素发生了降解,但不影响其反应原性,这与Tan等报道的结果一致[9],综上所述,预还原、厌氧无菌心脑浸液肉汤培养基(p H 7.3),培养细菌10 h~12 h左右(对数生长期),此工艺条件下获取的细菌培养物上清液的白细胞毒性最大;同时超滤获得的粗提白细胞毒素经Western bolt证实也具有免疫反应性,这表明获得的生产工艺可以作为制备坏死梭杆菌天然白细胞毒素疫苗的生产工艺条件,这些数据也将为研制坏死梭杆菌白细胞毒素亚单位疫苗提供一些基础数据。
致谢:作者对北华大学生命科学研究中心主任孙新教授给予本试验的帮助表示衷心地感谢!
[1]Nagaraja T G,Chengappa M M.Liver abscesses in feedlot cattle:a review [J].J Anim Sci,1998,76:287-298.
[2]Nagaraja T G,Narayanan S K,Stewart G C,et al.F.necrophoruminfections in animals:pathogenesis and pathogenic mechanisms[J].Anaerobe,2005,11:239-246.
[3]Clark B L,Emery D L,Steward D J,et al.Studies of immunization of cattle against interdigital necrobacillosis [J].Aust Vet J,1986,63:107-110
[4]Tan Z L,Lechtenberg K F,Nagaraja T G,et al.Serum neutralizing antibodies against F.necrophorumLeukotoxin in cattle with experimentally induced or naturally developed hepatic ab-scess[J].J Anim Sci,1994,72(2):502-508.
[5]Nagaraja T G,Chengappa M M.F.necrophorumLeukotoxin vaccine[P]:US,005455034A,1995-10-3.
[6]Saginala S,Nagaraja T G,Tan Z L,et al.The serum neutralizing antibody response in cattle to F.necrophorumLeukotoxoid and possible protection against experimentally induced hepatic abscesses[J].Am J Vet Res,1996,57(4):483-488.
[7]Saginala S,Nagaraja,T G,Lechtenberg,K F,et al.Effect of F.necrophorumLeukotoxoid vaccine on susceptibility to experimentally induced liver abscesses in cattle [J].J Anim Sci,1997,75(4):1160-1166.
[8]Garacia M M,Alexander D C,Mckay K A.Biological characterization of F.necrophorum cell fractions in preparation for toxin and immunization studies[J].Infect Immun,1975,11:609-611.
[9]Tan Z L,Nagaraja T G,Chengappa M M,et al.Biological and biochemical characterization of F.necrophorumLeukotoxin[J].Am J Vet Res,1994,55:515-521.
[10]Scanlan C M,Berg J N,Campbell F F.Biochemical characterization of the leukotoxin of three bovine strains of F.necrophorum [J].Am J Vet Res,1986,47:1422-1425.
[11]陈立志,姚志利,王克坚,等.一种坏死梭杆菌的基因检测分型方法及试剂盒[P].中国:201010289795.4.2011-01-26.
[12]Tan Z L,Nagaraja T G,Chengappa M M.Factors affecting leukotoxin activity of F.necrophorum [J].Vet Microbiol,1992,33:15-28.
[13]Coyle-Dennis J E,Lauerman L H.Correlations between leukocidin production and virblence of two isolates of F.necrophorum [J].Am J Ver Res,1979,40:274-276.
[14]Narajanan S K,Chengappa M M.Immunogenicity and protective effects of truncated recombinant leukotoxin proteins of F.necrophorumin mice[J].Vet Microbiol,2003,93(4):335-347
[15]Sun,D B,Wu R,Li G L,et al.Identification of three immunodominant regions on leukotoxin protein of F.necrophorum[J].Vet Res Commun,2009,33(7):749-755.
[16]Tan Z L,Nagaraja T G,Chengappa M M.Factors affecting leukotoxin activity of F.necrophorum [J].Vet Microbiol,1992,32(1):15-28.
[17]Emery D L,Duffy J H,Clark B L.Biochemical and functional properties of a leukocidin produced by several strains of F.necrophorum [J].Aust Vet J,1984,61:382-387

