三种免疫增强剂对猪细小病毒抗体水平的影响
魏光河,李薇伊
(1.西南大学荣昌校区动物医学系,重庆402460;2.重庆市动物卫生监督所,重庆401121)
猪细小病毒病是由细小病毒科猪细小病毒(Porcine parvoviurs,PPV)引起的以初产母猪产死胎、畸形胎、木乃伊胎及病弱仔猪,偶有流产,但经产母猪本身无明显症状的一种猪繁殖障碍性疾病[1-2]。该病毒在世界范围内广泛存在并呈地方性流行,给生猪的繁殖、发展带来了巨大的经济损失,严重影响着养猪业的发展[3]。目前,免疫接种是猪细小病毒病的主要防控手段。有关猪细小病毒病防控措施的探讨报道较多,影响猪细小病毒的抗体水平的因素也有报道,但应用具体数据佐证影响猪细小病毒抗体滴度及探讨如何提高猪细小病毒抗体滴度的方法未见报道。本研究选择临床及实验室常用的3种不同免疫增强剂,探讨对猪细小病毒抗体滴度的影响,寻找提高猪细小病毒抗体滴度的新方法及措施,以期应用于生产实践,并为研制高滴度猪细小病毒血清奠定基础和提供技术支持。现报道如下。
1 材料与方法
1.1 材料
1.1.1 主要试剂 猪细小病毒灭活疫苗,批号1002003,齐鲁动物保健品有限公司生产;盐酸左旋咪唑注射液,批号20100201,四川鼎尖动物药业有限责任公司;猪基因工程α干扰素,批号09102103,大连三仪动物药品有限公司;蜂胶液,生产日期2010年12月28日,两年有效期,绵阳蜂之吻蜂业生产;猪细小病毒乳胶凝集试验抗体检测试剂盒,批号100401,武汉科前动物生物制品有限公司。
1.1.2 试验场址及试验用动物 试验猪场为西南大学荣昌校区西南养猪场;试验用动物为从荣昌县昌元镇石河村一个体养猪户购买的一窝12头30日龄断奶的健康荣昌仔猪。该荣昌仔猪及母猪均未免疫接种细小病毒疫苗,血凝抑制试验检测PPV均呈阴性。
1.2 方法
1.2.1 试验用动物分组及免疫接种 将购买的仔猪转入试验猪场,观察7 d,随机分为4组,每组3头,命名为干扰素组、蜂胶试验组、盐酸左旋咪唑组及单一猪细小病毒疫苗组。在单一细小病毒疫苗相同疫苗使用剂量基础上,将干扰素、蜂胶和盐酸左旋咪唑分别按表1第1次~第4次免疫添加的不同剂量,将其与猪细小病毒灭活疫苗混合,颈部肌肉注射于试验猪。其中,第2、3、4次免疫接种均为上次免疫接种后的第7天进行;前3次每次免疫接种均在采血后进行,第4次采血在加强免疫接种后进行(表1)。
1.2.2 血样的采集及血清的制备 前腔静脉采血,按5 mL/头/次分别于前3次免疫接种前采集血液,最后1次加强免疫接种后的第2天从前腔静脉采集血液。采集鲜血转入灭菌5 mL离心管(有盖),编号,37℃恒温培养箱静置10 min~15 min,后转入4℃冰箱静置。取上清液,5 000 r/min离心10 min,上清液转入灭菌的1.5 mL离心管,即为制备的待检血清,置4℃冰箱保存备用。
1.2.3 抗体效价的检测 参照何启盖等[4]建立的乳胶凝集试验方法,根据猪细小病毒乳胶凝集试验抗体检测试剂盒说明书,按表2加样及判读结果。达到阳性凝集反应的血清最高稀释倍数,即为血清的抗体效价。凝集反应强度标准:“++++”表示全部乳胶凝集,颗粒聚于液滴边缘,液体完全透明;“+++”表示大部分乳胶凝集,颗粒明显,液体稍混浊;“++”表示约50%乳胶凝集,但颗粒较细,液体较混浊;“+”表示有少许凝集,液体呈混浊状;“-”表示液滴呈原有的均匀乳状。判定标准:当阳性对照血清加抗原呈“++++”凝集,阴性对照血清加抗原呈“-”凝集,抗原加稀释液呈“-”凝集时,以呈现“++”及其以上凝集反应判为阳性。
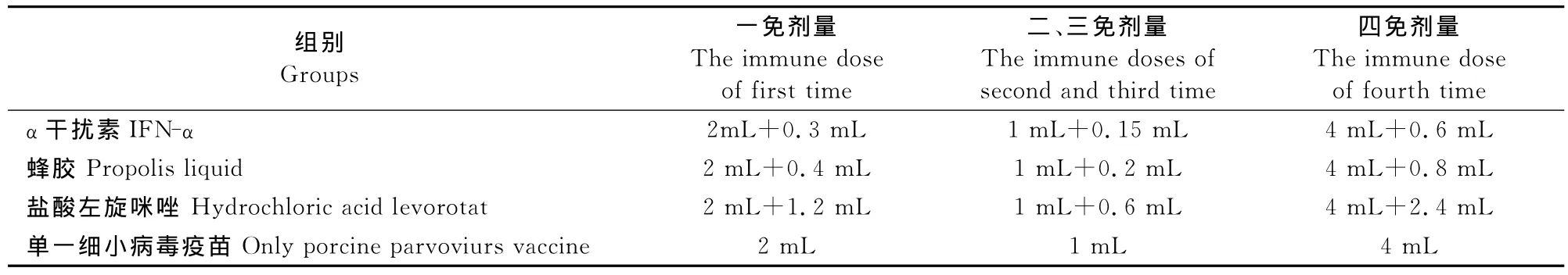
表1 3种不同免疫增强剂免疫程序及剂量Table1 The immunization programs and doses of three different immunopotentiators
1.2.4 3 种免疫增强剂对猪细小病毒抗体消长规律的影响
1.2.4.1 效价平均值的计算方法 参照姚火春等[5]所介绍的抗体效价平均值计算办法,确定干扰素、蜂胶及盐酸左旋咪唑分别作为猪细小病毒免疫接种时的免疫增强剂各组内试验猪一免、二免及三免、四免的猪细小病毒抗体效价平均值,以及干扰素组、蜂胶组、盐酸左旋咪唑组与单一猪细小病毒灭活疫苗组各组的猪细小病毒抗体效价平均值。
1.2.4.2 3种免疫增强剂对猪细小病毒的抗体消长曲线 以检测3种免疫增强剂每组3个平行样本的猪细小病毒抗体效价为基础,计算出左旋咪唑、干扰素及蜂胶作为免疫增强剂监测4次平均猪细小病毒抗体效价,以监测时间为横坐标,以对应的猪细小病毒平均抗体效价为纵坐标,作3种免疫增强剂对猪细小病毒抗体消长规律影响的动态变化曲线,并以单一细小病毒疫苗对照组作对照。
1.2.5 各免疫增强剂组间猪细小病毒抗体效价的分析 按1.2.5.1所述方法,同法计算出每种免疫增强剂最后一次免疫接种后猪细小病毒抗体效价的平均值,以此平均值为基础,单一细小病毒疫苗对照组作对照,采取单因素分析法,统计分析各免疫增强剂组间对猪细小病毒抗体效价的差异。
1.2.6 免疫接种后猪细小病毒抗体效价个体间的差异性分析 以单一细小病毒疫苗对照组为对照,参照姚火春等[5]所介绍的抗体效价平均值计算办法,确定每头试验猪只最后一次免疫接种后猪细小病毒抗体效价所对应的孔数,以此为基础,采取多重比较法作最后一次免疫接种后各试验猪只与单一细小病毒疫苗免疫接种猪只间的猪细小病毒抗体效价个体间的差异分析。
1.2.7 数据处理 试验数据用 Microsoft Excel 2010统计处理软件进行单因素及多因素统计分析。
2 结果
2.1 血清样品
通过采集各试验仔猪前腔静脉血液,制备免疫接种前及免疫接种后各试验仔猪的血清样品各4份,共计48份待血清样品。
2.2 3种免疫增强剂对猪细小病毒抗体消长规律比较
对采集的试验前、免疫接种后第7天及以后每7 d的血清样品进行乳胶凝集试验,检测各组试验猪的猪细小病毒抗水消长规律(表2)。
2.3 3种免疫增强剂对猪细小病毒抗体效价的影响
从表2可以看出,添加了免疫增强剂组的试验动物所产生的抗体效价都较单一细小病毒疫苗对照组高,蜂胶作为免疫增强剂相对于本次研究的其他两种免疫增强剂来说免疫效果最好,猪细小病毒抗体效价最高,达到28,即1∶256,适合作为猪细小病毒疫苗免疫接种时的较好免疫增强剂;干扰素和盐酸左旋咪唑作为猪细小病毒的免疫增强剂免疫效果较差,四免后平均效价均接近1∶128;低于蜂胶作为猪细小病毒免疫接种时的免疫增强剂效果。仅接种猪细小病毒疫苗的空白对照组猪细小病毒抗体效价在最后一次免疫接种后平均为1∶64,相对蜂胶组、盐酸左旋咪唑组及干扰素组的细小病毒抗体效价要低。

表2 不同免疫增强剂猪细小病毒抗体消长规律Table2 The porcine parvovirus antibody titers in three different immunopotentiators
2.4 各免疫增强剂组间猪细小病毒抗体效价差异分析
采用单因素方差分析,干扰素、盐酸左旋咪唑免疫增强剂组与单一细小病毒疫苗组所产生的猪细小病毒抗体效价比较,差异均显著(P<0.05),蜂胶组与单一细小病毒疫苗对照组抗体效价差异极显著(P<0.01);干扰素与盐酸左旋咪唑组差异不显著(P>0.05),干扰素与蜂胶组的猪细小病毒抗体效价差异显著(P<0.05),蜂胶组与左旋咪唑组的抗体效价差异不显著(P>0.05)。
2.5 免疫接种后猪细小病毒抗体效价个体间的差异性分析
采用多重比较法将单一细小病毒免疫接种组各猪只最后一次免疫接种后的猪细小病毒抗体效价与干扰素组、蜂胶组、盐酸左旋咪唑组的各试验猪只最后一次免疫接种后的猪细小病毒抗体效价比较可知,免疫接种后,单一细小病毒免疫接种组3头单个猪只的猪细小病毒抗体效价与干扰素组、蜂胶组及盐酸左旋咪唑组的所有单个试验猪只的细小病毒抗体效价个体间差异不显著(P>0.05)。
3 讨论
免疫接种时使用免疫增强剂,是提高被免疫动物特异性血清抗体效价的手段之一,免疫增强剂种类、免疫接种剂量、免疫接种途径、免疫接种次数和免疫接种间隔时间的最佳选择也与提高免疫动物特异性血清抗体效价紧密相关[6-7],而母源抗体水平直接影响免疫增强剂的效果。通过试验猪只的选择及对试验猪只猪细小病毒抗体水平的监测结果显示,所有试验猪只包括对照组猪只的猪细小病毒抗体效价均为零,说明该批试验猪只符合本次研究要求。
本研究选择30日龄左右的9头健康荣昌仔猪用蜂胶、盐酸左旋咪唑和干扰素作为免疫接种猪细小病毒疫苗的免疫增强剂和3头单一细小病毒疫苗对照组试验猪的试验中,用蜂胶作为免疫增强剂的试验猪细小病毒抗体水平达到1∶32及以上,该组所有试验猪的细小病毒抗体水平均高于单一细小病毒疫苗对照组至少一个梯度。这与王茹等[8-9]研究报道的蜂胶具有免疫增强作用,能促进血清蛋白和丙种球蛋白含量提高,提高抗体的特异性保护力等作用机理一致。在以盐酸左旋咪唑为免疫增强剂的试验组中,试验猪的细小病毒抗体水平不及蜂胶组,但高于仅免疫接种猪细小病毒疫苗的空白对照组,说明盐酸左旋咪唑对猪细小病毒疫苗具有一定的免疫增强作用。因为盐酸左旋咪唑是咪唑的左旋异构体,在免疫方面具有双重作用,一是恢复周围效应细胞的功能,可使低活性的T细胞、巨噬细胞和中性粒细胞的功能恢复到正常水平;二是诱导T细胞和粒细胞的分化成熟,T细胞转变成致敏淋巴细胞,产生MAF和MIF等淋巴因子,进一步活化巨噬细胞[10]。干扰素作为动物机体感染疾病过程的一种产物,既能通过在细胞内合成具有不损害细胞本身且抗病毒作用的蛋白质(AVP)而具有很广的抗病毒作用;还具备高浓度的IFN可抑制B细胞产生抗体和低浓度的IFN可促进抗体产生作用等免疫调节功能。本次研究表明,干扰素作为猪细小病毒免疫接种时的免疫增强剂,当最后一次加强免疫接种时,试验猪只的猪细小病毒抗体滴度平均接近1∶128,比单一猪细小病毒疫苗免疫接种组的平均抗体效价1∶64相对高了一个梯度,应证了王忠海、曹瑞兵等[11-14]许多学者报道的干扰素的免疫调节功能。
随着第4次3种不同免疫增强剂与猪细小病毒疫苗同时免疫接种试验猪只,大部分试验猪只的细小病毒抗体效价都有较为明显的增加,尤以最后一次加强免疫接种后猪细小病毒血清抗体效价都较未免疫接种前明显增高;另外,随着免疫接种次数的增加,试验猪个体间的猪细小病毒抗体效价则呈现出平行的或类似平行的增长关系。本试验研究所测得的结果显示,免疫接种次数的多少及免疫接种剂量的大小、是否使用免疫增强剂等直接影响猪细小病毒的抗体水平。
[1]殷 震,刘景华.动物病毒学[M].2版.北京:科学出版杜,1997:1145.
[2]甄洪花,沈志强,单 虎,等.猪细小病毒结构蛋白VP2研究进展[J].动物医学进展,2009,30(8):85-88.
[3]李昌文,仇华吉,童光志.猪细小病毒研究进展[J].动物医学进展,2004,25(1):36-38.
[4]何启盖,陈焕春,吴 斌,等.检测猪细小病毒血清抗体乳胶凝集试验方法的建立及初步应用[J].中国预防兽医学报,1999,21(6):457-459.
[5]姚火春,郭霄峰.兽医微生物学实验指导[M].北京:中国农业出版社,2002:105-107.
[6]张小飞,杨 倩.复合粘膜免疫佐剂对鸡小肠细胞免疫的影响[J].畜牧兽医学报,2008,39(1):85-90.
[7]穆 杨,周丽梅.不同佐剂对新城疫疫苗对鸡体液免疫的影响[J].中国家禽,2007,29(19):12-14.
[8]王 茹,谢印乾,沈志强,等.蜂胶的免疫增强作用及其在疫苗中的应用[J].中国畜牧兽医,2007,34(2):93-95.
[9]Ítavol C C B F,Morais1 M G,Ramos1 C L,et al.Green propolis extract as additive in the diet for lambs in feedlot[J].Revista Brasileira de Zootecnia,2011,40(9):1991-1996.
[10]牛华星,李淑花,张传津.盐酸左旋咪唑-维生素E可溶性粉对鸡免疫功能增强作用的研究[J].山东畜牧兽医,2009,(8):3-5.
[11]王忠海.干扰素在狂犬病疫苗中的佐剂效果研究[J].中国药业,2009,18(24):17-19.
[12]Mack E A,Kallal L E,Demers D A,et al.Type 1 interferon induction of natural killer cell gamma interferon production for defense during lymphocytic choriomeningitis virus infection[J].MBio,2011,2(4):1-10.
[13]Le Bon A,Schiavoni G,D′Agostino G,et al.TypeⅠinterferons potently enhance humoral immunity and can promote isotype switching by stimulating dendritic cells in vivo[J].Immunity,2001,14:461-470.
[14]曹瑞兵,周国栋等.猪α干扰素对猪圆环病毒2型亚单位疫苗免疫效果的影响[J].畜牧兽医学报,2009,40(6):867-872.

