微小隐孢子虫含EF-hand结构域蛋白家族的生物信息学研究*
郭志云,杨 光,荆春霞,付芹芹,孙小会,王穗湘,李月琴,周天鸿
隐孢子虫(Cr yptosporidiu m spp.)是一种呈世界性分布的人兽共患寄生虫,已成为世界范围内水源传播疾病中的重要病原体,它能感染人和许多动物,严重危害着人类的健康和畜牧业的发展[1]。隐孢子虫机会性感染是AIDS病患者的重要致死原因,而目前还没有有效的治疗和预防方法[2]。近几年,随着全基因组测序计划的不断发展,隐孢子虫已有3个分离株(C.parvu m Iowa II,C.hominis TU502和C.muris)的全基因组测序工作完成[3-4],围绕隐孢子虫基因结构和功能的研究迅速成为热点。
EF-hand (Exchange Factor hand)结 构 域(PROSITE entry:PDOC00018,Ex PASy)是一种含有钙离子结合位点的α螺旋-中央环-α螺旋(alpha helix-loop-alpha helix)结构,两股α螺旋分别称为“E”和“F”,且几乎是垂直的,这有利于中央环与Ca2+结合而发生构象的改变,进而暴露靶结合位点而发挥生物学功能[5-6]。EF-hand motif约含有 40个氨基酸残基,常以成对形式出现在蛋白功能域中,与重要的钙离子信号有着密切的关系[7]。
我们在对隐孢子虫进行基因功能研究的过程中,发现C.par vu m Iowa II基因组中含有大量EF-hand结构域蛋白。为了更好地分析这类含有EF-hand结构域的蛋白的功能及其对微小隐孢子虫的重要意义,本文对微小隐孢子虫该蛋白家族进行了生物信息学相关分析,为进一步基因功能研究提供理论基础。
1 材料与方法
1.1 数据收集 在美国隐孢子虫基因组数据库(htt p://cr yptodb.or g/cr yptodb/)中 “Gene Text Search”信息栏输入EF-hand,初步搜索C.par vu m Iowa II基因组中推定的含有EF-hand结构域的蛋白,结合 Gen Bank中的核酸数据库(http://www.ncbi.nl m.nih.gov/)获得各蛋白相应的核苷酸序列及蛋白序列。
1.2 结构域和motif分析 将搜索获得的蛋白序列输入到NCBI的结构域搜索网站CDD(http://www.ncbi.nl m.nih.gov/Str ucture/cdd/wrpsb.cgi)中进行各蛋白的结构域搜索,以进一步确定和分析各蛋白含有EF-hand结构域以及其他结构域的情况。同时还进行Sanger网站的Pfam搜索(http://pf am.sanger.ac.uk/)验证结构域搜索结果。通过日本京都大学开发的Motif Search在线搜索工具(http://www.geno me.jp/tools/motif/),对每个蛋白进行了motif搜索。
1.3 序列比对 利用NCBI BLAST功能中的Blast-N和Blast-P对经过结构域搜索确定含有EF-hand结构域的蛋白进行核苷酸和氨基酸序列比对,以确保所收集得到的数据的准确性。在缺省值条件下使用Cl ustal W软件(版本号是1.83)对每个蛋白的EF-hand结构域进行多序列联配分析,以进一步了解微小隐孢子虫中EF-hand结构域间的相似性和研究EF-hand结构域中的Ca2+binding site等重要残基相关信息。
1.4 计算蛋白的分子量、等电点和氨基酸长度 将目的蛋白序列输入到 Ex PASy(http://www.expasy.ch/t ools/pi_tool.ht ml)进行蛋白的分子量和等电点计算,以比较EF-hand家族蛋白之间基本性质的区别。
1.5 蛋白功能分析 通过各蛋白所含有的结构域情况,对C.par vum Iowa II中的 EF-hand结构域蛋白进行大致分类。利用结构域画图软件DOG 2.0(Do main Graph,version 2.0,(Do main Graph,version 2.0,http://dog.biocuckoo.org/soft ware.php)画出上述蛋白所含有的结构域以及钙离子结合位点和其他相关重要位点情况,进行蛋白之间的比较与分析,最后结合NCBI的Blast比对结果和文献分析进行功能预测。
2 结 果
2.1 含EF-hand结构域蛋白的初筛 在微小隐孢子虫基因组数据库的数据收集过程中,在C.parvum Iowa II的全基因组中搜索获得数据库中注释的含有EF-hand结构域的53个蛋白,经过分析发现其中15个蛋白是假设蛋白,故将获得的除去假设蛋白的38个含EF-hand结构域的蛋白作为进一步分析的目标蛋白。
2.2 含EF-hand结构域蛋白的确定 将这38个蛋白的蛋白序列输入到NCBI的结构域搜索网站中进行CDD结构域搜索与分析时,发现这38个蛋白中只有18个蛋白真正含有EF-hand结构域,其余20个蛋白均未发现EF-hand结构域的存在。将此未发现EF-hand结构域的20个蛋白序列输入到sanger网站进行Pfam结构域搜索,结果仍未搜索到EF-hand结构域,推测在微小隐孢子虫基因组数据库中的全基因组进行注释时并未精确分类这些蛋白。因此对这18个真正含有EF-hand结构域的蛋白进行深入分析(表1)。
2.3 蛋白的基本性质分析 经过Ex PASy的分子量和等电点分析,这18个蛋白之间的氨基酸长度、分子量大小以及等电点等都有很大的区别,它们的氨基酸长度从149-1042 AA,分子量从16.8-115.6k D,pI值从4.09-8.96,呈现着明显的区别。EF-hand家族的染色体定位分析表明,该家族蛋白分布在C.par vu m Iowa II的1、2、3、5、7与8号染色体上,其中在3号染色体上1个,1号染色体上有2个,5号、7号和8号染色体上各有3个,分布最多的是2号染色体6个,4号和6号染色体上未发现此类蛋白的存在。而且,除cgd1-1370含有1个内含子之外,其余17个蛋白未见内含子的存在(表1)。
2.4 结构域和motif分析 通过CDD结构域搜索发现,在这18个蛋白中,有9个蛋白含有2个EF-hand结构域,分别为cgd2-810、cgd8-1280、cgd5-60、cgd1-1370、cgd8-4120、cgd2-1240、cgd5-820、cgd7-1840和cgd2-1300。而另外9个蛋白只含有1个 EF-hand结构域,分别是cgd2-1700、cgd8-500、cgd5-3920、cgd3-3420、cgd2-3990、cgd1-3220、cgd7-40、cgd2-1060和cgd7-1260。除 EF-hand结构域外,cgd5-820、cgd7-1260 和 cgd2-1300还含有PKC(protein kinase C)结构域,cgd2-1060和 cgd7-1840 还 含 有 STKc-AGC〔serine/t hreonine kinases(STKs),AGC (pr otein kinases A,G and C f amily,catal ytic do main〕结构域,且cgd7-1840还含有一个CBM20(The fa mil y 20 carbohydrate-binding module,also known as the starch-binding domain)结构域(图1)。
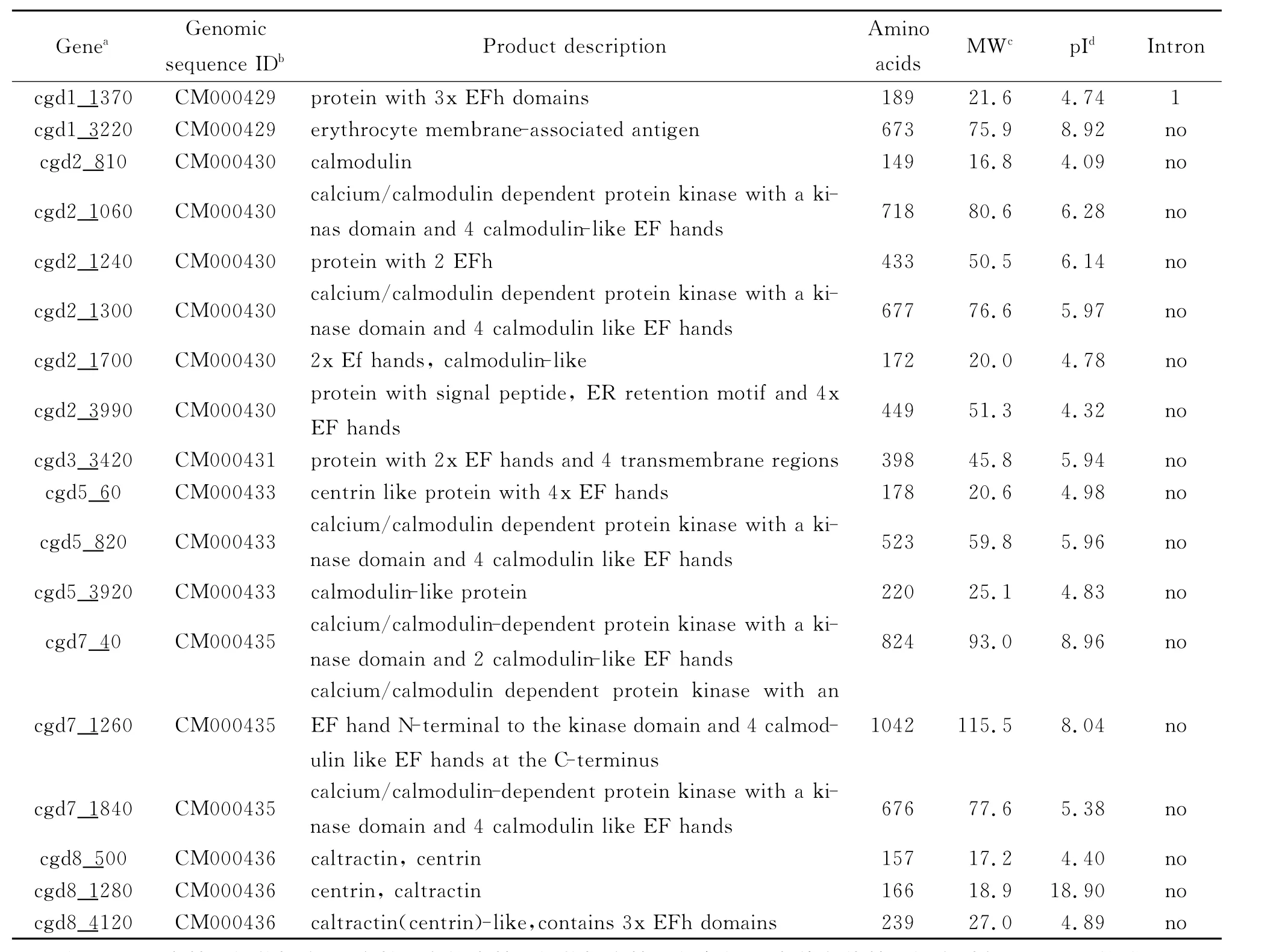
表1 微小隐孢子虫基因组中含有EF-hand结构域的18种蛋白的基本信息Tab.1 General infor mation about the 18 kinds of pr otein which containd EF-hand domains of the C.parvum Iowa II genome
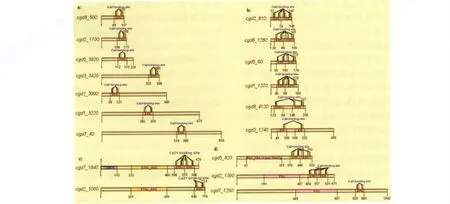
图1 微小隐孢子虫含有EF-hand结构域蛋白的结构域示意图Fig.1 The domain condition of the 18 proteins containing EF-hand domains from the C.parvum Iowa IINote:This result was obtained in March 2011 online.Due to the update of the website,there is a certain difference in the results bet ween before and after search.EFh:EF-hand domain;EH:Eps15 homology domain(EFh superfamily).
经motif搜索发现,18个蛋白都含有EF-hand-1 Motif,其一致模式为D-{W}-[DNS]-{ILVFY W }-[DENSTG ]-[DNQGHRK ]-{GP }-[LIV MC]-[DENQSTAGC]-x(2)-[DE]-[LIVMFY W](PROSITE entr y:PS00018;“{}”表示除了括号内的任何一个氨基酸都可以,“[]”表示括号内的任何一个氨基酸都可以,“x”表示所有氨基酸中的任何一个,“x(2)”表示此位点两个重复氨基酸,“-”为分隔符),包括了13个氨基酸残基,其中,位点1、3、5、7、9和12(图2)都是和Ca2+结合相关的重要位点,尤其是位点12上固定不变的带负电荷的Asp(D)或Glu(E)可以通过电荷之间的相互作用与带正电荷的Ca2+结合,并提供2个氧给Ca2+以促进Ca2+的 结 合 (http://pfam.sanger.ac.uk/family/PF00036.26)。通过 Clustal W 1.83软件进行的EF-hand结构域多序列联配分析发现,本文所分析的18个蛋白的EF-hand结构域均由一对EF-hand motif构成,都符合EF-hand-1 Motif的一致模式,其中位点1上几乎均为D(Asp)氨基酸,位点12上几乎都是E(Glu)和D(Asp)氨基酸(图2),这就揭示了EF-hand motif在氨基酸序列上的保守性,进一步说明这些位点是结构域的重要位点。
还发现,cgd2-3990的羧基末端还含有一个ER-TARGET motif (endoplas mic reticulu m-targeting signal sequence)RDE,称为内质网(ER)滞留信号的4肽信号序列,它的一致模式为[KRHQ-SA]-[DENQ]-E-L(PROSITE:PS00014),带 有 此滞留信号的蛋白被称为ER定居蛋白,在ER腔、高尔基体及其中间区分布有ER-TARGET motif的受体,ER定居蛋白一旦进入高尔基体就会被高尔基体上的受体结合,形成回流小泡被转运回内质网,从而将错误转运到分泌囊泡中的ER定居蛋白重新转运回ER腔[8]。此外cgd5-820、cgd7-1840、cgd2-1300、cgd2-1060、cgd7-40和cgd7-1260这6个蛋白都含有一个PROTEIN_KINASE_ST motif(PROSITE:PS00108)和一个PROTEIN_KINASE_ATP motif(PROSITE:PS00107)。PROTEIN_KINASE_ST motif是一个 Serine/Threonine protein kinases active-site signat ure,而 PROTEIN_KINASE_ATP motif是一个Pr otein kinases ATP-binding region signature,除 cgd7-40 之外,这些motif刚好是和它们所含有的PKc或STKc-AGC蛋白激酶催化结构域相一致的。因此,我们可以发现,motif和domain虽然是两个不同的概念,但是两者之间是密切相关的,正是因为motif这些保守性的残基组成了do main。

图2 微小隐孢子虫18个蛋白的EF-hand结构域多序列联配分析Fig.2 Multiple sequence align ment of the EF-hand domain from the 18 proteins of the C.parvum Iowa IINote:The domain sequence is named according to the complete genome database’s gene names;the 1 and 2 represent t his pr otein’s t wo EF-hand do mains.
2.5 蛋白分类情况 PKC结构域是蛋白激酶催化结构域(protein kinases catalytic domain),能够催化ATP上的γ-磷酰基团向蛋白底物的丝氨酸/苏氨酸/酪氨酸残基转移,使丝氨酸/苏氨酸/酪氨酸被磷酸化;而STKc-AGC结构域为丝氨酸/苏氨酸激酶 (serine/t hreonine kinases,STKs)-蛋白激酶 A、G、C 家族 (protein kinases A,G,and C family,AGC)催化结构域,是蛋白激酶超家族中A、G、C家族的丝氨酸/苏氨酸激酶催化结构域,只能催化ATP上的γ-磷酰基团向蛋白底物的丝氨酸/苏氨酸残基的转移,使丝氨酸/苏氨酸发生磷酸化(http://www.ncbi.nl m.nih.gov/Str ucture/cdd/cddsrv.cgi);而成对出现的EF-hand结构域会比单一EF-hand结构域更稳定,且在对Ca2+的结合上起着协同作用[9]。因此基于所含有的结构域情况可以简单地把这18个蛋白分成a、b、c和d四大类(见图1):a类为只含有1个EF-hand结构域的蛋白,b类为只含有2个EF-hand结构域的,c类为同时含EF-hand和STKc-AGC两种结构域的,d类为同时含EF-hand和PKC两种结构域的蛋白。
3 讨 论
自从微小隐孢子虫(C.par vu m)8条染色体的全基因测序工作[3-4]完成之后,隐孢子虫的研究已进入了后基因组时代,大量新基因的发现为科研工作者提供了更多的研究方向。其中许多的序列信息只进行了简单的注释,利用生物信息学相关知识来分析和预测蛋白的功能已成为很多课题研究的基础。本研究从与蛋白功能密切相关的结构域信息出发,通过研究隐孢子虫中EF-hand家族蛋白的结构域情况去预测这些蛋白的功能,为后续进行的微小隐孢子虫中钙离子代谢的研究提供了更多的方向。
Ca2+信号是真核细胞中最广泛存在的信号转导机制之一,细胞受到刺激后,储存的Ca2+就会被快速释放,引起下游一系列的效应,而这些效应一般由EF-hand蛋白超家族通过各种途径参与执行[10]。EF-hand蛋白是一类同源蛋白,一般含有2到12个拷贝的EF-hand结构域,按功能可以分为两类,一类为结合Ca2+后能发生构象改变起到调控作用的信号蛋白,包括钙调蛋白(cal modulin)、肌钙蛋白C(tr oponin C)和S100B蛋白等;另一类为如钙结合蛋白(calbindin)和小清蛋白(Parvalbu min)样只起到缓冲胞内Ca2+水平的结构蛋白,它们不会发生Ca2+依赖的构象改变[11]。对于本研究中的这18个蛋白,基于美国隐孢子虫基因组数据库的注释和同源性分析,cgd2-810、cgd2-1700、cgd5-3920 和cgd3-3420属于钙调蛋白家族,因此它们属于起到调控作用的信号蛋白;cgd8-500、cgd8-1280、cgd5-60和cgd8-4120属于中心体蛋白家族(centrin,在某些生物又叫做钙牵蛋白,caltractin),centrins在结合Ca2+之后发生的构象改变,很有可能为纺锤极体(spindle pole body)的复制提供信号,并提高了centrins对相互作用的目的蛋白的亲和力[12],因此这类蛋白应该都属于信号蛋白;而cgd5-820、cgd7-1840、cgd2-1300、cgd2-1060、cgd7-40和cgd7-1260都属于CDPK (calciu m/cal modulin-dependent protein kinase)蛋白,由于 EF-hand结构域和protein kinase结构域之间存在信息传递关系,也应都属于信号蛋白;cgd1-1370是磷酸酶B亚单位(calcineurin subunit B,Cn B),虽然在结合Ca2+之后并不经历Ca2+诱导的构象改变,但它是一个独立的Ca2+传感器,能够调控Ca2+依赖的和非Ca2+依赖的两种形式磷酸酶[13],所以是一个信号蛋白;cgd2-1240和cgd1-3220,目前尚无相关功能研究的资料支撑其分类;cgd2-3990是一个膜相关的Ca2+依赖的ER定居蛋白,与Pl asmodiu m f alcipar u m的Pfs40蛋白结构非常相似,而Pfs40是Pl asmodium f alcipar um 配子主要的Ca2+结合蛋白,Ca2+调控的结构改变很有可能是其细胞识别和聚合所必须的分子相互作用[14],所以cgd2-3990也是一个信号分子。因此,我们推测,此EF-hand家族除cgd2-1240和cgd1-3220尚未有相关资料来支撑分类之外,其余的16个蛋白都属于信号蛋白,但这只是基于生物信息学的初步分类,而进一步的确定还需要对各个蛋白进行如Ca2+放射自显影等相关的体外实验来说明。
Ca2+信号控制着顶复门寄生虫生活史中很多重要的过程,如粘附素的分泌、虫体的滑行运动、对宿主细胞的入侵和逃出等,而蛋白激酶是下游Ca2+水平变化的效应器,Ca2+向胞质的快速释放将会活化Ca2+依赖的蛋白激酶家族(CDPKs)[15]。在植物和一些原生动物中已发现,CDPKs能够接收Ca2+信号而在细胞中扮演着非常重要的角色,经典的CDPKs结构域含有一个能对靶蛋白进行磷酸化作用的激酶催化区(kinase catalytic region)和大量的C末端EF-hand结构域(通常为4个EF-hand motifs),它们中间是一个短的自动抑制结构域,正常情况下,这个自动抑制结构域充当假底物的身份,和蛋白激酶结构域结合在一起从而抑制蛋白激酶结构域的功能,当Ca2+结合到EF-hand结构域之后,这种自动抑制作用就会被解除,从而发挥Ca2+依赖的蛋白激酶家族蛋白各种功能[16-17]。本文中含有CDPKs结构域(PKc和STKc-AGC)的5个 EF-hand蛋白中,有3个蛋白在蛋白激酶催化结构域后面紧跟着2个 EF-hand结构域即4个 EF-hand motifs,且PKc和STKc-AGC结构域都具有活化位点(active site)、ATP结合位点(ATP binding site)以及底物结合位点(substrate binding site)。CDPKs作为一切生命活动的基础,控制着细胞内如转录、新陈代谢、离子泵与离子通道和细胞骨架的构建等一系列的过程[18],所以在C.par vu m Iowa II中应该是这类EF-hand家族蛋白起着最重要的作用,且它们这种强大功能的发挥是依赖于这些蛋白激酶催化结构域的。
大量的研究还证明,Ca2+调控着疟原虫不同的生物过程,如裂殖子对红细胞的入侵,动合子和子孢子的运动与细胞侵袭,分泌细胞器的脱落,以及在蚊体内的性分化过程[19-20]。Toxopl asma gondii 的体外试验也证明,寄生虫侵入宿主细胞前的细胞附着作用是与顶复门特有的微线体黏附蛋白(micr oneme proteins)密切相关的,而微线体黏附蛋白的分泌又受到胞质Ca2+水平的调控[15]。还有实验证明,C.par vu m子孢子侵入宿主细胞之前需要进行Ca2+依赖的顶复器的脱落是[20],因此C.parvu m对宿主细胞的侵袭与胞内的Ca2+信号有着非常重要的关系。在隐孢子虫基因组中EF-hand蛋白家族如此地庞大,暗示着钙离子信号在隐孢子虫的整个生命活动中起着非常重要的作用,EF-hand蛋白很有可能成为今后隐孢子虫病治疗的一个药物靶点。鉴于本文前面的讨论,cgd5-820、cgd7-1840、cgd2-1300、cgd2-1060、cgd7-1260、cgd1-1370和cgd2-3990这7个蛋白很有可能在隐孢子虫的生活史中起着关键的作用。尤其是cgd2-3990和cgd1-1370两个蛋白,cgd2-3990很有可能与隐孢子虫配子体的形成和作用有着密切的关系[14],而cgd1-1370作为Calcineurin的一个调节亚基,且已有研究证明Calcineurin B对免疫系统有明显的刺激作用,是T细胞的活化过程必不可少的,在老鼠身上也证明了Calcineurin B的显著抗癌效应,所以cgd1-1370很有可能成为隐孢子虫病治疗的药物靶点[13],这7个蛋白将会成为今后深入研究的方向。
[1]O'Donoghue PJ.Cr yptosporidiu m and Cr yptosporidiosis in man and animals[J].Int J Parasitol,1995,25(2):139-195.DOI:10.1016/0020-7519(94)E0059-V
[2]Diao ZL,Yin ZH,Chen XH.The research progress of Cr yptosporidiosis[J].Chin J Intern M,2008,47(6):521-522.(in Chinese)刁宗礼,阴祯宏,陈小华.隐孢子虫病研究进展[J].中华内科杂志,2008,47(6):521-522.
[3]Abrahamsen MS,Templeton TJ,Eno moto S,etal.Co mplete genome sequence of the apicomplexan,Cr yptosporidiu m parvu m[J]. Science, 2004, 304: 441-445. DOI: 10.1126/science.1094786
[4]Xu P,Wid mer G,Wang Y,etal.The genome of Cr yptosporidiu m ho minis[J].Nat ure,2004,431:1107-1112.DOI:10.1038/nat ure02977
[5]Taylor DA,Sack JS,Maune JF,etal.Structure of a recombinant cal modulin from Drosophil a mel anogaster refined at 2.2-Å resol ution[J].J Biol Chem,1991,266(32):21375-21380
[6]Persechini A,Moncrief ND,Kretsinger RH.The EF-hand family of calciu m-modulated pr oteins[J].Trends Neur osci,1989,12(11):462-467.DOI:10.1016/0166-2236(89)90097-0
[7]Francesco C,Federica C,Claudio L.EF-hand protein dynamics and evolution of calciu m signal transduction:an NMR view[J].Biol Inorg Chem,2006,11:949-962.DOI:10.1007/s00775-006-0163-0
[8]Griffit hs G,Ericsson M,Krijnse LJ,etal.Localization of the Lys,Asp,Glu,Leu tetrapeptide receptor to the Golgi co mplex and the inter mediate co mpart ment in ma mmalian cells[J].J Cell Biol,1994,127(6):1557-1574.DOI:10.1083/jcb.127.6.1557
[9]Lewit-Bentley A,Réty S.EF-hand calciu m-binding proteins[J].Curr Opin Struct Biol,2000,10:637-643.DOI:10.1002/9780470015902.a0003056.pub2
[10]Nagamune K,Moreno SN,Chini EN,etal.Calciu m regulation and signaling in apicomplexan parasites[J].Subcell Biochem,2008,47:70-81.
[11]Kawasaki H,Nakayama S,Kretsinger RH.Classification and evol ution of EF-hand proteins[J].Biometals,1998,11:277-295.DOI:10.1023/A:1009282307967.
[12]Schiebel E,Bor nens M.In search of a f unction for centrins[J].Trends Cell Biol,1995,5(5):197-201.DOI:10.1016/0962-8924(95)80011-5.
[13]Li J,Jia ZG,Zhou WC,etal.Calcineurin regulator y subunit B is a unique calciu m sensor that regulates calcineurin in bot h calciu m-dependent and calciu m-independent manner[J].Pr oteins,2009,77:612-623.DOI:10.1002/prot.22474.
[14]Rawlings DJ,Kaslo w DC.A novel 40-k Da membrane-associated EF-hand calciu m-binding protein in Pl asmodiu m f alcipar u m[J].J Biol Chem,1992,267(6):3976-3982.
[15]Bill ker O,Lourido S,Sibley LD.Calciu m-dependent signaling and kinases in apico mplexan parasites[J].Cell Host Micr obe,2009,5(6):612-622.DOI:10.1016/j.cho m.2009.05.017.
[16]Har per JF,Har mon A.Plants,sy mbiosis and parasites:a calciu m signalling connection[J].Nat Rev Mol Cell Biol,2005,6:555-566.DOI:10.1038/nr m1679.
[17]Moreno SN,Doca mpo R.Calciu m regulation in protozoan parasites[J].Curr Opin Micr obiol,2003,6:359-364.DOI:10.1016/S1369-5274(03)00091-2.
[18]Har mon AC,Gribskov M,Har per JF.CDPKs-a kinase for ever y Ca2+signal[J].Trends Plant Sci,2000,5:154-159.DOI:10.1016/S1360-1385(00)01577-6.
[19]Ishino T,Orito Y,Chinzei Y,etal.A calciu m-dependent protein kinase regulates Pl asmodiu m ookinete access to the midgut epithelial cell[J].Mol Micr obiol,2006,59:1175-1184.DOI:10.1111/j.1365-2958.2005.05014.x.
[20]Vaid A,Tho mas DC,Shar ma P.Role of Ca2+/cal modulin-Pf PKB signaling pat h way in er yt hr ocyte invasion by Pl asmodiu m f alcipar u m[J].Biol Chem,2008,283:5589-5597.DOI:10.1074/jbc.M708465200.

