中老年缺血性脑卒中患者康复治疗前后的弥散张量成像研究②
张晓钰,桑德春
脑卒中是一种致死率和致残率极高的疾病,缺血性脑卒中约占全部脑卒中的80%,而早期评价脑卒中的损伤程度和准确预测患者预后一直是医学界的难题。常规CT和MRI很难准确显示病灶与神经纤维束的空间位置关系以及白质束受损的范围,弥散张量成像(diffusion tensor imaging,DTI)技术的出现为缺血性脑卒中的早期诊断和病情评估、治疗时机的判断以及预后的评估提供了技术支持[1],是惟一可在活体显示脑白质纤维束的无创性成像技术,其主要方法为DTI纤维追踪成像,可直观地显示脑内病变对白质纤维形态结构直接或间接的影响。目前国内外对脑卒中DTI的研究资料尚缺乏康复治疗方面的评价,且未能很好地控制年龄对其的影响[2-3]。本研究探讨DTI对脑梗死患者康复治疗预后评价的应用价值。
1 对象与方法
1.1 对象 2010年6月~2011年6月本院收治中老年住院患者24例,发病24~72 h内经常规MRI或CT明确诊断为单侧脑梗死。缺血性脑卒中的定义符合WHO的诊断标准。按年龄分为3组:①A组(n=8):其中男性3例,女性5例;年龄45~59岁,平均(51.53±4.62)岁;②B组(n=8):其中男性5例,女性3例;年龄60~74岁,平均(66.71±4.08)岁;③C组(n=8):其中男性6例,女性2例;年龄75~82岁,平均(78.44±4.26)岁。
纳入标准:①脑梗死发病3 d以内,临床资料完整;②单侧发病;③梗死灶位于基底节、内囊或放射冠等,仅累及白质而无灰质受累;④初次发病;⑤生命体征平稳;⑥无MRI检查禁忌征,完成检查并图像质量良好;⑦知情同意。
排除标准:①双侧脑梗死或椎基底动脉系统脑梗死;②无法配合或完成该检查;③有明显意识障碍、严重认知功能障碍或颅脑外伤史;④拒绝签署知情同意书或中途退出者。
1.2 方法
1.2.1 神经功能评分 患者于入院时和发病后6周分别进行神经功能评分。采用美国国立卫生院脑卒中量表(National Institutes of Health Stroke Scale,NIHSS)评价各期临床症状。评分范围为0~42分,分数越高表示神经受损越严重。
1.2.2 常规MRI检查 包括:T1WI、T2WI序列,T1WI使用FSE序列(TR/TE=2066/10.4 ms),T2WI使用TSE序列(TR/TE=4400/87.5 ms),常规横断面、矢状位、冠状位扫描。扫描层厚5.0 mm,20层,层间距1.5 mm。
1.2.3 DTI序列检查 使用弥散敏感单次激发回波平面成像序列进行轴位扫描。扫描参数:TR/TE=8000/70.4 ms,视野(FOV)230×230 mm,在相位编码方向上重复取样率为100%,矩阵256×256,层厚3.6 mm,无间隔。采用AC-PC定位线总计获取33层图像,覆盖整个大脑半球和脑干;使用2个弥散权重,b值分别为0和800 mm2/s,在12个各向同性方向上分别施加弥散敏感梯度,信号5次平均,采集时间259 s。
1.2.4 数据处理 利用工作站LEONARDO提供的分析软件包计算出部分各向异性(fractional anisotropy,FA)图,由研究者手动在FA图各个层面上画出梗死灶感兴趣区(region of interest,ROI)及其对侧相应大小正常脑组织ROI得到相应FA值,每个区域测量3次,取平均值,再将各个层面的值平均后得到梗死灶及对侧相应正常脑组织处的FA值。
弥散张量成像纤维束成像(diffusion tensor tractography,DTT):根据大脑白质纤维束解剖,利用“种子点”标记梗死灶周围纤维束始点,计算机自动追踪,终止条件:FA值<0.2,角度<35°,重建双侧皮质脊髓束(corticospinal tract,CST)。在DTT图中根据CST与梗死灶的空间位置关系,主要表现为完整、受压移位和中断3种方式[4]。将CST受累情况分为2级,1级:皮质脊髓束完整;2级:皮质脊髓束中断。
1.3 统计学分析 采用SPSS 16.0统计软件进行分析。梗死侧与健侧CST的FA值的差异采用配对t检验;分析各组患者及治疗前后梗死灶侧CST的FA值,采用单因素方差分析;各组患者CST分级与脑梗死患者NIHSS评分的关系采用单个样本的t检验,检验水准a(双侧)=0.05。
2 结果
2.1 梗死灶和对侧相应正常脑组织FA值比较 各组患者梗死灶侧的FA值均较对侧相应正常脑组织FA值低,康复治疗6周后梗死侧的FA值均比入院时明显增加(P<0.05)。各组患者FA值随年龄的增加呈逐渐下降趋势(P<0.05)。见表1。
2.2 DTT结果 DTT显示梗死灶纤维束直径变细,纤维数量减少,甚至有中断。随着年龄的增加,其CST破坏的程度逐渐加重,经康复治疗后均有好转。其中A组CST 1级2例,2级6例;B组CST 1级4例,2级4例;C组CST 1级3例,2级5例。
2.3 CST分级与NIHSS评分的联系 各年龄组患者CST 2级的NISHH评分均高于CST 1级(P<0.05)。在同组同一CST级别的患者,其发病后6周NIHSS评分低于入院时NIHSS评分(P<0.05)。见表2。

表1 各组患者脑梗死侧与对侧相应正常脑组织(健侧)CST的FA值比较
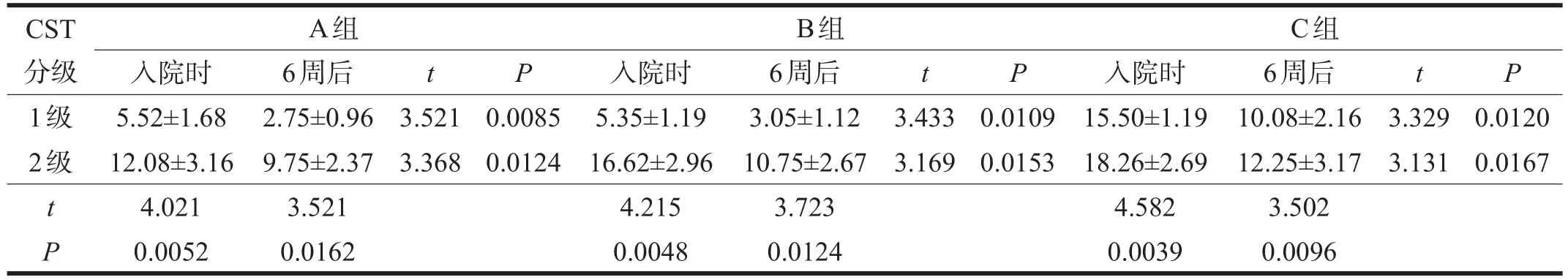
表2 各组患者CST级别在治疗前后NISHH评分的比较
3 讨论
缺血性脑卒中约占全部脑卒中的80%,而脑梗死是严重危害人类健康的常见病之一。脑梗死后约3/4以上的患者会残留不同程度的肢体运动或其他功能障碍。早期评价脑梗死的损伤程度和准确预测患者预后一直是医学界的难题。
DTI是近年来运用于临床的一种功能性磁共振成像方法,是当前惟一的一种能有效观察和追踪脑白质纤维束的非侵入性检查方法,能较好显示出白质纤维如皮质脊髓束、钩束、上下纵束、下额枕束的结构变化。应用DTI对脑卒中患者进行评价,已逐渐成为临床上一种重要的参考依据[5],甚至可以发现短暂性脑缺血发作和微小脑卒中之间的差异,从而更有利于准确地评估患者的长期预后[6]。
目前应用弥散张量成像技术对脑卒中/梗死患者预后判断的研究资料甚少[7]。本研究显示各年龄组患者梗死灶侧的FA值均较对侧相应部位正常脑组织FA值低,与以往文献报道一致[8]。说明在梗死早期,DTI参数就会发生改变,这些现象和变化对临床医生及时判断脑梗死和梗死时期具有重要意义。在脑梗死早期,FA值升高提示存在细胞水肿,随后开始降低则预示比较严重的,甚至不可逆性缺血损伤的发生[9]。说明FA值可以早期显示神经纤维的变性,从一定程度上反映CST的受损情况[10]。研究表明[11],FA值的大小与髓鞘的完整性、纤维致密性及平行性有密切关系,能够反映白质纤维是否完整,FA值越大,神经传导能力越强。
本研究还发现,梗死侧FA值随年龄的增加呈下降趋势,在康复治疗6周后显著增加。可能是由于发病后经综合康复治疗后,患者的神经运动功能逐渐恢复所致。而年龄越大的患者,其神经运动功能恢复较慢,因此FA值的下降比较明显。
Thomalla等对发病2~16 d内的亚急性期轻、中度缺血性组中患者行DTI检查,发现梗死灶侧大脑脚的FA值下降,且梗死灶侧大脑脚FA与对侧FA的比值(rFA)与NIHSS评分之间存在负相关[12]。其结果表明FA值越低则变性程度越重,神经运动功能恢复越差。许祖梅等的研究发现,梗死区FA值降低幅度超过0.2,临床预后较差;而7个脑梗死区域FA值较对侧正常区域FA值无明显变化的患者先前的症状完全或近乎完全恢复,预后良好[13]。结合本实验研究,提示我们对临床DTI检查中发现FA值降低明显、尤其是年龄较大的脑卒中患者,更应当引起足够的重视,尽早给予综合康复治疗。
有研究结果表明,DTT可显示纤维束的迂曲、受压、变形,也可显示梗死区与纤维束的关系,如接近、部分穿行、完全穿行[14]。与既往研究结果一致,本研究DTT结果显示,梗死灶侧皮质脊髓纤维束直径变细,纤维数量减少,甚至有中断。DTT可较清晰准确地显示CST的状态,而CST的完整与否在脑卒中患者神经运动功能恢复过程中起着决定性作用。随着年龄的增加,其CST破坏程度加重,患者的神经功能恢复较慢或较差。
本研究结果还表明皮质脊髓束的损伤程度与NIHSS密切相关,提示患者的临床预后不仅与梗死灶组织的受损程度有关,更重要的是与梗死发生的部位有关。国内任钰等对18例脑血管疾病(脑梗死16例,脑出血2例)患者发病初及发病后2周、1个月和2个月分别进行了神经功能缺损评分,其研究结果表明16例脑梗死患者不同时期NIHSS评分与CST级别明显相关,尤其是发病后2个月时患者的NIHSS评分转归情况与皮质脊髓束级别有显著性差异[7]。而本研究结果则显示6周后有显著性差异,可能是因为本研究对患者的年龄段及血管危险因素等作了相对严格的区分,本研究在常规治疗的基础上采用了综合康复治疗手段。
DTT能够清晰地显示缺血区和受损白质纤维之间的关系,更能立体直观地观察CST的状况,将对脑梗死患者临床神经功能康复治疗及判断预后提供更多重要的信息。
[1]张霞,邢悦,张芸,等.弥散张量成像技术在缺血性脑卒中的应用[J].四川大学学报(医学版),2009,40(3):551-554.
[2]Bhagat YA,Beaulieu C.Diffusion anisotropy in subcortical white matter and cortical gray matter:changes with aging and the role of CSF-suppression[J].Magn Reson Imaging,2004,20(2):216-227.
[3]Pfefferbaum A,Adalsteinsson E,Sullivan EV.Frontal circuitry degradation marks healthy adult aging:Evidence from diffusion tensor imaging[J].Neuroimage,2005,26(3):891-899.
[4]肖惠,陈自谦,张碧云,等.三维纤维束示踪成像评价急性脑梗死患者皮质脊髓束损伤的意义[J].中国临床康复,2006,10:70-73.
[5]Sotak CH.The role of diffusion tensor imaging in the evaluation of ischemic brain injury-a review[J].NMR Biomed,2002,15(7-8):561-569.
[6]Tong T,Yao ZW,Feng XY.Transient ischemic attack and stroke can be differentiated by analyzing the diffusion tensor imaging[J].Korean J Radiol,2011,12(3):280-288.
[7]任钰,陈嘉峰,饶明俐.核素共振弥散张量成像对脑血管患者预后的判断[J].中风与神经疾病杂志,2008,25(5):570-573.
[8]Xu SW,Chen ZQ,Chen JH,et al.Correlation between muscular strength and basal nuclei ischemic/hemorrhagic stroke-induced corticospinal tract injury,as detected by diffusion tensor imaging and tractography[J].Neural Regen Res,2010,5(13):1010-1014.
[9]倪建明,黄钢,沈天真,等.急性缺血性脑梗死弥散各向异性的变化规律[J].中国医学影像技术,2009,25(6):985-988.
[10]Klose U,Mader I,Unrath A,et al.Directional correlation in white matter tracks of the human brain[J].J Magn Reson Imaging,2004,20:25-30.
[11]Thomalla G,Glauche V,Koch MA,et al.Diffusion tensor imaging detects early wallerian degeneration of the pyramidal tractafterischemic stroke [J].Neuroimage,2004,22:1767-1774.
[12]许祖梅,郭庆清,陈国章,等.磁共振张量成像对脑梗死预后的评价[J].中国实用神经疾病杂志,2008,11(12):4-6.
[13]李敏,于向荣,贾中正,等.白质纤维束成像评价皮质脊髓束损伤与脑梗死预后的关系[J].临床放射学杂志,2009,28(6):755-758.
[14]鲍莎莎,刘青蕊,张金峰,等.磁共振弥散张量及纤维束成像在急性脑梗死的临床应用[J].脑与神经疾病杂志,2009,17(3):204-206.

