MnS细微粉体的制备与工艺研究
陈玲玲
(渭南师范学院,陕西渭南714000)
0 引言
半导体纳米晶是一种人工设计制造的(通过能带工程实施)新型半导体材料,它具有与体材料截然不同的性质.作为重要的宽带隙无机半导体化合物材料,硫化物纳米晶因其优异的非线性光学性质、发光性质、量子尺寸效应及其他重要的物理化学特性迅速成为短波半导体光电材料研究的国际热点.过渡金属硫属化合物半导体纳米材料中最具代表性的是CdS、CdSe、CdTe、ZnS、SnSe、CuS和MnS等.这些纳米材料已经被应用在光电转换和光催化、光发射二极管、太阳能电池和生物荧光探针等领域[1].MnS是ⅦB-ⅥA族的弱磁性半导体材料,带隙宽度为3.7eV,在制备太阳能电池的窗口/缓冲材料有着潜在的应用.MnS有三种晶型结构:岩盐结构(α-MnS)、闪锌矿结构(β-MnS)和纤锌矿结构(γ-MnS).亚稳态的β和γ-MnS在100℃ ~400℃易转变为稳态的α-MnS,且这种转变是不可逆的[2].亚稳态的MnS与稳态的MnS相比较,展现出了更为特殊的化学性能、电学性能、光学性能及磁学性能[3].近些年来MnS纳米晶制备已成为研究热点,常见的MnS的制备方法是采用水热、溶剂热法[4]在控制一定的条件下获得目标产物.还有许多方法如化学沉积法、射频辐照法、分子束外延法(MBE)和微波照射法,但这些方法都比较复杂.本文研究了微波水热法制备MnS时工艺因素的影响,以确定其最佳制备工艺,并采用XRD、SEM等分析手段研究了粉体的显微结构和性能.主要研究内容和成果如下:研究了微波水热温度、保温时间、反应物浓度、反应物pH对MnS粉体结晶情况及显微结构的影响,确定了最佳工艺参数.
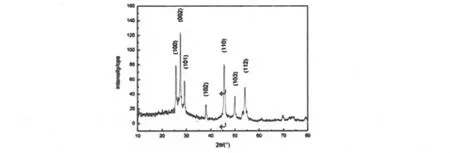
图1 MnS样品的XRD图谱
1 实验过程
取MnCl2·4H2O和硫代乙酰胺按1∶2比例加蒸馏水50mL配成溶液,放入容积为100mL的水热高压釜中,微波水热一定时间后自然冷却至室温.所得沉淀依次用蒸馏水和无水乙醇洗涤以除去杂质,在50℃真空干燥箱中干燥,最后收集红褐色产物用于样品的表征.
2 结果与讨论
2.1 MnS粉体的物相分析和形貌分析
图1为所得MnS粉体样品的XRD图谱.从该图谱可以得出合成的MnS粉体为六方相结构.图中各衍射峰与六方相的MnS纤锌矿结构(JCPDS 06-0464)的特征峰对应,且没有发现任何杂质.
2.2 样品的微观形貌
由图2可见,样品的形貌多呈现直径10μm左右的铅笔状结构,这些铅笔状颗粒在空间中以各个方向分散.从局部放大图可以看出,合成产物为六方晶系.

图2 样品的微观形貌
2.3 水热工艺因素对MnS粉体晶相及微观形貌的影响
2.3.1 水热反应温度的影响
为了进一步研究反应温度对反应产物的影响,本实验分别选取了130℃、140℃、150℃、160℃和170℃五个不同反应温度,在保温时间为90min的条件下进行反应,所得产物的XRD图谱如图3所示.
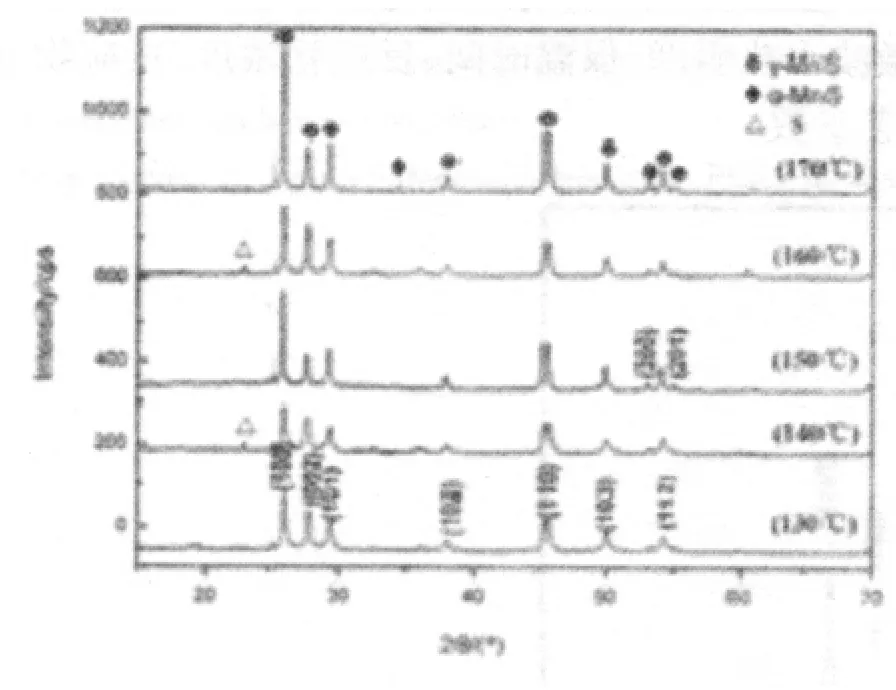
图3 不同温度下制备MnS的XRD图谱

图4 不同微波水热处理时间下产物的XRD图谱
图中可以看出,在130℃时已经生成纯相的γ-MnS,但结晶度较低,随着温度的升高,衍射峰强度升高,γ-MnS结晶性变好,150℃时,γ-MnS的结晶度达到最高.随着温度继续升高,晶体沿(100)和(110)晶面取向生长,到达160℃时,有微量的α-MnS生成,所以温度升高会出现晶型的转变,即γ-MnS开始向α-MnS转变.所以制备γ-MnS的最佳温度为150℃.
2.3.2 水热反应时间的影响
为研究产物的形成过程,选取了不同的反应时间进行实验.图4为不同微波水热处理时间下产物的XRD图谱.由图可见,在保温30min和60min时,反应不完全,产物中仍存在有含硫有机物(JCPDS 71-0560SN-sulfur nitride).反应时间为90min时,产物晶化良好.延长保温时间至120min时出现硫锰矿MnS.因此本实验选取的反应时间为90min.
2.3.3 反应物浓度的影响
从图5的XRD图像可以看出,随着浓度的增大,生成γ-MnS开始出现晶面的取向生长,(100)晶面的生长速率明显快于其他晶面.另外,随着浓度的增大,α-MnS的结晶性变好,这说明有一部分γ-MnS正在向α-MnS转变.
图 6 中 a、b、c、d 分别为0.1mol/L、0.3mol/L、0.5mol/L、0.7mol/L 浓度下所得产物的 SEM 图.从图 6中可看出,随着浓度的增大,产物的粒径呈现先增大后减小的趋势.在浓度为0.1mol/L的SEM图中,呈现铅笔状的六方晶系γ-MnS长度约为5μm.当浓度增大到0.3mol/L时,γ-MnS长度增大,平均约为10μm.当浓度继续增加至0.5mol/L时,粉体粒度减小,同时由于粒度的减小粉体出现了团聚现象,但此时仍能明显看出晶体为六棱柱状,属六方晶系.当浓度增加至0.7mol/L时,颗粒团聚现象明显,从图像中能分辨出某些晶体呈立方体,属四方晶系,故推知晶体的晶型也从γ-MnS转变为α-MnS.
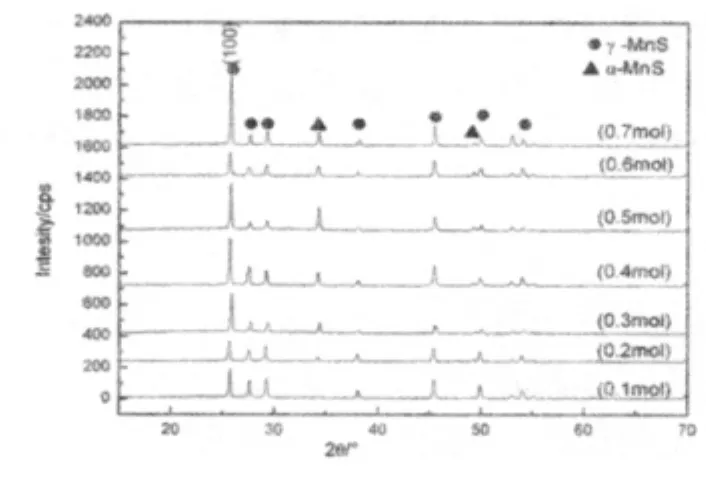
图5 为不同浓度下产物的XRD图谱

图6 为不同浓度下产物的SEM图
2.3.4 pH 值的影响
从图7的XRD图中可看出,在酸性条件下随着pH值增大,γ-MnS晶体结晶性变好;在碱性条件下,随着pH值增大,衍射峰宽化,说明pH值的升高,晶粒细化.图8为不同pH值下制备的MnS粉体的SEM图,其中图8(d)为pH=8.8的局部放大图(放大倍率为8000),其他四幅图的放大倍率为3000.从图中可以看出酸性条件下合成的γ-MnS晶粒尺寸较大,约为5μm,pH=3.8时,产物的结晶度很差,形貌无规则,如图8(a).pH=5.8时,如图8(b)中所示,γ-MnS的形貌为六方柱状和铅笔棒状结构.随着pH值的升高γ-MnS晶粒尺寸减小,这与XRD的分析结果一致.当pH=8.8时,如图8(c)所示,晶粒尺寸约为0.5μm.从局部放大图8(d)来看,产物是由形貌均一的六方柱状团聚而成.继续增大pH值,当pH=10.8时,如图8(e),晶体尺寸继续减小,团聚成直径约为1μm的球体.
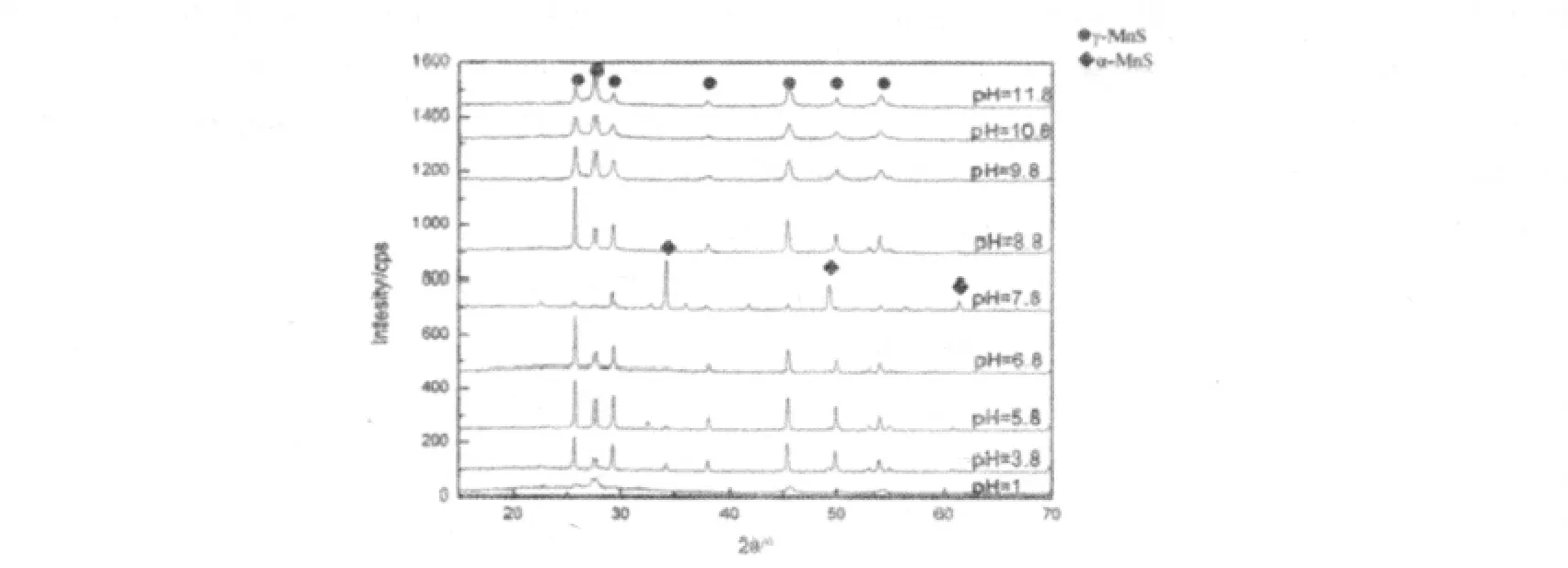
图7 不同pH下制备的MnS的粉体的XRD图

图8 不同pH下制备MnS粉体的SEM图
3 结语
本文以MnCl2·4H2O和C2H5NS为原料,采用微波水热法制备MnS细微粉体,并探讨了温度、时间、pH和反应物浓度等不同工艺因素对产物的影响.主要结论如下:所制备的产物是由棒状颗粒组成的,小粒径的六方柱状结构颗粒会发生团聚从而形成球状颗粒.通过改变不同的温度,得出在150℃时产物的结晶性最好;随着反应时间的延长,产物粒径变小,且会发生从γ-MnS向α-MnS的晶型转变;同时发现合成MnS比较适宜的pH为8.8.反应物浓度越大,产物的晶粒尺寸越小,且有向α-MnS晶型转变的趋势.
[1]朝霞,刘淑萍.金属硫属化合物纳米材料制备方法的研究进展[J].化学工程师,2006,(9):50-53.
[2]Hu Y,Zheng Z,Jia H M,et al.Selective synthesis of FeSand FeS2nanosheet films on iron substrates as novel photocathodes for tandem dyesensitized solar cells[J].J.Phys.Chem.C,2008,112:13037 -13042.
[3]ZHANGYong-cai,WANGHao,WANGBo,et al.Hydrothermal synthesis of metastable γ-manganese sulfide crystallites[J].Optical Materials,2003,23:214 -217.
[4]王巍,吕伟丽,古国华.纳米MnS空心球的制备与表征[J].稀有金属材料与工程,2007,15(2):74-76.

