瓜蒌薤白颗粒中多糖的含量测定
鄢海燕,邹纯才
(皖南医学院 1.药剂学与生药学教研室;2.药物分析与药物化学教研室,安徽 芜湖 241002)
瓜蒌薤白颗粒是采用瓜蒌、薤白两味药经提取有效成分制成的冲剂。瓜蒌开胸涤痰,可扩张冠状动脉,提高抗缺氧能力,还可抑制血小板聚集;薤白通阳宣痹,有舒张冠状动脉作用[1]。多糖是瓜蒌和薤白中的活性成分之一[2-3],其含量在一定程度上反映了瓜蒌薤白颗粒的质量,为此采用硫酸-苯酚显色法[4-7]建立瓜蒌薤白颗粒中多糖的含量测定方法。
1 材料与方法
1.1 材料
1.1.1 仪器 紫外-可见分光光度计(UV-2550,日本岛津公司),台式高速冷冻离心机(3K30,德国sigma公司),电子分析天平(AUW120D,日本岛津公司)。
1.1.2 试药葡萄糖对照品(天津一方科技有限公司,含量 >99%),瓜蒌薤白颗粒(自制,批号:20111001,20111002,20111003,20111004,20111 005),6%苯酚溶液,其他所用试剂均为分析纯。
1.2 方法
1.2.1 溶液的制备
1.2.1.1 对照品溶液的制备精密称取经五氧化二磷干燥48 h的葡萄糖对照品10 mg,置100 ml量瓶中,加水溶解并稀释至刻度,摇匀,即得0.1 mg/ml对照品溶液。
1.2.1.2 供试品溶液的制备取瓜蒌薤白颗粒1.5 g,精密称定,乙醚超声2次,每次5 min,滤过,残渣加适量水溶解,离心,取上清液于250 ml容量瓶中,加水至刻度。精密量取4 ml,用Sevag法 (三氯甲烷∶正丁醇=4∶1)脱蛋白,样品液与三氯甲烷-正丁醇的体积比为4∶1,分取上清液,精密量取1.0 ml,加 95% 乙醇 3 ml,冷藏,5 000 r/min 离心 30 min,倾去上清液,沉淀依次加乙醚、无水乙醇洗涤3次,挥干,沉淀加水溶解,定容至100 ml,即得。
1.2.2 检测波长的确定 分别吸取一定量的葡萄糖对照品溶液和已处理好的供试品溶液,显色后在305~600 nm波长范围内扫描。结果表明,葡萄糖对照品和供试品的最大吸收峰位一致,均位于490 nm波长处,故本试验选用490 nm作为检测波长。吸收光谱见图1。
1.2.3 标准曲线的制备 精密量取葡萄糖对照品溶液 2、4、6、8、10 ml,分别置 10 ml容量瓶中,加水至刻度。精密吸取1 ml,加6%苯酚水溶液1.0 ml,浓硫酸6 ml,静止10 min,旋涡混合5 min,室温放置20 min,照分光光度法,于波长490 nm处测定吸收度,以蒸馏水按同样显色操作为空白,以测得的吸收度与其对应的浓度计算回归方程为:A=7.16C-0.0124,r=0.9998。结果表明:葡萄糖溶液 0.02 ~0.1 mg/ml

图1 瓜蒌薤白颗粒中多糖与葡萄糖显色后的紫外-可见光谱图1.葡萄糖对照品;2.瓜蒌薤白颗粒中多糖Fig 1 UV-VIS of polysaccharides in Gualou-Xiebai granulesand glucose after color development1. Reference substance of glucose; 2. Polysaccharides in Gualou-Xiebai granules
1.2.4 换算因子的测定 精密称取60℃干燥至恒重的瓜蒌薤白颗粒多糖29.1mg,置100ml容量瓶中,用水稀释至刻度,摇匀。精密吸取2ml置10ml容量瓶中,加水稀释至刻度,取1ml,按测定标准曲线同样的方法测得吸收度A为0.255,从回归方程中求出多糖稀释液中葡萄糖浓度为0.0378mg/ml,按下式计算换算因子f,测得f=1.54。
f=w/(C×D)
式中w为多糖的质量(mg);C为多糖稀释液中葡萄糖浓度(mg/ml);D为多糖的稀释倍数。多糖含量测定:按下试计算多糖含量:
多糖含量(%)=CDf/w×100%式中:C为样品溶液的中葡萄糖含量(mg),D为样品溶液的稀释倍数,f为换算因子,w为样品的重量(mg)。
1.2.5 测定法 精密吸取供试品2.0ml,照标准曲线制备项下自“加6%苯酚水溶液1.0ml起”依法操作,由回归方程计算样品溶液中葡萄糖含量,按多糖含量计算公式计算多糖含量。
1.2.6 精密度试验 精密吸取葡萄糖对照品溶液6ml,置10ml容量瓶中,加水至刻度。精密吸取1ml,加 6% 苯酚水溶液 1.0ml,浓硫酸 6ml,静止10min,旋涡混合5min,室温放置20min,照分光光度法,于波长490nm处测定吸收度。平行5份,以1ml蒸馏水按同样显色操作为空白,计算其RSD为1.21%,表明仪器的精密度良好。
1.2.7 稳定性试验 取样品(批号:20111001)新制得的供试品溶液 2.0ml,照“1.2.5”项下方法,在0、2、4、8、16、24h 时测定吸光度。计算其 RSD 为1.93%,表明供试品溶液在24h内稳定。
1.2.8 重复性试验 取同一批号的样品(批号:20111001)5 份,每份各2.5g,精密称定,按“1.2.1.2”项下方法制备溶液,照“1.2.5”项下方法测定其吸收度。计算RSD为1.90%,表明重复性良好。
1.2.9 回收率试验 精密吸取1ml已知含量的供试品溶液 6 份,每 2 份分别精密加入 0.2、0.4、0.6 ml的葡萄糖对照品溶液(0.1mg/ml),照“1.2.5”项下方法测定其吸收度,并计算含量,结果见表1。
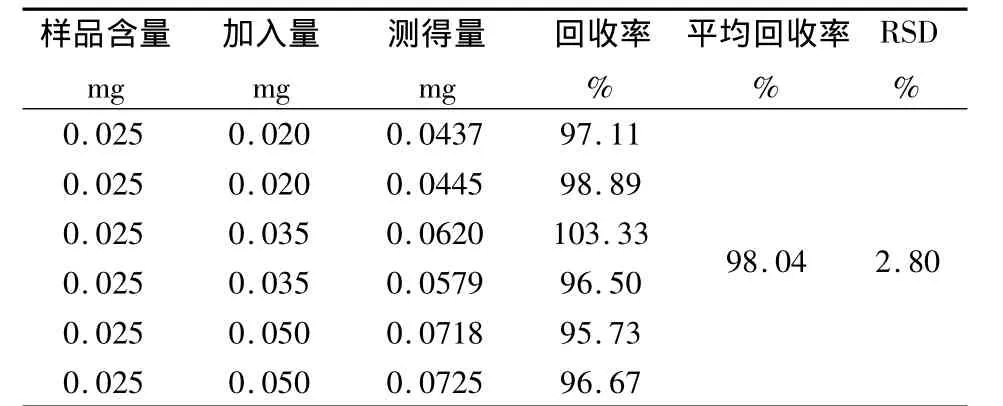
表1 加样回收率测定结果Tab1 Resultsoftheaveragerecovery
2 结果
取5批样品,按“1.2.1.2”项下方法制备供试品溶液,照“1.2.5”项下方法测定吸收度,并计算其多糖含量,结果见表2。

表2 含量测定结果Tab2 Resultsofthecontentdetermination
3 讨论
3.1 在多糖的精制过程中采用了Sevag法脱蛋白,再用乙醚、无水乙醇洗涤以除去脂溶性成分。由于有效去除了多种杂质的干扰,使结果更加准确、可靠。葡萄糖对照品和瓜蒌薤白颗粒中多糖的IR图,如图2。
3.2 影响比色法的因素较多,因此在操作过程中要保证一致性,如混合速度、显色温度和显色时间等,以保证实验数据的准确、可靠。
3.3 本实验曾尝试使用硫酸-蒽酮法[8]对瓜蒌薤白颗粒中的多糖进行含量测定,结果也较为理想,但蒽酮试剂不够稳定,在较多样品的测定或稳定性考察的过程中,需要临用前配制,应用较为不便。为此,本实验最终采用硫酸-苯酚法。在用硫酸-苯酚法进行瓜蒌薤白颗粒中多糖的含量测定中,为避免苯酚的氧化,需对其进行蒸馏纯化处理,否则测定结果将会收到影响,在使用的过程中应避光保存。
3.4 本方法所需设备简单、试剂易得,在测定的过程中,避免了单糖、低聚糖及其他还原性物质对多糖含量测定的干扰。加样平均回收率为98.04%,RSD=2.80%,方法较为可靠,可用于瓜蒌薤白颗粒中多糖的含量测定。
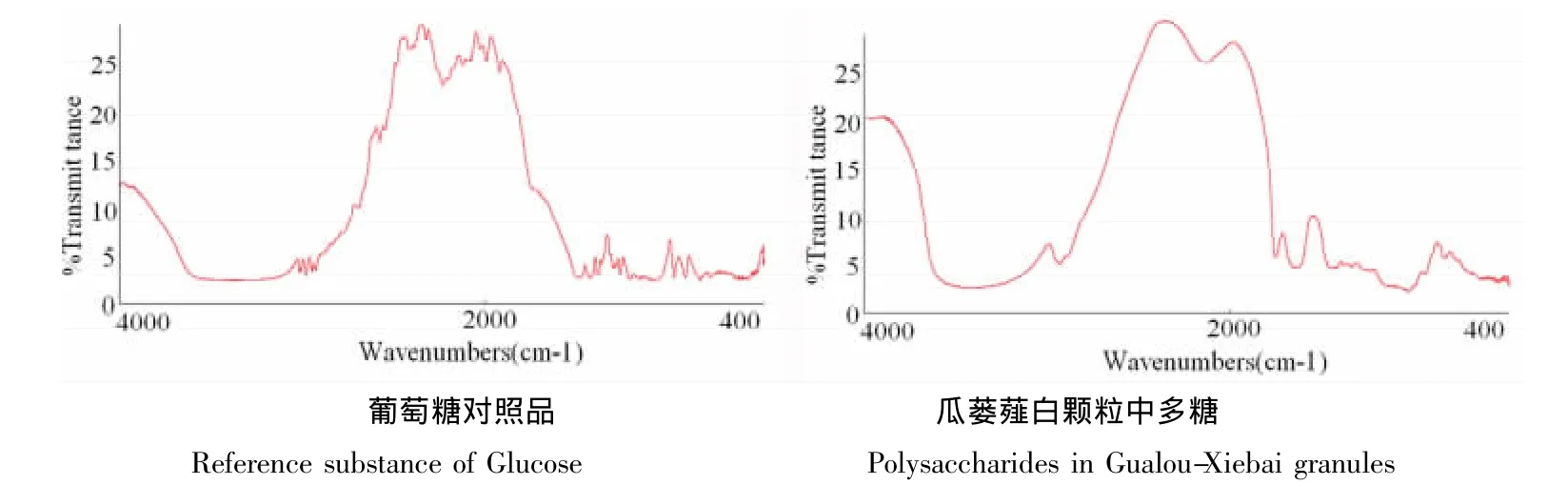
图2 FT-IR光谱图Fig 2 FT-IR spectrum
[1] 孙志强,郑冀,代龙.瓜蒌薤白药理作用研究进展[J].江西中医药,2010,41(11):76 -78.
[2] 夏新奎,杨海霞,李纯,等.薤白多糖的分离纯化及组成分析[J].食品工业科技,2010(1):244 -247.
[3] 夏新奎,张建新.薤白多糖抗氧化活性研究[J].信阳农业高等专科学校学报,2007,17(4):138 -139.
[4] 屠婕红,黄佳.瓜蒌皮中水溶性多糖的提取及含量测定[J].时珍国医国药,2009,20(2):281 -282.
[5] 于昕雯,张文杰,王岩,等.天仙子多糖含量测定[J].辽宁中医药大学学报,2011,13(10):246 -248.
[6] 徐丽媛,李志猛,杨蕾,等.菟丝子多糖含量测定方法的研究[J].北京中医药大学学报,2011,34(8):548 -551.
[7] 庄筱葳,刘秀芳,毛贵元,等.西藏红雪茶多糖含量测定[J].中国实验方剂学杂志,2012,18(4):103 -106.
[8] 吕方军,叶国华,许一平,等.北沙参茎叶多糖的含量测定[J].中药新药与临床药理,2012,23(1):84-86.

