皖南地区汉族ICP患者ERα基因多态性的研究
舒 静,何淑凤,李玉红,庞晓楠,李铁臣
(皖南医学院 分子生物学研究室,安徽 芜湖 241002)
妊娠期肝内胆汁淤积症(intrahepatic cholestasis of pregnancy,ICP)是一种妊娠中晚期常见的并发症,其产妇主要表现为皮肤瘙痒,血清中转氨酶和胆汁酸水平异常增高,主要危及胎儿,可引起胎儿窘迫、窒息致中枢神经系统缺氧损伤从而引发胎儿宫内死亡及流产[1-2]。目前ICP的发病机理尚不清楚,流行病学研究提示机体内雌激素水平过高可能是ICP的重要诱因,主要证据有:ICP在临床上主要发生于妊娠中晚期,此时正值胎盘合成雌激素的高峰期;使用含雌激素的避孕药物妇女中发生胆汁淤积时的临床表现与ICP的症状十分相似等等[3-4]。雌激素通过与雌激素受体(estrogen receptor,ER)相结合,调节一系列基因的表达。有研究表明ERα基因PvuⅡ多态性在雌激素生理学效应发生中起了重要作用[5],因此可能与ICP的发生有关。本研究采用PCR-RFLP和DNA测序方法检测ICP患者和正常孕妇中PvuⅡ多态位点的分布情况,探讨ERα基因多态性在ICP发生中的作用。
1 材料和方法
1.1 标本来源和制备 136例标本均来自2009年10月~2012年1月皖南医学院附属弋矶山医院妇产科,其中ICP组43例,年龄22~43岁,平均(26.6±3.6)岁;孕周 30~41周,平均孕(37±2.6)周。正常孕妇组93例,年龄20~40岁,平均(27.8±4.3)岁;孕周 31 ~41 周,平均孕(38.5 ±1.9)周。ICP诊断标准按照《妇产科学》第7版中的标准执行,两组均为居住安徽皖南地区汉族孕妇,均无口服避孕药和接受激素治疗史,也无全身性、遗传性和免疫性疾病(如乙肝,糖尿病等)及其他妊娠期并发症(如妊娠期高血压等)。两组孕妇均抽取2 ml外周血,冻存于-80℃冰柜中,在1~4周内,参考胡卫华等[6]方法制成DNA标本,4℃保存备用。
1.2 聚合酶链式反应(PCR) 引物依照参考文献[7]设计,由上海生物工程有限公司合成,上游序列为 5'-TCCAGGGTTATGTGGCAATGACG-3',下游引物序列为5'-ACTACCTGCACCAGAATATGTTACCT-3',扩增片段大小为278 bp,覆盖ERα基因PvuⅡ多态位点。PCR总反应体积50μl:模板DNA为2μl,Taq酶(Tiangen公司)2.5 U,10×buffer(含 Mg2+)5 μl,dNTPs 0.2 mmol/L,上游及下游引物各 10 pmol/L,加灭菌双蒸水至总体积50μl。PCR反应在Mycycler型热循环仪(Bio-Rad公司)上进行,98℃ 5 min蛋白变性后,加入Taq酶,进入热循环,反应条件为:94℃变性30 s,62℃复性45 s,72℃延伸1 min,共33个循环,最后72℃完全延伸4 min。PCR产物4℃保存备用。取10μl PCR扩增产物加样,1.5%琼脂糖凝胶电泳60 min(电压100 V),溴化乙啶(ethidium bromide,EB)染色,FR-980型凝胶成像仪(上海复日科技有限公司)下检测扩增产物,并摄片保存。
1.3 限制酶酶切 限制性内切酶PvuⅡ为Fermentas公司产品(#ER0631),反应总体积32μl,包括PCR 产物10 μl,10×buffer 2 μl(10×buffer G),限制酶PvuⅡ2μl,加灭菌双蒸水至总体积 32μl。37℃水浴2 h,10 μl酶切产物加样,1.5%琼脂糖凝胶电泳(电压100 V),EB染色,凝胶成像仪下观察结果并摄片保存。
1.4 DNA序列测定 PCR产物50μl连同上下游引物由北京诺赛生物科技有限公司进行PCR产物的纯化和单向测序(双脱氧法),必要时进行双向测序,观察PvuⅡ多态位点的分布情况。
1.5 数据分析 在SPSS软件包中应用拟合优度χ2检验判断两组PvuⅡ多态性基因型分布是否符合Hardy-Weinberg遗传平衡定律,是否具有群体代表性,采用χ2检验比较两组基因型频率以及等位基因频率的分布。
2 结果
2.1 ERα基因PCR产物的鉴定及PvuⅡ酶切和测序结果 所有标本均扩增出278 bp的目标片段,见图1。PvuⅡ酶切产生三种基因型:PP(CC)型(突变型),产物为278 bp一条带;Pp(TC)型(杂合型),产物为278 bp、179 bp和99 bp三条带;pp(TT)型(野生型),产物为179 bp和99 bp两条带,其对应的测序结果中PvuⅡ多态位点序列为CAGCCG、CAGCT/CG(T/C 杂合)和 CAGCTG,见图2、3。
2.2 Hardy-Weinberg遗传平衡检验 根据Hardy-Weinberg平衡定律用χ2检验分别计算ICP组和对照组3种基因型的期望值、观察值的差异。结果两组的基因型分布均符合Hardy-Weinberg平衡(ICP组:χ2=5.283,P=0.071;对照组:χ2=2.090,P=0.352),群体代表性好。
图1 ERα基因PCR产物1.5%琼脂糖凝胶电泳结果

图2 ERα基因PCR产物PvuⅡ酶切结果

图3 PvuⅡ酶切位点测序结果
2.3 ICP组和对照组ERα基因PvuⅡ多态性分析PP型、Pp型、pp型在ICP组和正常孕妇对照组中的分布见表1,经χ2检验,两组间差异无统计学意义(χ2=4.762,P=0.092),P、p 的基因频率在两组间差异也无统计学意义(χ2=2.385,P=0.122)。
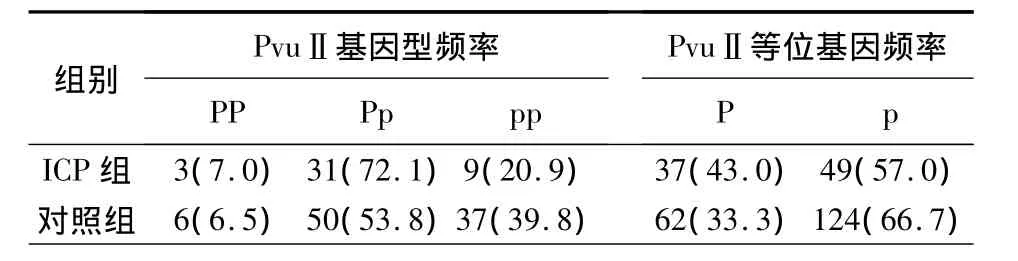
表1 ERα基因PvuⅡ多态性基因型和等位基因在ICP组和对照组中的分布Tab 1 Genotype and allele distribution of ERα gene PvuⅡ polymorphisms in ICP group and control group[n(%)]
3 讨论
ICP是妊娠期危害围生儿健康的并发症,其发病机制尚不明确,目前认为,其发生与雌激素、遗传、环境等因素有关[2]。研究已证明雌激素在ICP发生中起了关键作用,并成功应用雌激素诱出大鼠ICP模型[3,8]。雌激素通过靶细胞膜上ER介导产生生物学效应,因此与ER基因的转录和表达密切相关。ER有ERα和ERβ两种亚型,研究中发现ERα基因敲除的雌鼠体内雌激素等性激素水平降低,不能受孕;而ERβ基因敲除的雌鼠体内雌激素等性激素含量正常或者几乎正常,能受孕[5]。这提示ERα在雌激素生理学活性发挥中起了主导作用,是ER发挥生物学功能的最主要亚型。
ERα基因位于6q25.1,DNA片段大小为140 kb左右,由8个外显子和7个内含子组成[9],在第1内含子中有1个单核苷酸多态(single nueleotide polymorphism,SNP)位点,可通过限制酶PvuⅡ酶切来检测。研究已证明内含子1中有与基因转录调控密切相关的启动子,增强子等调节序列,因此在其中发生的点突变将严重影响该基因的转录活性,蛋白质的表达以及与雌激素结合活力,最终影响雌激素生物学功能的发挥[10]。目前研究已证实雌激素在ICP的发生中起了重要作用[3],因此ERα基因的多态可能影响ICP的发生。
ERα基因的多态性与ICP的关系,目前国内外虽有这方面的少量报道,但无进行大样本的研究,ICP病例选取均不超过100例。本研究表明ERα基因PvuⅡ多态在ICP组和正常孕妇对照组中的分布差异无显著性(P >0.05),与芬兰 Eloranta等[11](ICP组 57 例),张力等[8](ICP 组100 例),梁正仪等[12](ICP组54例)报道相一致,但不能就此说明PvuⅡ多态与ICP无关,因为上述报道包括本实验都只进行了小样本的研究,要想得出更可信的结果还需扩大样本含量进一步研究。此外ERα基因上有多个多态位点,本实验仅进行了一个常见位点的研究,而且ICP的发生存在明显的地区和种族差异[3],因此在不同地区和种族进行ERα基因多位点分析对于明确其多态性在ICP发生中的作用是必要的,ERα基因的多态性与ICP的关系还有待于进一步探讨。
本实验先采用PvuⅡ酶切方法进行研究,发现有些标本酶切效果不理想,目标带总是消化不干净存在残留,影响结果的判断。后又使用DNA测序方法进行实验,有些测序图中存在杂峰和底峰同样影响实验结果的准确判断,最后采用先酶切,再与DNA测序结果相比对的方法,提高了实验结果的可靠性。
综上所述,ERα基因的多态性与ICP发生之间的关系尚不明确,需采用扩大研究标本量以及采用限制酶酶切与DNA序列测定相结合的方法作进一步的研究,以明确两者间的关系。
[1] OUDE ELFERINK RP,KREMER AE,MARTENS JJ,et al.The molecular mechanism of cholestatic pruritus[J].Dig Dis,2011,29(1):66-71.
[2] YAYI H,DANQING W,SHUYUN L,et al.Immunologic Abnormality of Intrahepatic Cholestasis of Pregnancy[J].Am J Reprod Immunol,2010,63(4):267 -273.
[3] PAN C,PERUMALSWAMI PV.Pregnancy-related liver diseases[J].Clin Liver Dis,2011,15(1):199 -208.
[4] JOSHI D,JAMESA,QUAGLIA A,et al.Liver disease in pregnancy[J].Lancet,2010,375(9714):594 - 605.
[5] 张嫣,陈伟忠,王伟民,等.雌激素受体α基因多态性对女性原发性胆汁淤积性肝硬化患者T细胞亚群及其相关细胞因子变化影响的研究[J].中华临床医师杂志,2010,4(7):954-961.
[6] 胡卫华,李铁臣,孙慧兰.冻存血与新鲜血的DNA抽提效果的比较研究[J].皖南医学院学报,2005,24(2):96 -98.
[7] 孙清,孔丽娜,宋蓉蓉,等.雌激素受体α基因多态性与子宫内膜异位症的相关性研究[J].中国病理生理杂志,2010,26(9):1828-1832.
[8] 张力,刘淑芸,时青云,等.雌激素受体α基因多态性与妊娠肝内胆汁淤积症相关性研究[J].中华妇产科杂志,2006,41(5):307-310.
[9] PONGLIKITMONGKOL M,GREEN S,CHAMBON P.Genomic organization of the human oestrogen receptor gene[J].EMBO J,1988,7(11):3385 -3388.
[10] 张力,刘淑芸.雌激素受体基因多态性与妇产科疾病关系研究进展[J].国外医学妇产科学分册,2006,33(3):194 -197.
[11] ELORANTA ML,HEISKANEN JT,HILTUNEN MJ,et al.Multidrug resistance 3 gene mutation 17-12del T and estrogen receptor alpha gene polymerphisms in Finnish women with obstetric cholestasis[J].EurJ Obstet Gynecol Reprod Biol,2002,105(2):132-135.
[12] 梁正仪,刘淮.雌激素受体基因多态性与妊娠期肝内胆汁淤积症关系的研究[J].中华围产医学杂志,2007,10(6):365-369.

