荷叶离褶伞菌丝体多糖的提取及还原力的研究*
张春梅,宋 海,魏生龙
(1.河西学院食用菌研究所,甘肃 张掖 734000;2.河西学院化学化工学院,甘肃 张掖 734000;3.河西学院农业与生物技术学院,甘肃 张掖 734000)
荷叶离褶伞 Lyophyllum decastes,隶属于担子菌纲、伞菌目、口蘑属、离褶伞属食用真菌[1],味道鲜美,属野生优良食用菌[2]。李林玉等探讨了荷叶离褶伞生长所需的营养条件[3],魏生龙等报道了荷叶离褶伞分离驯化[4]和生物学特性研究[5],该菌种保藏于“中国微生物菌种保藏管理委员会普通微生物中心”(保藏号 CGMCC 1518,菌株号ZY48-1),该菌种于2008年获得了国家发明专利授权[6]。关于食用真菌多糖提取工艺的研究很多,传统工艺有热水浸提法、稀酸浸提法、稀碱浸提法等,新工艺包括酶法、超声波辅助法、微波辅助浸提法、超滤法等[7],其中热水浸提法为食用菌多糖最经典的提取方法,以其工艺简单、成本低、易于推广等特点为人们所接受。此前对荷叶离褶伞菌丝体多糖提取工艺方面的研究报道极少,而其水溶性多糖抗氧化性能的研究未见报道。本文对荷叶离褶伞多糖提取工艺进行研究,得到一种优化方案,并以还原力为依据,研究了荷叶离褶伞多糖的抗氧化活性,为其进一步的开发利用以及天然保健品的研发提供科学依据。
1 材料与方法
1.1 材料
1.1.1 供试菌种
荷叶离褶伞由河西学院食用菌研究所提供,菌种保藏号 CGMCC NO.1518,菌种编号 ZY48-1,专利申请号200510096405.0,公开号CN1923997A。
1.1.2 液体菌种培养基配方
将玉米面加水调制成悬液,加入0.1%淀粉酶,于70℃水浴锅中酶解5 h;大豆先用水浸泡24 h,用豆浆机打浆,加入0.1%蛋白酶,于55℃水浴锅中酶解5 h。然后用300目筛过滤,滤液中加入白糖,加水定容。
1.1.3 液体菌种培养
将供试试管菌种置于22℃恒温箱内活化24 h,接入250 mL三角瓶(100 mL)中,置于 22℃、转速 120 r·min-1的恒温摇床上,连续培养7 d。将该菌种接入20 L液体菌种培养罐中,接种量10%,恒温22℃、通气量20 L·h-1,连续培养7 d获得液体菌种。
1.1.4 发酵罐发酵
将液体菌种按10%的接种量接入200 L发酵罐中,给予搅拌转速 160 r·min-1、罐压 0.2 MPa、通气量 80 L·h-1、pH 6.5、温度20℃的培养条件,连续培养8 d。
1.2 仪器与设备
DFT-50流水式中药粉碎机,青州三阳包装设备有限公司;UV-9100分光光度计,北京瑞利分析仪器公司;SHZ-D(Ⅲ)循环水式真空泵、KQ-B玻璃仪器气流烘干器,巩义市予华仪器有限公司;RE-85C旋转蒸发仪,上海青浦沪西仪器厂;HK-2A超级恒温水浴锅,江苏金坛市中大仪器厂;DHG-9070(A)电热干燥箱,上海三发科学仪器有限公司;TGL-16G高速冷冻离心机,上海安亭科学仪器厂;AR1530电子精密天平,奥豪斯国际贸易(上海)有限公司;苯酚、浓硫酸、正丁醇、氯仿、95%乙醇、无水乙醇、三氯乙酸、抗坏血酸、铁氰化钾、三氯化铁均为分析纯。
1.3 试验方法
1.3.1 粗多糖浸提过程中的单因素试验
选择原料的粉碎度(目数),浸提过程中的料水比、温度、时间,醇沉时的乙醇添加倍数、提取次数为因素,研究各因素下浸提液中的粗多糖得率。
1.3.2 粗多糖浸提过程中最佳工艺条件的确定
在单因子实验的基础上,设计了正交试验以优化荷叶离褶伞多糖提取工艺。选择提取时间、料水比、提取温度、乙醇浓度四个对多糖提取影响较大的因素,按L9(34)设计四因素、三水平的正交试验,以优化浸提过程的工艺条件。每个处理3个重复,取各提取率的平均值。
1.3.3 粗多糖浸提最佳工艺条件验证试验
在正交试验确定的最佳工艺条件下进行试验,以验证粗多糖浸提过程中工艺条件的可靠性。
1.4 多糖的提取工艺及含量测定
1.4.1 标准曲线的绘制
精确称取于105℃条件下干燥至质量恒定的葡聚糖50.0 mg,于50 mL量瓶中,加适量水溶解后定容,摇匀备用。分别精密移取该溶液0、0.4 mL、0.6 mL、0.8 mL、1.0 mL、1.2 mL、1.4 mL、1.6 mL、1.8 mL于 10 mL容量瓶中,加水定容,摇匀后各取2.0 mL于25 mL具塞刻度试管中(每个处理3个重复),另取2.0 mL蒸馏水作空白对照。分别加入质量分数为5.0%的苯酚溶液1.0 mL,混匀,迅速加入5.0 mL浓硫酸,立即摇匀。放置10 min,置于沸水浴中保温15 min,取出后迅速冷却至室温,在波长490 nm处测定吸光度A。以葡萄糖质量浓度C为横坐标、A为纵坐标,绘制标准曲线。计算得归回方程为Y=0.160293A-0.0125,r=0.9992,Y为葡萄糖的含量(mg),A为吸光度,r为相关系数。
1.4.2 荷叶离褶伞菌丝体多糖提取工艺流程
发酵罐培养8 d后,用300目筛过滤,经真空冷冻(-70℃、12 h) 干燥→粉碎→浸提→4 000 r·min-1离心10 min取上清液→Sevag法除蛋白→离心取下层澄清液→旋转蒸发仪浓缩→加乙醇沉淀4℃冰箱中过夜→离心(4 000 r·min-1)10 min取沉淀→沉淀用乙醇洗涤2次→定容显色→测吸光度→粗多糖得率。
1.4.3 多糖含量测定
采用苯酚-硫酸显色法[8]测定多糖含量,以葡萄糖溶液为标准。多糖提取率(P)公式如下:

式中:C为荷叶离褶伞多糖质量浓度(mg·mL-1);V为荷叶离褶伞多糖提取液的体积(mL);m为荷叶离褶伞菌丝体粉末质量(mg)。
1.5 还原力测定
参考 Oyaizu[9]的方法。分别吸取浓度为 200 μg·mL-1、400 μg·mL-1、600 μg·mL-1、800 μg·mL-1、1 000 μg·mL-1的荷叶离褶伞菌丝体多糖溶液和抗坏血酸(Vc)溶液各1.0 mL置具塞试管中,分别加入2.5 mL磷酸盐缓冲溶液(0.2 mol·L-1,pH6.6) 和质量分数1%铁氰化钾溶液5 mL,置于50℃水浴中反应20 min,然后加入体积分数10%的三氯乙酸5 mL,摇匀,于5 000 r·min-1离心10 min,吸取上清液2.5 mL加入2.5 mL蒸馏水和0.5 mL0.1%的三氯化铁溶液,混合均匀,室温下反应10 min后在波长700 nm处测定光密度值(以蒸馏水代替样品的混合液作参比溶液),光密度值越大表明还原力越强。
1.6 数据处理与统计分析
采用DPS软件进行数据处理并进行Duncan新复极差多重比较分析,数据用平均值±标准误表示(X±SE),p<0.05为有显著性差异。
2 结果与分析
2.1 单因素试验
2.1.1 粉碎度对粗多糖得率的影响
粉碎的目的在于增加原料与萃取剂之间的接触面积,理论上粉碎度越大越好,但提取过程中包括扩散、渗透、溶解过程,实践证明粉碎度并非越大越好。粉碎度对荷叶离褶伞菌丝体多糖得率的影响见表1。

表1 粉碎度对荷叶离褶伞菌丝体多糖得率的影响
从表1可以看出,随着粉碎度的增大,粗多糖得率提高,当原料粉碎度为100目时,粗多糖得率达到(2.75±0.1368)%,粗多糖得率最高;粉碎度进一步增大,粗多糖得率降低。因此,确定粉碎度为100目。
2.1.2 料液比对粗多糖得率的影响
称取100目原料按不同料液比在90℃浸提3 h,添加3倍乙醇,4℃冰箱过夜。一般来说,液料比越大提取效果越好。但是,从细胞中提取多糖的过程除了简单的扩散过程之外,还有受细胞膜影响的阻滞扩散过程,而阻滞扩散速度取决于细胞膜结构。当溶剂用量增加到一定时再增加也不会提高溶剂中多糖含量。料液比对荷叶离褶伞菌丝体多糖得率的影响见表2。

表2 料液比对荷叶离褶伞菌丝体多糖得率的影响
从表2可以看出,料液比达到1∶80时,粗多糖得率最高,考虑到液料比太高会加重后续的浓缩以及纯化工的能耗。因此,确定料液比为1∶80。
2.1.3 浸提温度对粗多糖得率的影响
称取100目原料按料水比1∶80在不同温度下浸提3h,添加3倍乙醇,4℃冰箱过夜醇沉。浸提温度对粗多糖得率的影响见表3。
从表3可以看出,随着浸提温度的升高,粗多糖得率显著提高,但超过一定温度后,高温长时间的浸提会破坏多糖的结构,同时考虑到高温会使杂质溶出量增加,为后续处理带来不便,并影响其生物活性。因此,温度不宜过高,确定浸提温度为90℃。
2.1.4 浸提时间对粗多糖得率的影响

表3 浸提温度对粗多糖得率的影响
称取100目原料按料水比1∶80在90℃下浸提不同时间,添加3倍乙醇,过夜醇沉。浸提时间对粗多糖得率的影响见表4。
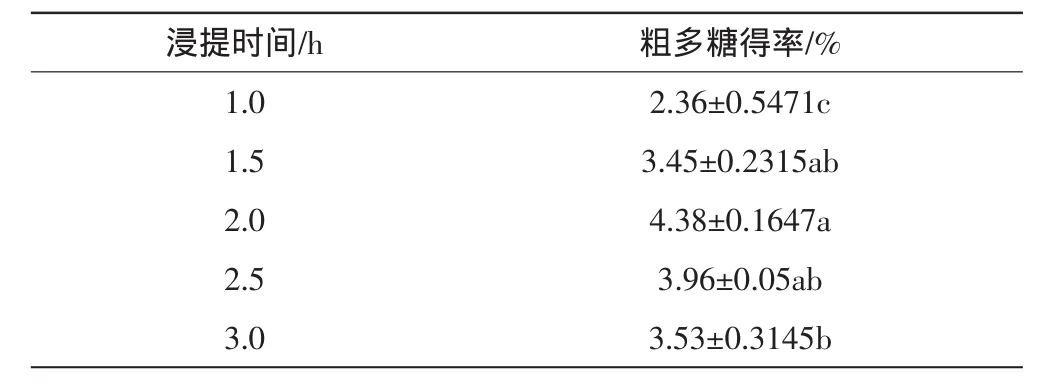
表4 浸提时间对粗多糖得率的影响
从表4可以看出,随着浸提时间的延长,粗多糖得率显著提高;2.5 h后,粗多糖得率有下降趋势,可能是时间过长导致多糖遭受破坏。因此,确定浸提时间为2 h。
2.1.5 乙醇沉淀倍数对粗多糖得率的影响
乙醇沉淀多糖主要取决于多糖的浓度和多糖的类别,化学组成和分子量。选择不同乙醇沉淀倍数进行实验,结果见表5。

表5 乙醇沉淀倍数对粗多糖得率的影响
从表5可以看出,随着乙醇沉淀倍数的增加,多糖的含量也在增加,随着乙醇添加倍数的继续增大,粗多糖得率仍有提高,但与乙醇添加倍数3相比,差异并不显著。考虑到能耗问题,确定3倍乙醇沉淀多糖。
2.1.6 乙醇体积分数对粗多糖提取率的影响
醇沉浓度是影响多糖提取的最主要因素。一般情况下,多糖的分子量越大,被沉淀下来所需的乙醇浓度越小;乙醇浓度越大,沉淀下来的分子量越小,多糖得率越高。乙醇体积分数对粗多糖得率的影响见表6。
从表6可得知,多糖提取率随着乙醇体积分数的增加先增加后下降,在乙醇体积分数为95%时多糖提取率达到最大值(4.55±0.0356)%。乙醇体积分数超过95%后,多糖提取率变化不明显,且增加提取成本。因此,确定乙醇体积分数为95%。
2.2 荷叶离褶伞菌丝体粗多糖提取工艺的优化
选择料液比、浸提温度、浸提时间、乙醇体积分数4个对多糖提取影响较大的因素,按L9(34)设计四因素、三水平的正交试验,见表7、表8。

表6 乙醇体积分数对粗多糖得率的影响
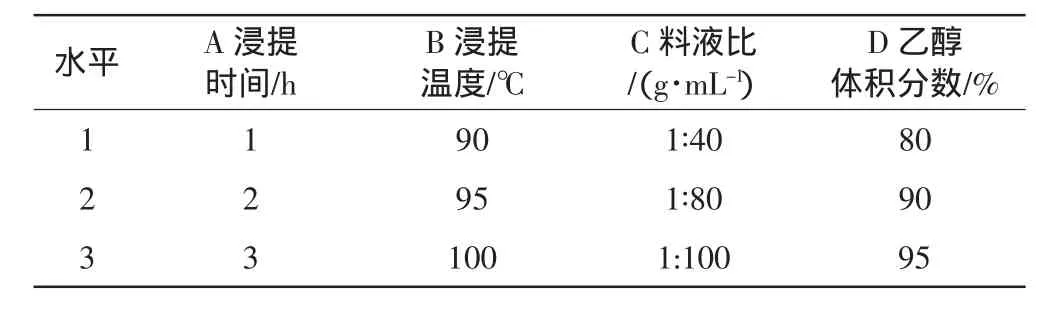
表7 正交实验因素和水平表

表8 荷叶离褶伞菌丝体多糖提取正交实验方案
由极差分析得出影响效果为B>A>C>D,进一步根据各水平的均值比较,确定热水提取荷叶离褶伞菌丝体多糖的最佳工艺参数为A2B1C2D3,即浸提温度90℃、浸提时间2 h、料液比1∶80、乙醇体积分是95%。
2.3 粗多糖浸提最佳工艺条件的验证试验
在最佳工艺条件下进行提取多糖的验证实验,称取原料按目数100,料水比1∶80,90℃浸提2 h,重复2次,得率分别为4.12%、4.34%,则平均得率为4.23%,高于正交试验的各组,说明试验中得出的工艺条件是可靠的。
2.4 多糖还原力测定结果
抗氧化剂能够通过自身的还原作用给出电子使自由基变成稳定的分子,从而失去活性;还原力越大,抗氧化能力就越强。因此可根据Fe3+还原为Fe2+的多少来间接评价各种提取物的抗氧化能力。在试验浓度范围,还原力测试液的吸光值随着浓度的增加而增大(图1),低浓度时吸光值较低,当浓度增至1 000 μg·mL-1时,测试混合液的吸光值为0.435,说明荷叶离褶伞菌丝体多糖具有一定的还原力,但与抗坏血酸Vc相比,还原力较弱。

图1 荷叶离褶伞菌丝体多糖的还原能力
3 讨论与结论
多糖不仅是机体主要供能物质,同时还具有多种多样的生物学功能,在生命活动中参与了细胞的各种活动。在我国的中药现代化进程中,研究天然多糖无论是在药学方面还是在药理学方面都已取得了明显的进步[10,11]。许多研究表明,高等真菌子实体和菌丝体多糖具有显著的抗肿瘤、抗氧化、降血糖等活性[12-15]。以往的真菌多糖多从子实体中提取得到,由于生产周期长、劳动强度大、受气候影响严重,产量及质量不稳定,且子实体木质化程度高,多糖提取效率较低。本研究采用热水提取、乙醇沉淀、Sevage法除蛋白提取了荷叶离褶伞菌丝体多糖,工艺操作简单,较适用于工业生产。在单因素试验基础上通过正交试验,确定了影响荷叶离褶伞菌丝体多糖提取率因素的主次关系是:浸提温度>浸提时间>料液比>乙醇体积分数。荷叶离褶伞菌丝体多糖提取最优工艺条件是粉碎度100目、料水比1∶80(g·mL-1)、浸提温度90℃、浸提时间2 h、添加3倍95%乙醇醇沉。苯酚-硫酸法测定此最佳提取工艺条件下粗多糖得率可达4.23%。
生物体中不断产生的羟自由基(·OH)和超氧阴离子自由基(O2-·),具有很强的氧化能力,当它们的存在超出机体防御系统所具有的清除能力时,这些自由基及其诱导的氧化反应就会直接或间接地降低酶活性,促使多糖降解、DNA链断裂,从而引起体内代谢紊乱,导致各种疾病发生[16]。多糖结构中的醇羟基可以与产生·OH等自由基所必需的金属离子络合,使羟自由基的产生受到抑制,最终抑制活性氧的产生[17]。本试验是通过体外实验对荷叶离褶伞粗多糖的抗氧化功效进行测定。结果表明,荷叶离褶伞多糖具有一定的体外抗氧化能力,且在供试浓度范围内,随着浓度的增加而增强,但与抗坏血酸Vc相比,还原力较弱。而在生物体内多糖的抗氧化作用途径更为复杂。作为外源性抗氧化剂,多糖作用的机理除直接参与猝灭自由基的途径外,还可能通过参与调动或激活机体的内源性抗氧化剂,从而避免或减轻自由基对机体的损伤。多糖在实验体系中表现出较强的抗氧化活性,这可能是多糖抗衰老、抗炎症、降血脂、抗肿瘤等功效的药理基础[18]。目前,国内外已将抗氧化检测用于抗衰老等保健食品的评价,对保健食品开发具有积极作用[19]。因此,可开发具有抗氧化、抗衰老作用的荷叶离褶伞多糖功能性保健食品,有关荷叶离褶伞多糖体内抗氧化作用及与其多糖的种类、结构及在生物体内的生物学活性差异有待进一步研究。
[1]黄年来.中国大型真菌原色图鉴[M].北京:中国农业出版社,1998.
[2]卯晓岚.中国经济真菌[M].北京:科学出版社,1998.
[3]李林玉,李荣春.荷叶离褶伞菌丝营养条件的初步研究[J].中国食用菌,2004,24(3):30-32.
[4]魏生龙,王治江,于海萍,等.荷叶离褶伞分离驯化研究[J].西北农业学报,2005,14(5):128-131.
[5]魏生龙,王治江,于海萍,等.荷叶离褶伞生物学特性研究[J].菌物学报,2005,25(1):101-108.
[6]魏生龙.荷叶离褶伞食用菌菌种:中国,ZL200510096405.0[P].2008-07-02.
[7]陈欣,龚兰,刘冠卉.食用真菌多糖提取条件的优化及其还原力的比较[J].食品科学,2010,31(14):140-144.
[8]张维杰.糖复合物生化研究技术(2版)[M].杭州:浙江大学出版社,2006.
[9]Oyaizu M.Antioxidative activity of browning products of glucosaminefractionated by organic solvent and thin layer chromatography[J].Nippon Shokuhin Kogyo Gakkaishi,1986(35):771-775.
[10]王红英.中药多糖研究进展[J].实用医技杂志,2006,13(6):10-21.
[11]邓小云,丁登峰,戴美红,等.植物多糖药理作用研究进展[J].中医药导报,2006,12(9):45-53.
[12]Chung CS,Lu MK,Cheng JJ,et al.An tiangiogenic activities of polysaccharides isolated from medicina fungi[J].Fems Microbiol Lett,2005(249):247-254.
[13]Li SP,Zh ang GH,Zeng Q,et al.Hypoglycemic activity of polysaccharide with antioxidation isolated from cultured Cordyceps mycelia[J].Phytomedicine,2006(13):428-433.
[14]Zhang M,Cui SW,Cheung PCK,et al.Antitum or polysaccharides from mushrooms:a review on their isolation process,structural characteristics and antitum or activity[J].Trends Food Sci.Tech.,2007(18):4-19.
[15]Wasser SP.Medicinal mushrooms as a source of antitumor and immunomodulating polysaccharides[J].Appl Microbiol Biotechnol,2002(60):258-274.
[16]盛伟,方晓阳.杏鲍菇菌丝体胞内与胞外多糖体外抗氧化活性研究[J].中国林副特产,2009(1):7-10.
[17]Volpi N,Tarugi P.Influence of chondroitin sulfate charge density,sulfate group position,and molecularmass on Cu2+-mediated oxidation of human low-density lipoproteins:Effect of normal human plasma derived chondroitin sulfate[J].The Journal of Biochemistry,1999(125):297-304.
[18]顾有方,李卫民,李升和,等.大枣多糖对小鼠四氯化碳诱发肝损伤防护作用的实验研究[J].中国中医药科技,2006,13(2):105-107.
[19]郑晶泉.抗氧化剂抗氧化实验研究进展[J].国外医学:卫生学分册,2000,27(1):37-40.

