VRB电解液的高锰酸钾电位滴定分析
方 磊,常 芳,李晓兵,何 平
(1.西南科技大学材料科学与工程学院,四川 绵阳 621010;2.中国工程物理研究院电子工程研究所,四川绵阳 621900)
VRB电解液的高锰酸钾电位滴定分析
方 磊1,常 芳2,李晓兵2,何 平1
(1.西南科技大学材料科学与工程学院,四川 绵阳 621010;2.中国工程物理研究院电子工程研究所,四川绵阳 621900)
分析钒离子的状态及浓度,可检测全钒氧化还原液流电池(VRB)的荷电状态、容量和充放电效率。采用KMnO4-(NH4)2Fe(SO4)2体系为滴定剂的电位滴定法来分析钒电解液,可测定电解液中V(Ⅱ)、V(Ⅲ)、V(Ⅳ)和V(Ⅴ)的单一价态、混合价态离子浓度及电解液的总钒浓度。结果表明:测得的各价态钒及总钒的相对标准偏差(N=5)不超过3.67%。
全钒氧化还原液流电池(VRB); 电位滴定; 高锰酸钾(KMnO4)
全钒氧化还原液流电池(VRB,简称钒电池)以钒离子溶液为正负极活性物质[1],定量分析电解液中的各价态钒离子,可了解电池充放电过程中的电化学反应程度,分析钒充放电效率,也可为制备目标浓度的电解液提供依据。钒电池电解液的分析方法,主要有光谱法和电化学法等[2-3],目前以电化学法中的电位滴定为主,但滴定剂K2Cr2O7的毒性较强、对环境危害较大[3-4],而以(NH4)2Fe(SO4)2为滴定剂[2],操作相对繁琐,不利于现场分析。
本文作者采用KMnO4-(NH4)2Fe(SO4)2体系作为滴定剂,利用氧化还原反应进行电位滴定,测定了各种价态的钒离子浓度,并分析了电解过程中钒离子的变化情况。
1 实验
1.1 溶液的配制及标定
配制 0.1 mol/L KMnO4溶液:将17.0 g干燥的 KMnO4(成都产,AR)溶于1 000 ml蒸馏水中,煮沸、冷却后,在冷暗处置14 d。用4号砂芯漏斗过滤,保存在棕色瓶中。
KMnO4溶液的标定:准确称取3.0 g已恒重的Na2C2O4(上海产,AR),溶于100 ml蒸馏水中,转移至250 ml容量瓶中,定容。取25.00 ml,加入4 ml 3.0 mol/L H2SO4(成都产,AR)溶液,恒温水浴至 75~85℃,用配好的 KM nO4溶液滴定至粉红色,保持 30 s,记下 KMnO4溶液消耗的体积。由式(1)计算KMnO4标准溶液的浓度C1(mol/L):

式(1)中:为基准Na2C2O4的称取质量。
配制 0.2 mol/L(NH4)2Fe(SO4)2溶液:将 70.0 g(NH4)2Fe(SO4)2(成都产,AR)溶于300 ml 20%H2SO4溶液中,转移到1 000 ml棕色容量瓶中,定容,每次使用前标定。
(NH4)2Fe(SO4)2溶液的标定:准确移取20 ml配制好的(NH4)2Fe(SO4)2溶液,在T50自动电位滴定仪(瑞士产)上恒速搅拌10 s,用KMnO4溶液进行滴定,当电位到达810~890 mV时出现突跃,记下KMnO4溶液消耗的体积VKMnO4。由式(2)计算(NH4)2Fe(SO4)2标准溶液的浓度C2(mol/L):

式(2)中:C1为KM nO4溶液的浓度,VFe2+为移取的(NH4)2Fe(SO4)2溶液的体积。
电解液的制备[5]:将V2O5(湖北产,AR)、H2C2O4(成都产,AR)和H2SO4按物质的量比1.00∶1.08∶2.00混合,煮沸0.5 h,定容得到VOSO4溶液。对电堆充电,将V(Ⅳ)转变为V(Ⅳ)、V(Ⅴ)的混合态,同时除去过量的H2C2O4。当控制电位反充时,可得到V(Ⅱ)、V(Ⅲ)电解液的混合态。
1.2 实验原理
在待测液中加入滴定剂,将被测钒离子氧化成高价态或还原成低价态,浓度突变引起电极电位突跃,即可计算被测钒离子浓度。对于KMnO4-(NH4)2Fe(SO4)2体系,反应如下:
负极溶液

1.3 实验方法
用T50自动电位滴定仪,在 H3PO4中用 KMnO4和(NH4)2Fe(SO4)2溶液对不同价态离子体系进行滴定。记录滴定剂的消耗体积和滴定过程中的电极电位,对滴定曲线进行一级微商作图,可得到一个或多个尖峰,即为滴定终点。
1.3.1 V(Ⅴ)/V(Ⅳ)体系
取35 ml 3.0 mol/L H3PO4(成都产,AR)溶液置于烧杯中,加入5.00 ml V(Ⅴ)/V(Ⅳ)正极液,恒速搅拌 10 s,用配好的(NH4)2Fe(SO4)2溶液或 KMnO4溶液滴定,记下滴定突跃对应的(NH4)2Fe(SO4)2溶液及KMnO4溶液消耗的体积V1、V2。由式(7)-(9)分别计算五价钒离子、四价钒离子和总钒离子的浓度CV(Ⅴ)、CV(Ⅳ)及CⅣ+Ⅴ。
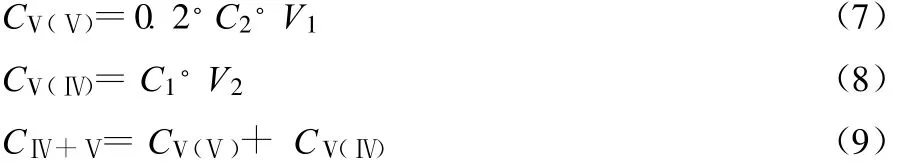
1.3.2 V(Ⅲ)/V(Ⅳ)体系
采用分析 V(Ⅴ)/V(Ⅳ)体系的方法,仅用 KMnO4溶液,滴定过程中有2个突跃,分别对应KMnO4溶液消耗的体积V3和V4。由式(10)-(12)分别计算三价钒离子、总钒离子和四价钒离子的浓度CV(Ⅲ)、CⅢ+Ⅳ及C'V(Ⅳ)。

1.3.3 V(Ⅱ)/V(Ⅲ)体系
采用分析V(Ⅳ)/V(Ⅲ)体系的方法,在N2保护下,滴定过程中有3个滴定突跃(第3个突跃舍弃),对应 KMnO4溶液消耗的体积分别为V5、V6和V7。由式(13)-(15)分别计算二价钒离子、总钒离子和三价钒离子的浓度CV(Ⅱ)、CⅡ+Ⅲ及C'V(Ⅲ)。

以K2Cr2O7(成都产,AR)、(NH4)2Fe(SO4)2为滴定剂,用电位滴定法[2-4]进行测定,再用GB7315.1-87《五氧化二钒化学分析方法》中的检测方法[6]进行测定,进行对比。
2 结果与讨论
2.1 测量介质的选择
钒离子与PO43-可生成稳定的络合物[3]。实验表明:H3PO4浓度对滴定终点有影响。当 H3PO4浓度大于 6.0 mol/L时,V(Ⅳ)氧化成V(Ⅴ)的滴定突跃斜率很小,突跃的斜率随H3PO4浓度的增加而减小。
实验确定:用KMnO4溶液测定各价态钒离子溶液时,H3PO4浓度为2.5~3.3 mol/L对各价态钒离子及总钒离子浓度的影响很小,因此选择H3PO4的浓度为3.0 mol/L。
2.2 滴定终点的确定
在H3PO4溶液中对钒电解液进行滴定,结果见图1。
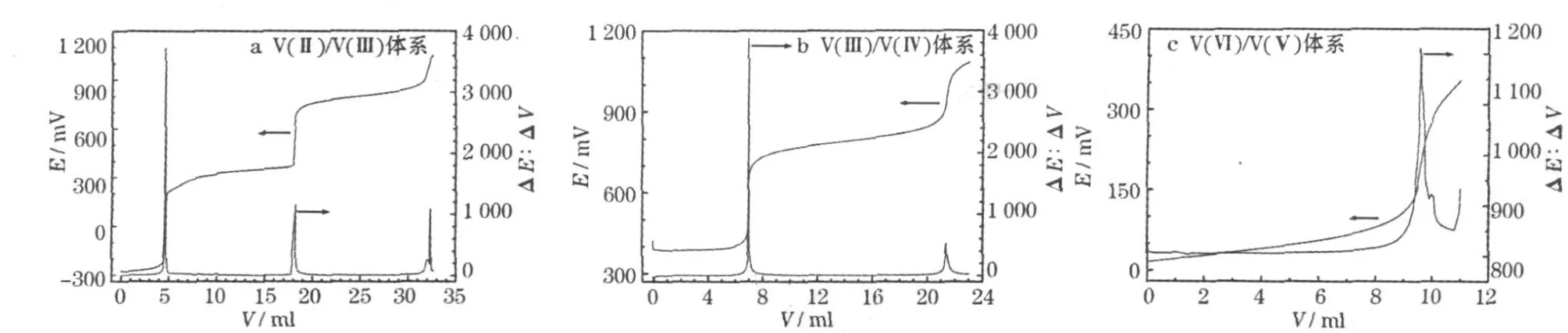
图1 KMnO4溶液电位滴定钒电解液的E-V和ΔE/ΔV-V曲线Fig.1 E-V and ΔE/ΔV-V curves of vanadium electrolyte potentiometric titrated by KMnO4
图1a中,第1个峰电位处于-35~-90 mV,峰形很尖锐,是 V(Ⅱ)氧化成 V(Ⅲ)所致;第2个峰电位处于520~560 mV,是V(Ⅱ)氧化成的V(Ⅲ)和溶液中原有的V(Ⅲ)一起被氧化成V(Ⅳ)所致,峰形相对尖锐;第3个峰电位处于950~980 mV,是前面氧化成的V(Ⅳ)继续被氧化成 V(Ⅴ)所致,峰形相对平缓。实验主要用前两个突跃来确定溶液中钒离子的浓度。图1b中,滴定曲线中出现了490~570 mV和950~980 mV的两个突跃,分别是 V(Ⅲ)被氧化成V(Ⅳ)、由V(Ⅲ)被氧化成的 V(Ⅳ)与溶液中原有的 V(Ⅳ)一起被氧化成V(Ⅳ)所致。图 1c中,V(Ⅳ)氧化成V(Ⅴ)引起了940~1 100 mV的峰。在V(Ⅳ)电解液测定中,有时一阶微分曲线会出现第2个小峰,是过量的KMnO4搅拌不均所致,分析时应以第1个峰为准。
(NH4)2Fe(SO4)2溶液电位滴定V(Ⅳ)V/(Ⅴ)体系的E-V和ΔE/ΔV-V曲线见图2。
从图2可知,在滴定过程中,V(Ⅴ)被Fe2+还原成V(Ⅳ),电位在530~580 mV发生突跃,对应的一阶导数曲线峰形相对尖锐,对应滴定剂的消耗体积为还原V(Ⅴ)所致。

图2 (NH4)2Fe(SO4)2溶液电位滴定V(Ⅳ)V/(Ⅴ)体系的E-V和ΔE/ΔV-V曲线Fig.2 E-V and ΔE/ΔV-V curves of V(Ⅳ)/V(Ⅴ)potentiometric titrated by(NH4)2Fe(SO4)2
2.3 实验结果分析
用上述实验方法对钒的各种价态体系的电解液进行分析,结果如表1所示。

表1 各种价态钒电解液分析结果Table 1 Results of analysis of several electrolytes of vanadium ions
从表1可知,标准偏差 S≤3.67%,相对标准偏差RSD≤5.53%,说明该方法的精密度较高。
将电位滴定法、GB7315.1-87中的检测方法与本方法所得的结果进行对比,如表2所示。

表2 不同方法对样品分析结果Table 2 Analysis results of samples with different methods
从表2可知,本方法的分析结果与上述方法一致。
电位滴定法的精度主要取决于滴定反应的平衡常数K。等当点附近的滴定曲线越陡,误差越小。等当点处的锐度指数ηequ可作为电位滴定准确度的量度[7]。ηequ>1 000,滴定误差不超过0.1%;10≤ηequ≤1 000,滴定仍然可行,但误差较大,为0.1%~5.0%;ηequ<10,无法确定滴定终点。ηequ可由氧化还原电位滴定的ηequ计算公式[式(16)]估算。


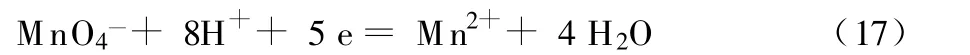
计算可知,式(3)-(6)所示反应的ηequ分别为 1.35×1023、2.37×1029、4.41×105和 6.43×104,由此可见,分析的相对误差不超过0.1%。
3 应用
采用电解法制备电解液时,高价钒被还原成所需价态,需对钒价态组成和浓度进行检测,以便了解电解状态。表3列出了一组电解液在电解过程中钒离子浓度随时间的变化情况(电解液体积为120 L,恒流150 mA,2只单体电池)。
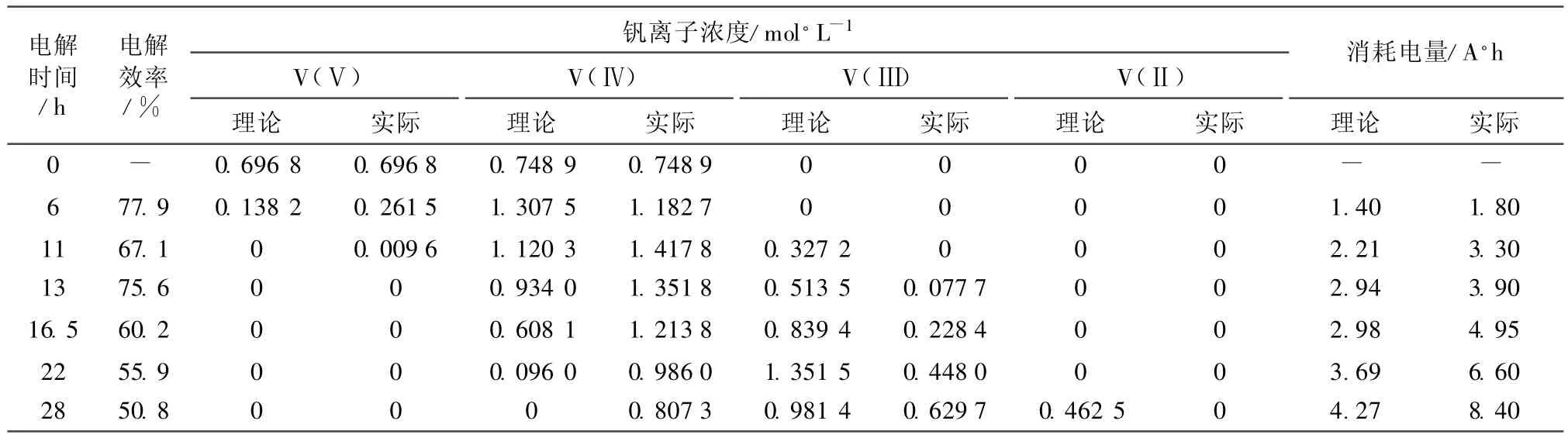
表3 电解过程中钒离子价态和浓度随时间的变化Table 3 Relationship of valence and concentration of vanadium ions with electrolysis time
从表3可知,采取电解的方式把高价钒电解成低价态,随着电解的进行,电解效率降低。在电解过程中,对钒电解液的价态组成和浓度进行全面分析,可及时检测电解的状态。
4 结论
采用KMnO4-(NH4)2Fe(SO4)2体系作为滴定剂对钒电解液进行电位滴定时,KMnO4能把低价钒氧化成较高价态,因此可检测低价钒离子;(NH4)2Fe(SO4)2把V(Ⅴ)还原成V(Ⅳ),可用来测定V(Ⅴ)的浓度。KMnO4经济易得、不具毒害性,实验结果的相对标准偏差不超过3.67%。结果表明,本方法可为钒电解液价态组成和浓度的检测提供依据。
[1] Joerissen L,Garche J,Fabjan C,et al.Possible use of vanadium redox-flow batteries for energy storage in small geids and stand-alone photovoltaic systems[J].J Power Sources,2004,127(1-2):98-104.
[2] LIU Su-qin(刘素琴),SANG Yu(桑玉),LI Lin-de(李林德),et al.电位滴定法测定钒电池电解液中不同价态的钒[J].Physical Testing and Chemical Analysis Part B:Chemical Analysis(理化检验-化学分册),2007,43(12):1 078-1 080.
[3] PENG Sheng-qian(彭声谦),CAI Shi-ming(蔡世明),XU Guozhen(许国镇),et al.钒电池充电过程中钒价态及其变化的现场分析[J].Physical Testing and Chemical Analysis Part B:Chemical Analysis(理化检验-化学分册),1998,34(7):291-294.
[4] T IAN Bo(田波),YAN Chuan-wei(严川伟),QU Qing(屈庆),et al.钒电池电解液的电位滴定分析[J].Battery Bimonthly(电池),2003,33(4):261-263.
[5] LIU Lian(刘联),LIU Xiao-jiang(刘效疆),LI Xiao-bing(李晓兵),et al.对甲苯磺酸对钒电池负极液的影响[J].Dianyuan Jishu(电源技术),2010,134(6):552-555.
[6] GB 7315.1-87,五氧化二钒化学分析方法-五氧化二钒量的测定方法[S].
[7] FANG Jian-an(方建安).影响电位滴定精度的几个问题[J].Analytical Instrumentation(分析仪器),1993,(4):55-58.
Potassium permanganate based potentiometric titration of electrolyte of VRB
FANG Lei1,CHANG Fang2,LI Xiao-bing2,HE Ping1
(1.School of Materials Science and Engineering,Southwest University of Science and Technology,Mianyang,Sichuan621010,China;2.Institute of Electronic Engineering,China Academy of Engineering Physics,Mianyang,Sichuan621900,China)
all vanadium redox flow cell(VRB); potentiometric titration; potassium permanganate(KM nO4)
TM912.9
A
1001-1579(2012)01-0054-04
方 磊(1986-),女,河南人,西南科技大学材料科学与工程学院硕士生,研究方向:能源电化学;
常 芳(1974-),女,甘肃人,中国工程物理研究院电子工程研究所工程师,研究方向:钒电池;
李晓兵(1975-),男,四川人,中国工程物理研究院电子工程研究所副研究员,研究方向:钒电池;
何 平(1971-),男,四川人,西南科技大学材料科学与工程学院教授,研究方向:能源电化学,本文联系人。
四川省第二批应用技术研究与开发项目(2008GZ0085),四川省教育厅科研项目(06ZD1105)
The analysis of the state and the concentration of vanadium ions provided an important evidence for determining the state of charged vanadium ions,the capacity of battery and the charge-discharge efficiency.The potentiometric titration method was established to determine the vanadium electrolyte through KMnO4-(NH4)2Fe(SO4)2system.The proposed method was used to analyze the single and mixed valence state of V(Ⅱ),V(Ⅲ),V(Ⅳ),V(Ⅴ)and total concentration of vanadium ions in electrolyte.The results showed that RSD(N=5)based on the proposed method was no more than 3.67%.
2011-04-01

