胃腺癌血清蛋白质标志物的筛选及鉴定*
王伟平, 刘池波
(1台州市第一人民医院检验科,浙江台州318020;2台州市立医院检验科,浙江台州318000)
胃腺癌是最常见的消化道恶性肿瘤之一[1],占 我国恶性肿瘤死亡的23.2%,每年死于胃腺癌的人数约为16万[2],大部分胃腺癌患者就诊时已属中晚期。目前临床胃腺癌的诊断方法多是物理诊断和组织细胞学诊断,这些方法往往只能发现中期病例,并且操作繁琐,因此只能靠生物化学方法检测胃腺癌发生过程中表达的特异性蛋白标志物达到快速诊断的目的。但是至今没有一种标志物对胃腺癌是完全特异性的,如现已发现的胃腺癌相关标志物癌胚抗原、糖链抗原19-9、糖链抗原125等诊断,灵敏度不高,特异性不强,尚不足于用来进行早期诊断[3]。因此,探索和建立一种简单、快速、敏感性高和特异性强的胃腺癌快速诊断技术已经成为临床医学上亟待解决的问题。表面增强激光解吸电离飞行时间质谱(surface-enhanced laser desorption ionization time-of-flight mass spectrometry,SELDI-TOF-MS)是近年来出现的一种新型的蛋白质组学研究方法[4-6],可用于直接检测临床各种类型标本,如血清、尿液、脑脊液等,实现了质谱技术用于临床样本检测的飞跃[5,7]。我们利用 SELDI-TOF-MS 技术结合基质辅助激光解吸电离飞行时间质谱技术(MALDI-TOF-MS),对109例胃腺癌和106例对照组(60例健康者、30例慢性浅表性胃炎和16例慢性萎缩性胃炎)进行蛋白质组学分析,筛选出胃腺癌特异的蛋白质标志物,并用质谱鉴定技术对筛选的胃腺癌相关蛋白进行鉴定分析。
材料和方法
1 研究对象
109 例胃腺癌患者按照Dukes分类(其中Dukes A 25例,Dukes B 22例,Dukes C 28例,Dukes D 34例),所有胃腺癌的术前血清来自浙江大学附属第一医院和浙江省台州市立医院。106例对照血清来自浙江省台州市立医院(慢性浅表性胃炎30例,慢性萎缩性胃炎16例,健康者60例)。按照表1分成实验组与验证组。实验经本院伦理委员会批准,受试者均签署知情同意书。所有胃腺癌、慢性浅表性胃炎和慢性萎缩性胃炎患者均经2位病理学专家证实。所有外周血标本均在清晨空腹采血,采集后立即放入 4℃冰箱内静置 1~2 h,然后 4℃3 000 r/min离心10 min,分离血清后,在冰上将血清转移到新的PCR管中分装,放入-80℃内冰箱保存待检。
2 仪器和试剂
乙腈、三氟乙酸(TFA)、芥子酸(sinapinic acid,SPA)、尿素、DTT、CHAPS、Tris-HCl、H2O 等购自Sigma。SELDI-TOF-MS(PBS IIC)质谱仪购自Ciphergen Biosystems。Q10蛋白芯片购于 Bio-Rad。MALDI-TOF-MS质谱仪(AXIMA CFRTMplus)购于Kratos Analytical。高相液相色谱(high-performance liquid chromatography,HPLC)购于岛津 Shimadzu。Xcalibur的程序组件Bioworks 3.2数据库购自Thermo Finnigan。

表1 109例胃腺癌患者临床分组和106例对照组情况Table 1.Clinical Dukes stage of 109 patients with gastric adenocarcinoma and 106 control
3 胃腺癌SELDI-TOF-MS分析
血清经冰浴融解后4℃ 10 000 r/min离心10 min。取 20 μL 血清加 30 μL U9 缓冲液(9 mol/L尿素,2%CHAPS,1%DTT),4 ℃ 振摇 20 min,再加100 μL U1缓冲液(50 mmol/L Tris-HCl缓冲液9倍稀释U9缓冲液),4℃振荡30 min。每个芯池中加200 μL Q10 缓冲液(100 mmol/L Tris-HCl缓冲液,pH 9.0),振荡孵育5 min 2次。从上述蛋白变性后的血清样品中取50 μL,加200 μL Q10缓冲液稀释,加至Q10芯片的Bioprocessor(Ciphergen)中,振荡60 min,甩去血清标本,每孔加 200 μL Q10缓冲液,振荡孵育5 min 2次,最后芯片用20 mmol/L HEPES(pH 7.4)淋洗,晾干芯片。芯片每孔分2次加 SPA 0.5 μL,2次之间自然晾干。质谱仪参数设定为激光强度185,灵敏度8,优化范围2 000~20 000质荷比(m/z)。每条芯片取1点用同一正常人血清作内参照,芯片间变异系数CV≤10%。检测前用All-in-One多肽标准芯片校正,系统质量偏差≤0.1%。原始数据先以ProteinChip 3.0软件校正。
4 蛋白质的纯化分析
将血清溶解后取出100 μL血清,加入350 μL水,700 μL纯乙腈。将上述混合液体置入-20℃的冰箱内,30 min后取出,3 000 r/min离心10 min。上清液转入PCR管中冻干20 min。将冻干的样品上样至HPLC中。收集不同时间的纯化液体,将纯化出的蛋白液置入PCR管中冻干约20 μL。各取所收集组分 0.5 μL,分别加入 1.5 μL 基质溶液(10 mg/L CHCA),混合后点于靶板上,静置结晶、干燥后用MALDI-TOF-MS检测。检测条件:脉冲氮激光(337 nm)作为离子解吸电离源,加速电压20 kV,采用线性分析模式,质量范围:3 000~20 000(m/z)。找出SELDI-TOF-MS所筛选质荷峰值的特异样本。
5 目标蛋白质的LC-MS/MS分析
取20 μL纯化的目标蛋白质,加60 μL 8 mol/L尿素,使尿素的终浓度为6 mol/L,室温振荡20 min;加入 0.8 μL 1 mol/L DTT,使其终浓度为 10 mmol/L,室温振荡1 h;再加入 3.2 μL 1 mol/L 碘乙酰胺,使其终浓度为40 mmol/L,避光放置45 min;加入3.2 μL 1 mol/L DTT,终浓度为40 mmol/L,振荡20 min;加入400 μL 50 mmol/L NH4HCO3稀释样品溶液,使尿素终浓度降为1 mol/L,pH约8.0。每支样品中加入0.1 μg蛋白酶 K,37 ℃水浴1 h,加入甲酸调溶液pH<3,终止酶解反应。目标蛋白的酶解产物用LC-MS/MS进行分析。样品溶液可以通过特定装置直接上样于自制的C18毛细管液相色谱柱。色谱柱及色谱条件:自制毛细管柱内径为100 μm,填料部分长100 mm,填料粒径 5 μm;流动相 A:水,0.1% 甲酸;流动相B:乙腈,0.1%甲酸);洗脱程序:100%A(0 min)-100%A(5 min)-5%B(5.1 min)-65%B(60 min)-100%B(75 min)-100%B(85 min);流速:200~800 nL/min。质谱条件:采用数据依赖模式(data-dependent mode),扫描质量范围:400~2 000(m/z),每次选取全扫描(full scan)中5个信号最强的离子峰(母离子)进行二级质谱(MS2)分析。
6 LC-MS/MS分析数据的检索
数据检索利用 Xcalibur的程序组件 Bioworks 3.2(Thermo Finnigan)完成,根据二级离子谱图在NCBI的人类蛋白数据库(human.ref)中检索肽段序列。检索参数设置:酶切断裂位点设为随机,固定修饰为半胱氨酸的胺甲酰化修饰,可变修饰为甲硫氨酸的氧化,检索参数 ΔCN >0.1;Sp>500;Rsp≥5;Xcorrvs Charge:Xcorr(+1)> 1.9、Xcorr(+2)> 2.5、Xcorr(+3)>3.75。
7 统计学处理
胃腺癌SELDI蛋白指纹图谱用Biomarker Wizard Software 3.1软件和 Biomarker Patterns Software 4.0.1软件进行分组及相关性分析,胃腺癌组与对照组之间蛋白质峰强度比较采用t检验,以P<0.05为差异有统计学意义。
结 果
1 胃腺癌血清蛋白指纹图谱分析
实验组中65例胃腺癌组和53例对照组血清的蛋白指纹图谱经标准化后,用 Biomarker Wizard软件分析,在分子质量2 000~50 000范围内共检测到227个蛋白峰,见图1。
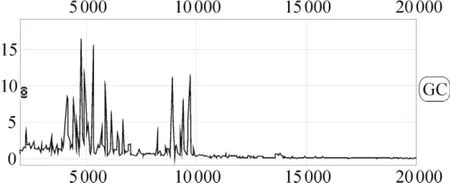
Figure 1.Representative protein spectrum of a gastric adenocarcinoma sample detected by SELDI-TOF-MS combined with Q10 protein chip,showing the protein mass/charge ratio between 1 000 and 20 000.图1 经SELDI-TOF-MS结合Q10蛋白芯片检测的胃腺癌血清蛋白质指纹表达图谱
2 胃腺癌血清蛋白指纹图谱数据分析及胃腺癌诊断模型的建立
经Biomarker Patterns软件作进一步分析显示,胃腺癌患者外周血清蛋白质表达谱与对照组相比,m/z为5 906.5、6 635.7 和8 716.3 的3 个蛋白峰的差异有统计学意义(P <0.01),见图 2、表 2,其中5 906.5 D蛋白峰在胃腺癌组中明显高于对照组,而6 635.7 D和8 716.3 D蛋白峰则在对照组中相对高表达,见表2。用此模型分析65例胃腺癌与53例对照组的质谱结果,其敏感性为93.85%(61/65),特异性为94.34%(50/53),见表3。根据差异蛋白及其特定组合,理论上可以区分胃腺癌组与对照组。
3 诊断模型的验证
采用44例胃腺癌组与53例对照组检测得到的蛋白指纹图谱对已建立的胃腺癌诊断模型进行验证,验证结果表明其对胃腺癌诊断的敏感性为90.91%(40/44),特异性为 90.57%(48/53),见表3。
4 差异蛋白质峰的纯化
将胃腺癌3个差异蛋白质峰(m/z 5 906.5、6 635.7和8 716.3)经 HPLC 分离纯化后,收集到不同的PCR管中,经MALDI-TOF-MS检测,发现3个纯化样本经MALDI-TOF-MS检测后相对分子质量分别是5 906.4、6 632.9 和 8 704.3,见图3。
5 质谱分析及数据库检索
将上述3管的蛋白质样品酶解后,采用LCMS/MS测定该蛋白质的酶解肽段,数据经过Xcalibur的程序组件 Bioworks 3.2(Thermo Finnigan)分析。根据二级离子谱图在NCBI的人类蛋白数据库中检索肽段序列,查得其对应可能的蛋白质为:5 906.4为纤维蛋白原α链,所检测到的肽段氨基酸序列与数据库中的纤维蛋白原α链序列匹配率为100%;6 632.9为载脂蛋白 A-II,所检测到的肽段氨基酸序列与数据库中的载脂蛋白A-II序列匹配率为96%;8 704.3为载脂蛋白 C-I,所检测到的肽段氨基酸序列与数据库中的载脂蛋白 C-I序列匹配率为60%,见表4。
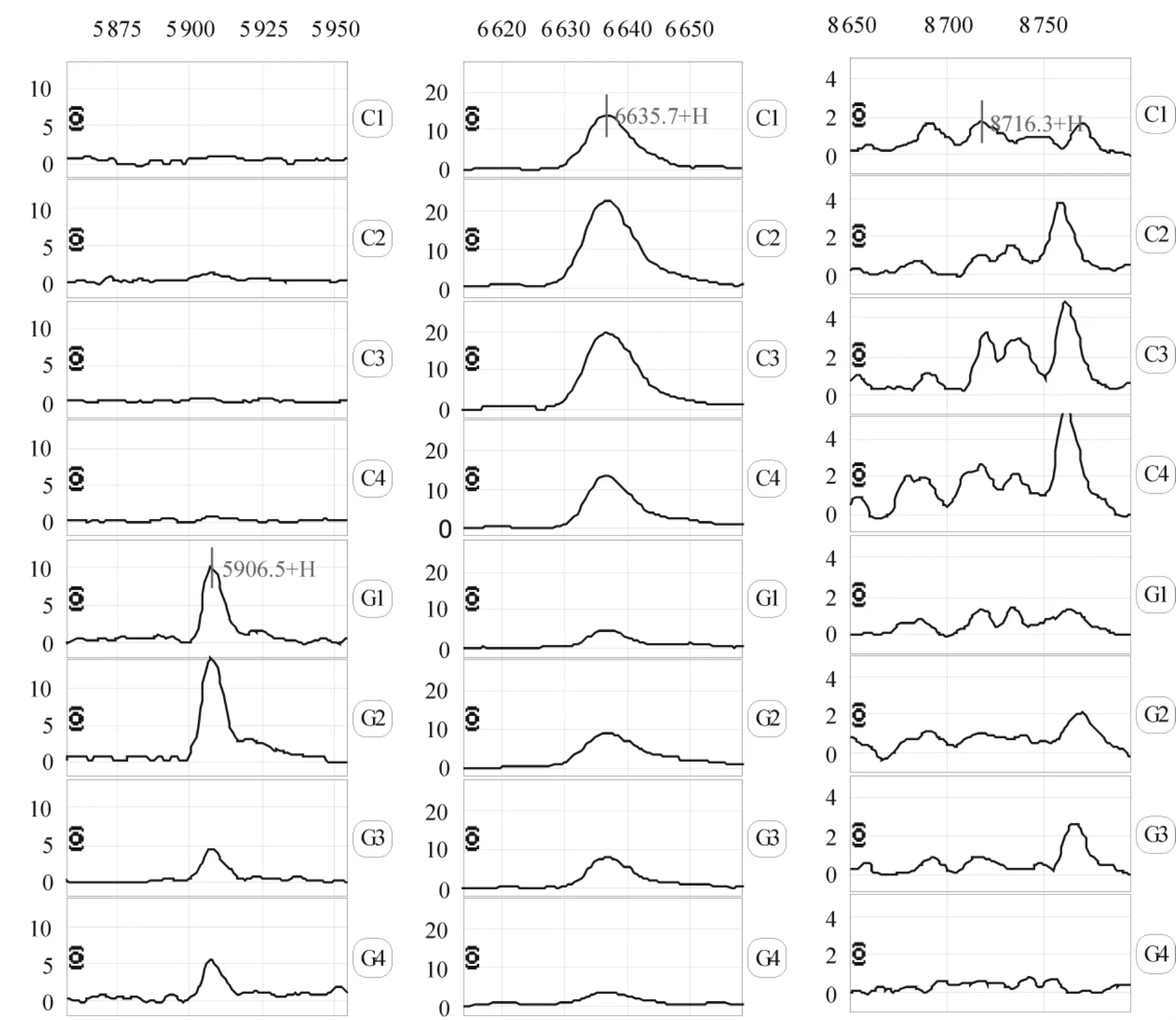
Figure 2.Differential expression of SELDI peaks with mass/charge ratios of 5 906.5,6 635.7 and 8 716.3 in serum samples from patients with gastric adenocarcinoma(G)and healthy control subjects(C).图2 建立胃腺癌诊断模型的3个蛋白峰(m/z 5 906.5、6 635.7和8 716.3)的蛋白指纹图谱
表2 胃腺癌组与对照组血清蛋白质峰强度比较Table 2.Mean signal intensity of various proteins and peptides comparing gastric adenocarcinoma with healthy control(±s)

表2 胃腺癌组与对照组血清蛋白质峰强度比较Table 2.Mean signal intensity of various proteins and peptides comparing gastric adenocarcinoma with healthy control(±s)
**P < 0.01 vs healthy control.
m/z Gastric adenocarcinoma(n=65)Healthy control(n=53)5 906.5 8.53 ±4.33**0.88 ±0.31 6 635.7 6.54 ±2.44** 17.56 ±4.43 8 716.3 0.93 ±0.29**2.16 ±0.98
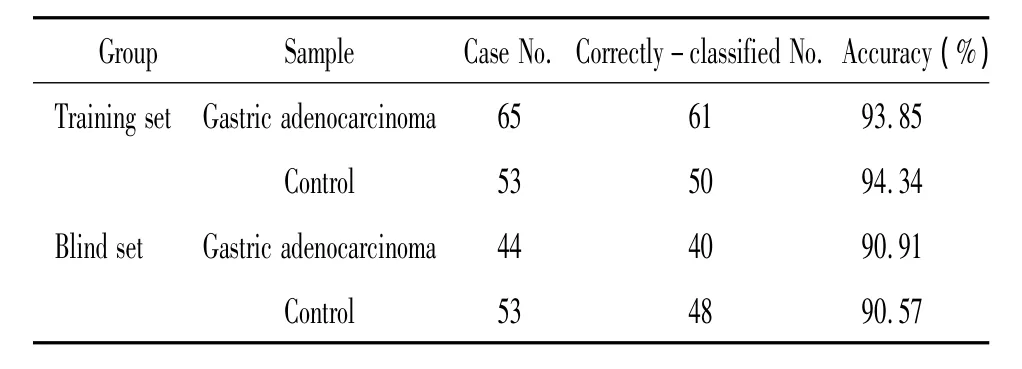
表3 胃腺癌诊断模型的诊断特性Table 3.Prediction results of the diagnostic model for gastric adenocarcinoma

Figure 3.MALDI-TOF-MS spectra of the three purified potential protein markers.A:m/z 5 906.5;B:m/z 6 635.7;C:m/z 8 716.3.图3 m/z 5 906.5、6 635.7 和8 716.3 的3 个差异蛋白经蛋白纯化后的MALDI-TOF-MS图
讨 论
SELDI-TOF-MS是近年出现的一种新的蛋白质组学研究方法,它集芯片和质谱于一身,是当前临床蛋白质组学研究中较理想的技术平台。目前已在自身免疫性疾病[8]、感染性疾病[9]及恶性肿瘤[10]等多种疾病标志物筛选方面取得了突破性进展,并且筛选出许多与疾病相关的新型生物标志物为临床疾病的诊断和治疗等提供了新的选择[11]。但SELDITOF-MS技术也存在一些缺点,如不同批次的芯片得到的质谱有较大的差异、基线漂移以及高噪音等都可能会降低检测结果的重复性。其次SLEDITOF-MS技术结合一种芯片所获得的蛋白并非血清中所有蛋白,只是一种性质的蛋白,因此要想获得更多蛋白,需要采用多种芯片检测。最后SLEDI-TOF-MS技术善于捕获小分子蛋白,因此也见有选用双向凝胶电泳技术来筛选胃腺癌大分子蛋白的报道[12]作为SELDI技术筛选差异蛋白的互补技术。这些缺点有待我们进一步改善。
在本研究中,我们通过SLEDI-TOF-MS技术结合 Q10 芯片筛选出 m/z 5 906.5、6 635.7 和8 716.3的蛋白质标志物3个,其中5 906.5在胃腺癌血清中高表达,6 635.7和8 716.3在胃腺癌血清中低表达。由这3个标志物组合的诊断模型在检测胃腺癌的灵敏度为 93.85%(61/65),特异性为94.34%(50/53)。提示可以将这3个蛋白质标志物作为胃腺癌血清学诊断的指标。通过本研究建立的诊断模型对44例胃腺癌组与53例对照组进行验证,验证结果表明其对胃腺癌诊断的敏感性为90.91%(40/44),特异性为 90.57%(48/53)。由于Q10芯片是一种强阴离子交换芯片,用于分析负电荷蛋白,有别于我们原先报道采用WCX芯片捕获的正电荷蛋白[13-14]建立的胃癌差异蛋白指纹图谱,但可将2种芯片联合检测,提高检测率。

表4 胃腺癌差异蛋白质的氨基酸序列Table 4.Identification of the three potential protein biomarkers with identified peptides and covered sequences
通过本研究,我们鉴定m/z为5 906.5的血清标志物为纤维蛋白原α链。纤维蛋白原α链是纤维蛋白原的组成部分,与β-链及γ-链组成纤维蛋白原。FIB是一种糖蛋白,由肝脏细胞合成及分泌,其形成后进入血循环,是血浆中含量最高的凝血因子,近年研究发现其与恶性肿瘤的发生密切相关。纤维蛋白原被激活后转变为纤维蛋白多聚体,具有极强的交织网络之功能,它可网络血细胞形成血块,为肿瘤细胞的生长、侵袭和转移提供支架;FIB亦可作为不同黏附分子的配体,增加血小板和肿瘤细胞间的黏附结合,促使肿瘤细胞的侵袭、转移[15-17]。Ward等[18]应用SELDI技术检测胰腺癌发现50%以上的胰腺癌患者纤维蛋白原α链片段是升高的。Cheng等[19]应用MALDI-TOF结合磁珠检测口腔癌,发现纤维蛋白原α链是口腔癌有用的临床肿瘤标志物。在动物模型的研究表明,通过强烈抑制纤维蛋白原含量可明显减少转移性肺癌的发生发展,进而进一步证明了在维持肿瘤细胞的入侵和生存[20-21]方面纤维蛋白原所起的重要作用。同样,在已发现的黑色素瘤患者[22]血清中纤维蛋白原链肽也有明显增加。可见纤维蛋白原的存在,可能会影响肿瘤的发展和转移。
m/z为6 635.7的蛋白为载脂蛋白 A-II,它是人类高密度脂蛋白(HDL)的主要载脂蛋白,其含量占HDL2总载脂蛋白的15%,HDL3总载脂蛋白的25%。载脂蛋白A-II的主要功能是参与脂质的运输,通过从高密度脂蛋白中转移载脂蛋白A-I、影响肝脂肪酶、抑制卵磷酯酰化酶的水平,在载脂蛋白 A-II缺乏的情况下,还会引起胰岛素代谢紊乱。但发挥这些功能的具体机制尚未完全清楚。最近越来越多的研究结果表明,APO家族蛋白是其中的关键因素。虽然它们在肿瘤发生中的作用尚未明确,但有证据表明其与细胞的增殖/凋亡有关[23]。Malik等[24]利用IMAC-Cu芯片研究前列腺癌的标志蛋白,其中的一个标志蛋白就是载脂蛋白 A-II。Xue等[25]利用SELDI技术检测胰腺癌发现载脂蛋白 A-II和载脂蛋白 C-I联合应用比单用CA199更能提高胰腺癌的诊断能力。可见载脂蛋白A-II与肿瘤的发生发展密切相关。
m/z为8 716.3的蛋白为载脂蛋白C-I,主要在肝脏合成,有极少一部分由小肠合成,其主要生物学功能是参与脂类代谢。至今,国内外有关载脂蛋白C-I与肿瘤的相关性研究报道甚少,未见其与胃腺癌的相关报道。Takano等[26]采用SELDI-TOF-MS技术检测胰腺癌血清,结果显示,胰腺癌细胞可分泌载脂蛋白C-I,通过抑制载脂蛋白C-I的表达可降低癌细胞复制,诱导癌细胞凋亡。Yang等[27]利用SELDI-TOF-MS筛选非小细胞肺癌患者血清差异蛋白,发现m/z为 6 628、9 191和11 412的一组蛋白可用于非小细胞肺癌筛查。其中m/z为6628蛋白在非小细胞肺癌中低表达,经鉴定为载脂蛋白CI。Engwegen等[28]利用 SELDI-TOF-MS分别检测了大肠癌血清,得到m/z为6 600和6 630处的蛋白质,经鉴定为载脂蛋白 C-I,其在大肠癌和乳腺癌患者血清中低表达。这些关于载脂蛋白C-I在肿瘤患者血清中低表达的研究,与本研究结果相符,这可能是在肿瘤发生过程中,肿瘤细胞与宿主相互作用的结果。但其机制尚未清楚,有待进一步研究。
本研究鉴定出的纤维蛋白原α链、载脂蛋白 A-II和载脂蛋白 C-I在胃腺癌诊断中的联合应用具有较高的特异度和敏感性,且本研究2个肽段与Cohen等[29]报道结果相同,可作为胃腺癌特异诊断指标,具有良好的临床应用推广前景。在下一步研究中,我们将进一步扩大样本量来验证。
[1] Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics,2002[J].CA Cancer J Clin,2005,55(2):74-108.
[2] 孙秀娣,牧 人,周有尚,等.中国胃癌死亡率20年变化情况分析及其发展趋势预测[J].中华肿瘤杂志,2004,26(1):4-9.
[3] Schneider J,Bitterlich N,Schulze G.Improved sensitivity in the diagnosis of gastro-intestinal tumors by fuzzy logic-based tumor marker profiles including the tumor M2-PK[J].Anticancer Res,2005,25(3A):1507-1515.
[4] Zeidan BA,Townsend PA.SELDI-TOF proteomic profiling of breast carcinomas identifies clinicopathologically relevant groups of patients similar to previously defined clusters from cDNA expression[J].Breast Cancer Res,2008,10(3):107.
[5] Cho WC,Yip TT,Ngan RK,et al.ProteinChip array profiling for identification of disease-and chemotherapyassociated biomarkers of nasopharyngeal carcinoma[J].Clin Chem,2007,53(2):241-250.
[6] Kozak KR,Amneus MW,Pusey SM,et al.Identification of biomarkers for ovarian cancer using strong anion-exchange ProteinChips:potential use in diagnosis and prognosis[J].Proc Natl Acad Sci USA,2003,100(21):12343-12348.
[7] Zhukov TA,Johanson RA,Cantor AB,et al.Discovery of distinct protein profiles specific for lung tumors and premalignant lung lesions by SELDI mass spectrometry[J].Lung Cancer,2003,40(3):267-279.
[8] Zhang X,Jin M,Wu H,et al.Biomarkers of lupus nephritis determined by serial urine proteomics[J].Kidney Int,2008,74(6):799-807.
[9] Molina S,Missé D,Roche S,et al.Identification of apolipoprotein C-III as a potential plasmatic biomarker associated with the resolution of hepatitis C virus infection[J].Proteomics Clin Appl,2008,2(5):751-761.
[10] Liang Y,Fang M,Li J,et al.Serum proteomic patterns for gastric lesions as revealed by SELDI mass spectrometry[J].Exp Mol Pathol,2006,81(2):176-180.
[11] Guo R,Pan C,Shen J,et al.New serum biomarkers for detection of esophageal carcinoma using matrix-assisted laser desorption/ionization time-of-flight mass spectrometry[J].J Cancer Res Clin Oncol,2011,137(3):513-519.
[12] 刘池波.蛋白质组技术在胃癌相关标志物筛查中的应用[J].实用肿瘤学杂志,2008,23(3):204-207.
[13] 刘池波,梁 勇,王海宝,等.胃癌患者中血清淀粉样蛋白A的测定及临床意义[J].中华胃肠外科杂志,2009,12(3):314-315.
[14] 刘池波,梁 勇.应用SELDI-TOF-MS技术建立胃癌筛选血清蛋白质指纹图谱模型[J].医学研究杂志,2008,37(1):115-117,124.
[15] Pereira M,Rybarczyk BJ,Odrljin TM,et al.The incorporation of fibrinogen into extracellular matrix is dependent on active assembly of a fibronectin matrix[J].J Cell Sci,2002,115(Pt 3):609-617.
[16] Rybarczyk BJ,Lawrence SO,Simpson-Haidaris PJ.Matrix-fibrinogen enhances wound closure by increasing both cell proliferation and migration[J].Blood,2003,102(12):4035-4043.
[17] Simpson-Haidaris PJ,Rybarczyk B.Tumors and fibrinogen.The role of fibrinogen as an extracellular matrix protein[J].Ann N Y Acad Sci,2001,936:406-425.
[18] Ward DG,Wei W,Buckels J,et al.Detection of pancreatic adenocarcinoma using circulating fragments of fibrinogen[J].Eur J Gastroenterol Hepatol,2010,22(11):1358-1363.
[19] Cheng AJ,Chen LC,Chien KY,et al.Oral cancer plasma tumor marker identified with bead-based affinityfractionated proteomic technology[J].Clin Chem,2005,51(12):2236-2244.
[20] Palumbo JS,Kombrinck KW,Drew AF,et al.Fibrinogen is an important determinant of the metastatic potential of circulating tumor cells[J].Blood,2000,96(10):3302-3309.
[21] Palumbo JS,Talmage KE,Liu H,et al.Plasminogen supports tumor growth through a fibrinogen-dependent mechanism linked to vascular patency[J].Blood,2003,102(8):2819-2827.
[22] Bottasso B,Mari D,Coppola R,et al.Hypercoagulability and hyperfibrinolysis in patients with melanoma[J].Thromb Res,1996,81(3):345-352.
[23] Trougakos IP,Gonos ES.Clusterin/apolipoprotein J in human aging and cancer[J].Int J Biochem Cell Biol,2002,34(11):1430-1448.
[24] Malik G,Ward MD,Gupta SK,et al.Serum levels of an isoform of apolipoprotein A-II as a potential marker for prostate cancer[J].Clin Cancer Res,2005,11(3):1073-1085.
[25] Xue A,Scarlett CJ,Chung L,et al.Discovery of serum biomarkers for pancreatic adenocarcinoma using proteomic analysis[J].Br J Cancer,2010,103(3):391-400.
[26] Takano S,Yoshitomi H,Togawa A.Apolipoprotein C-1 maintains cell survival by preventing from apoptosis in pancreatic cancer cells[J].Oncogene,2008,27(20):2810-2822.
[27] Yang Y,Zhao S,Fan Y,et al.Detection and identification of potential biomarkers of non-small cell lung cancer[J].Technol Cancer Res Treat,2009,8(6):455-466.
[28] Engwegen JY,Helgason HH,Cats A,et al.Identification of serum proteins discriminating colorectal cancer patients and healthy controls using surface-enhanced laser desorption ionisation-time of flight mass spectrometry[J].World J Gastroenterol,2006,12(10):1536-1544.
[29] Cohen M,Yossef R,Erez T,et al.Serum apolipoproteins C-I and C-III are reduced in stomach cancer patients:results from MALDI-based peptidome and immunobased clinical assays[J].PLoS One,2011,6(1):e14540.

