提高芝麻粕饲用品质的发酵菌种筛选与发酵条件优化*
彭惠惠,徐雅芫,李吕木,,钱坤,吴东,周芬,许发芝,丁小玲
1(安徽农业大学 茶与食品科技学院,安徽合肥,230036)
2(安徽农业大学 生命科学学院,安徽 合肥,230036)
3(安徽农业大学动物科技学院,安徽合肥,230036)
4(安徽省畜牧生物工程技术研究中心,安徽 合肥,230031)
提高芝麻粕饲用品质的发酵菌种筛选与发酵条件优化*
彭惠惠1,徐雅芫2,李吕木1,3,钱坤4,吴东4,周芬4,许发芝3,丁小玲3
1(安徽农业大学 茶与食品科技学院,安徽合肥,230036)
2(安徽农业大学 生命科学学院,安徽 合肥,230036)
3(安徽农业大学动物科技学院,安徽合肥,230036)
4(安徽省畜牧生物工程技术研究中心,安徽 合肥,230031)
以普通芝麻粕为原料,选用枯草芽孢杆菌、乳酸菌、酵母菌多个菌种,通过单因素、正交试验,优化微生物发酵条件,以降低芝麻粕中植酸含量,提高粗蛋白、酸溶蛋白等有益成分的含量。单因素试验的优化条件为:料水比1∶0.8(g∶mL)、R-02与KG-109混菌发酵;正交试验优化的发酵条件为:温度30℃、R-02与KG-109接种比例2∶1、接种量8%、时间10d。在此条件下发酵后植酸含量为0.08%,植酸降解率达到86.21%,粗蛋白含量为49.85%,酸溶蛋白为9.07%,挥发性盐基氮为2075.5 mg/kg。
芝麻粕,植酸,固态发酵,优化
中国是芝麻的主产区,根据国家统计信息,2008年芝麻总产量达到58.6万t。每年约有50%的芝麻用于榨油,剩余芝麻饼粕约14.7万t。芝麻饼粕的营养丰富,氨基酸组合全面,但含有大量植酸和单宁[1],直接饲喂影响动物的适口性,降低矿物质离子的吸收率和饲料的消化率,这些都限制了芝麻饼粕在畜禽日粮中的广泛应用。降低芝麻饼粕中植酸含量的手段很多,如高温蒸煮[2]、高压、溶剂法、超滤法[3]等,但这些方法存在成本太高,其他营养成分被破坏等问题。因此,人们开始关注条件温和的生物学方法,即酶制剂法和微生物发酵法。酶制剂法使用方便、效果显著、作用条件温和[4],但单种酶系效果单一[5];然而微生物发酵法利用微生物生长迅速,数量多、酶系复杂等特点,操作简单,去除抗营养因子效果明显,还能增加小肽等有益成分[6]。Ramachandran等人[7],用微生物固态发酵椰子饼粕和芝麻饼粕,经条件优化,植酸酶产量达到64 U/g。Singh等人[8]用嗜热孢霉菌固态发酵芝麻饼粕,植酸酶活力达到282 U/g(干基),能够有效降低植酸含量。以上研究对植酸去除虽有一定的效果,但都是利用好氧菌进行有氧发酵,有氧发酵较厌氧发酵将消耗大量营养物质产能,同时中间代谢产物也被彻底氧化而损失。利用厌氧或兼性厌氧微生物进行的厌氧发酵,在豆粕[9]、菜籽粕[10]等方面都有相关报道。本课题以普通芝麻粕为原料,以植酸含量为主要考察指标,筛选合适的微生物,优化微生物厌氧发酵条件,同时研究粗蛋白、酸溶蛋白等有益成分的含量,以及挥发性盐基氮等有害成分的含量,旨在降解芝麻粕中的植酸和提高发酵芝麻粕产品的饲用品质,为大规模生产提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 菌种
为安徽农业大学饲料科技研究所保藏的乳酸菌(Laobacillus)-01(R-01)、乳酸菌-02(R-02)、枯草芽孢杆菌(B.subtilis)-109(KG-109)、酵母菌(Saccharomyces)-05(J-05)、酵母菌-06(J-06)、酵母菌-08(J-08)、酵母菌-10(J-10)、酵母菌-11(J-11)。
1.1.2 原料
芝麻粕:水分含量9.59%,粗蛋白含量43.85%,总磷含量1.40%,植酸含量0.59%,原料粉碎过40目筛备用。
1.1.3 化学试剂
浓 H2SO4、三氯乙酸(TCA)、FeCl3。
1.1.4 培养基
LB 培养基:蛋白胨10 g、酵母粉5 g、NaCl 10 g、吐温 2010 mL、蒸馏水1000 mL,pH 7.0,121℃灭菌20 min。
牛肉膏蛋白胨培养基:蛋白胨10 g、牛肉膏5 g、NaCl5g、蒸馏水1000 mL,pH 7.2,121℃ 灭菌 20 min。
MRS培养基:蛋白胨10 g、牛肉膏5 g、酵母膏5 g、K2HPO42 g、柠檬酸铵2g、乙酸钠5g、葡萄糖 20g、吐温805mL、MnSO40.25 g、MgSO40.58 g、蒸馏水1000 mL,pH 7.0,115℃灭菌 30 min。
1.1.5 仪器设备
凯氏定氮仪,上海沛欧分析仪器有限公司;HC-2518高速离心机,安徽中科中佳科学仪器有限公司;752紫外可见分光光度计,上海浦东物理光学仪器厂。
1.2 试验方法
1.2.1 菌株活化
将冻藏菌种接种于50 mL液体完全培养基上,室温培养。乳酸菌:MRS培养基,37℃,静置培养24h;枯草芽孢杆菌:牛肉膏蛋白胨培养基上培养,37℃,160 r/min振荡培养24 h;酵母菌:LB培养基,30℃,120 r/min振荡培养48 h。
1.2.2 发酵种子液的制备
取活化的菌液,以2%的接种量分别接到各菌的完全培养基中,以室温培养制成发酵种子液。
1.2.3 固态发酵
将芝麻粕、玉米浆、菌液及水,搅拌均匀后,装入密封袋,排出空气并封口。28℃培养,发酵7、14 d分别取样,65℃烘干粉碎,测定样品的植酸、酸溶蛋白、粗蛋白、挥发性盐基氮含量。
1.2.4 不同菌种对芝麻粕发酵效果的影响
按照1.2.3的方法进行单因素试验。将R-01、R-02、J-05、J-6、J-8、J-10、J-11 七株菌,按料水比为1∶1.2(g∶mL)分别进行单菌固态发酵,培养基成分均为芝麻粕96%、玉米浆10%、菌液6%、水108%(总计220%)。
1.2.5 不同料水比对芝麻粕发酵效果的影响
将单菌试验中筛选出的R-02与好氧枯草芽孢杆菌KG-109混合发酵,按表1中培养基成分进行发酵。挑选对植酸降解率最高的料水比进行以后的混菌发酵试验。

表1 料水比试验培养基成分表
1.2.6 不同菌种组合对芝麻粕发酵效果的影响
在已选出的单菌基础上,根据乳酸菌、酵母菌和枯草芽孢杆菌需氧不同的特点,好氧菌可以消耗发酵培养基中的氧气,为后期发酵提供厌氧环境,故将好氧型枯草芽孢杆菌分别与厌氧型乳酸菌、兼性厌氧型酵母菌搭配,分为(R-02+KG-109)、(J-11+KG-109)两个组合,按料水比(g∶mL)为1∶0.8、菌液比例为1∶1进行发酵试验,培养基成分为芝麻粕96%、玉米浆10%、菌液6%、水68%(总计180%)。筛选降解植酸最优的一个组合菌。
1.2.7 芝麻粕发酵条件正交优化
对所筛选的菌株组合进行条件优化,根据单因素试验结果,确定料水比为1∶0.8(g∶mL)。采用 L9(34)正交试验设计对芝麻粕厌氧发酵的发酵条件温度、接种比例、接种量以及发酵时间进行优化,正交试验因素水平见表2。以降低芝麻粕的植酸含量为目标确定厌氧发酵条件的最佳组合,同时测定各处理组合的粗蛋白、酸溶蛋白以及挥发性盐基氮含量。

表2 厌氧发酵试验正交设计的因素水平表
1.3 指标测定方法
植酸的测定方法为TCA法[11],粗蛋白的测定方法为凯氏定氮法,酸溶蛋白的测定方法为三氯乙酸法[12],挥发性盐基氮的测定方法为半微量定氮法[13]。
1.4 数据统计与分析
试验数据以X±SD表示,采用SAS9.0软件中的glm和anova语句进行方差分析,并用邓肯新复极差法进行显著性多重比较。
2 结果与讨论
2.1 不同菌种对芝麻粕发酵效果的影响
在选择的菌种中,以植酸降解效果为主要目标,并考虑其降解大分子蛋白为酸溶性蛋白的能力,结合发酵后粗蛋白含量和挥发性盐基氮含量,筛选出能够较好降解芝麻粕中植酸的单株菌以进行下步试验。
由表3可知,J-11发酵样的植酸含量最低,降解率达到53.14%,显著优于其他6株菌(P<0.05);菌株在生长稳定期产生的植酸酶最多,降解效果明显,随着菌株的衰亡,植酸酶产量降低,植酸降解速度也会减缓,所以发酵14 d样与7 d样差别不显著,这与Roopesh等人[14]研究菌发酵条件优化的结果一致,可能是菌体生长阶段不产植酸酶。这一结果表明,单菌发酵7 d就可以达到其降解植酸的最大效果。
粗蛋白含量变化结果表明,R-01和R-02两株乳酸菌较优,发酵后粗蛋白含量均高于发酵前芝麻粕的粗蛋白含量。固态厌氧发酵时其物质是守恒的[15],随着发酵的进行,培养基中的物质被微生物分解,部分转化为气态(实验时厌氧发酵袋有胀气现象),由于总基数减少,造成粗蛋白含量升高[16]。能量消耗的快速阶段主要在发酵的最初7d,以后趋于稳定,因此R-01和R-02单菌发酵7d即可达到较高的粗蛋白水平。酸溶蛋白含量也是R-01和R-02两株乳酸菌较优,可能是由于乳酸菌能够分泌较多的蛋白酶,将大分子蛋白质分解为小分子多肽和氨基酸。而挥发性盐基氮产量则是J-06和 J-11两株酵母菌较低,可能是由于这两株菌分泌的蛋白酶较少,蛋白质被分解产生氨及胺类物质较少[17]。但各菌14天的挥发性盐基氮产量均高于7天(P<0.05),表明随着时间的延长,微生物分解蛋白质活动延长,挥发性盐基氮含量增加。
R-01与R-02两菌发酵的植酸含量、粗蛋白含量、酸溶蛋白含量和挥发性盐基氮含量指标差异均不显著(P>0.05),但在相同的培养条件下R-01种子液培养时间比R-02长;因此,综合考虑,选取植酸和挥发性盐基氮含量最低的J-11以及粗蛋白和酸溶蛋白含量最高的R-02进行下步混菌试验。
R-01与R-02两菌发酵的植酸含量、粗蛋白含量、酸溶蛋白含量和挥发性盐基氮含量指标差异均不显著,但在相同的培养条件下R-01种子液培养时间比R-02长;因此,综合考虑,选取J-11和R-02进行下步混菌试验。
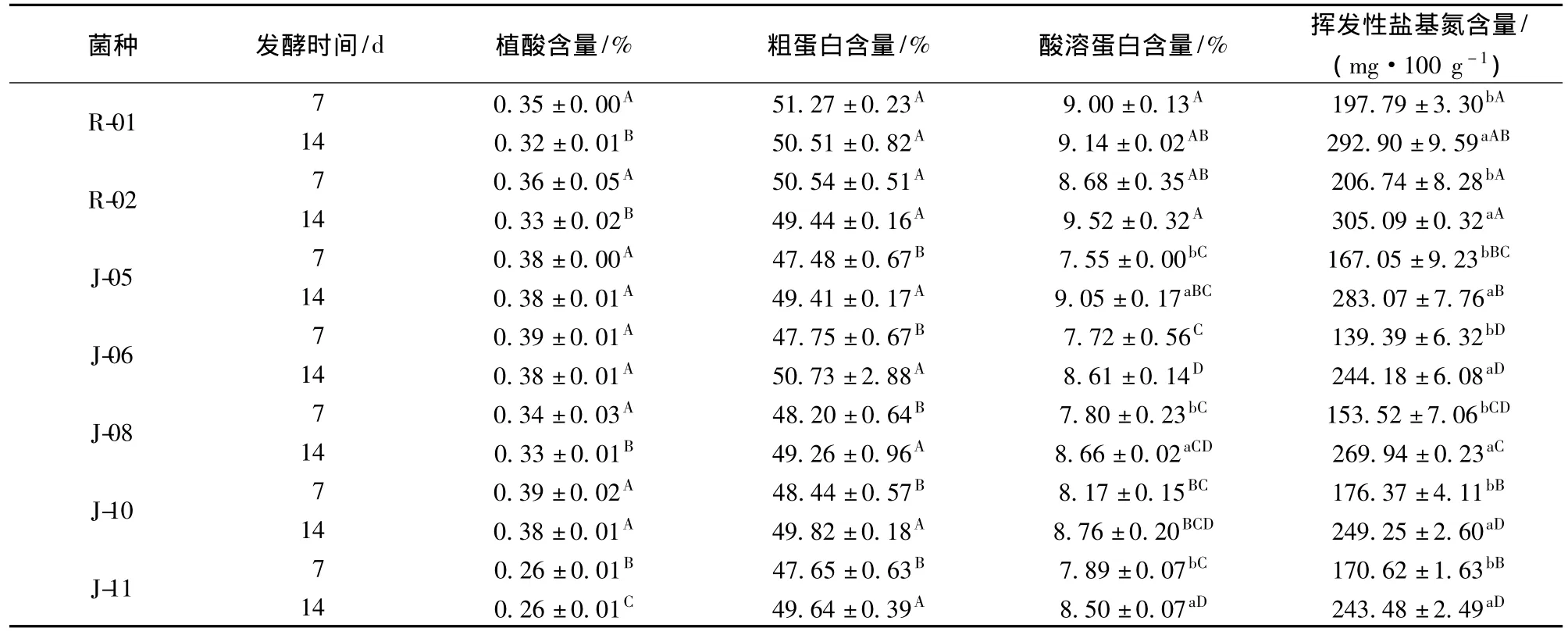
表3 不同菌株对发酵结果的影响
2.2 不同料水比对芝麻粕发酵效果的影响
固态厌氧发酵中水分对发酵效果影响很大[18],水分含量高会使基质的松散程度及含氧量降低,有利于厌氧菌的生长,对好氧菌不利,水分含量过高对饲料后期生产工艺会造成极大的影响。不同料水比试验结果如表4所示。可见,发酵7 d时料水比(g∶mL)1∶0.8、1∶1 植酸含量较低,说明水含量过多,会影响微生物分解植酸[19]。料水比为1∶0.6时植酸含量与料水比1∶0.8、1∶1 差异不显著(P >0.05),但由于水含量较低,氧气充足,造成霉菌等杂菌在发酵培养基中生长,影响发酵芝麻粕的饲用品质,因此,水分含量也不宜过低。
发酵7d料水比1∶1、1∶1.2粗蛋白含量较高;发酵14 d 料水比1∶0.6、1∶1、1∶1.2 较优,可能是水分含量高有助于厌氧菌R-02的快速生长,消耗较多的营养物质,而水分较低时氧气含量较高,好氧菌KG-109先消耗掉大部分氧气后,厌氧菌才能大量生长,消耗较多的营养物质。料水比1∶1的酸溶蛋白含量均较高,可能是料水比1∶1时微生物产蛋白酶的量较多;料水比1∶0.6、1∶0.8时的挥发性盐基氮含量显著低于其他组,但水分过低霉菌等杂菌易生长,故料水比1∶0.8在实际试验中优于料水比1∶0.6;随着发酵时间延长,微生物生长,蛋白酶增多,发酵14 d的挥发性盐基氮含量显著优于7 d,因此料水比1∶0.8时发酵7 d可以有效降低挥发性盐基氮含量。
料水比1∶1条件下发酵后样品中粗蛋白和酸溶蛋白含量较高,但与料水比1∶0.8差异不显著(P>0.05),且料水比为1∶1时挥发先盐基氮含量显著高于料水比1∶0.8,能够被动物消化吸收的蛋白质含量不高;其次根据饲料加工工艺,含水量较低能够节约能源,故1∶0.8 优于1∶1,选取料水比1∶0.8 作为固态发酵的最优水平。
从发酵时间来看,欲取得较好的植酸降解效果和产生更多的酸溶蛋白,以14天为好,但挥发性盐基氮的量却是时间越长含量越高,也即蛋白质损失越多。这两方面是矛盾的,实际生产中有必要在两方面之间进行权衡。
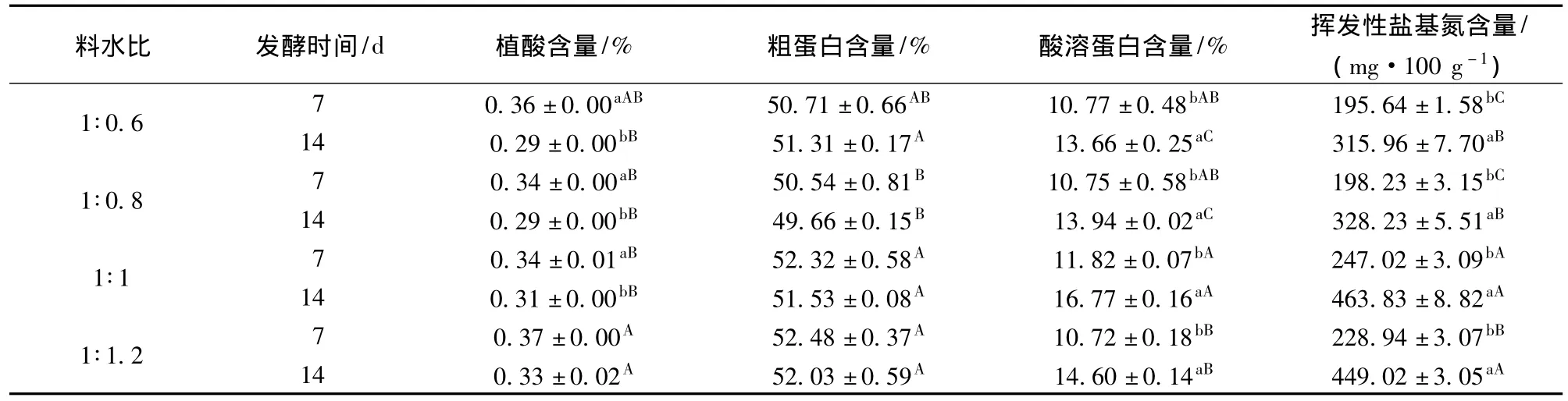
表4 料水比对发酵结果的影响
2.3 不同菌种组合对芝麻粕发酵效果的影响
不同菌株混菌试验结果如表5所示。从植酸含量看,发酵7d时J-11与KG-109混菌发酵较优,植酸降解率达到84.98%,但到发酵14d时两组合植酸含量差异不显著,表明J-11与KG-109组合前期降解植酸速度较快,后期较慢,而R-02与KG109组合正好相反,但14天内的植酸降解效率两者相当。可能是J-11为兼性厌氧菌在发酵初期含少量氧气状态下已经开始大量生长,R-02为厌氧菌在KG-109将氧气耗尽后才能开始大量生长,故发酵前7d时 J-11与KG109混菌发酵植酸降解效果较好,而7天后的环境可能更适合R-02产生植酸酶。但从发酵工艺方面考虑,J-11的种子液培养需要3d,R-02种子液培养仅需1d,R-02能缩短整个发酵工艺的时间,在大规模发酵生产中能较好地发挥优势。故选取R-02与KG109混菌进行正交优化试验。
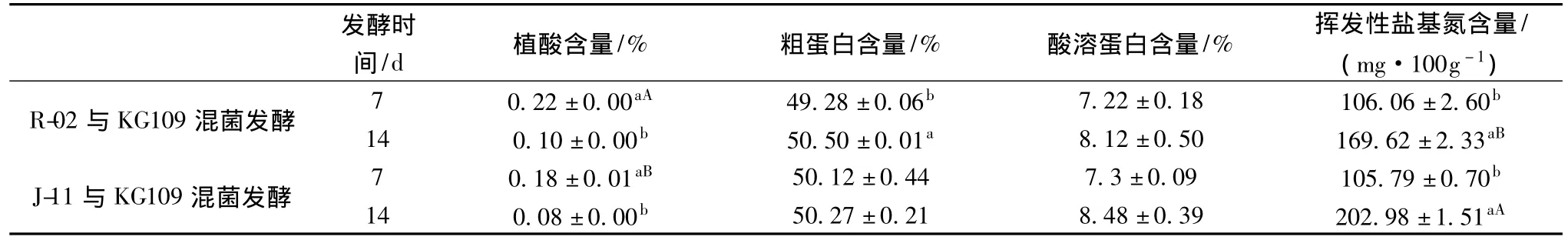
表5 不同菌株混菌发酵对发酵结果的影响
2.4 芝麻粕发酵条件正交优化
正交试验设计及统计结果见表6,由表可知,4个因素对植酸含量的影响顺序为:D>C>A>B,即对植酸含量影响最大的因素是发酵时间,接种量影响次之,温度和接种比例影响最小,确定最佳水平为A2B3C2D3,即温度30℃、R-02与 KG-109接种比例1∶2、接种量8%、时间10 d。经验证试验,此时植酸含量最低为0.07%,降解率达到87.60%。
4个因素对粗蛋白含量的影响顺序为:C>B>D>A,即对植酸含量影响最大的因素是接种量,接种比例和发酵时间影响次之,温度对粗蛋白含量影响最小,较优水平:A2B3C2D1温度30℃、R-02与 KG-109接种比例1∶2、接种量8%、时间5 d。经验证试验,此时粗蛋白含量达到48.45%。
4个因素对酸溶蛋白含量的影响顺序为:C>A>B>D,即对植酸含量影响最大的是接种量,温度、接种比例和发酵时间影响较小,较优水平:A1B1C3D3温度28℃、R-02与 KG-109接种比例2∶1、接种量10%、时间10 d。经验证试验,此时酸溶蛋白含量最高达到9.25%。
4个因素对挥发性盐基氮含量的影响顺序为:A>D>C>B,即对植酸含量影响最大的因素是温度,发酵时间影响次之,接种量和接种比例影响最小,较优水平:A1B1C1D1温度28℃、R-02与KG-109接种比例2∶1、接种量6%、时间5 d。此时挥发性盐基氮含量最低为110.73 mg/100 g。

表6 正交试验设计及统计结果
由表7正交试验方差分析结果可知,接种量、时间对植酸含量影响达到了极显著水平(P<0.01),温度对植酸含量影响达到了显著水平(P<0.05),R-02与KG-109接种比例对植酸含量影响不显著(P>0.05);表明接种量和时间是影响植酸降解的最主要因素,温度对植酸降解影响次之,R-02与KG-109接种比例对植酸降解几乎没有影响。在发酵过程中,接种量大,初始菌数较多,达到稳定期后总菌数也较多,其产生的植酸酶量也较多,植酸降解效果就显著提高[20]。微生物达到稳定期后才大量产植酸酶,所以在一定范围内时间越长,微生物产的植酸酶越多,植酸降解效果越显著。
接种量对粗蛋白含量影响达到了显著水平(P<0.05),温度、R-02与KG-109接种比例、时间对粗蛋白含量影响不显著(P>0.05);表明接种量是影响粗蛋白降解的最主要因素,温度、R-02与KG-109接种比例、时间对粗蛋白降解影响较小。由于在发酵样品测定时,芝麻粕中的粗蛋白和菌体蛋白测定的总值为样品的粗蛋白含量,故接种量越高,菌体蛋白含量越高,样品中粗蛋白含量也显著提高。
温度、R-02与KG-109接种比例、接种量、时间对酸溶蛋白含量影响不显著(P>0.05);表明温度、R-02与KG-109接种比例、接种量、时间对植酸降解影响较小。
温度、接种量、时间对挥发性盐基氮含量影响达到了极显著水平(P<0.01),R-02与KG-109接种比例对植酸含量影响达到了显著水平(P<0.05);表明温度、接种量、时间是影响植酸降解的最主要因素,R-02与KG-109接种比例对植酸降解影响次之。随着温度、接种量的提高微生物分解能力提高,随着时间延长,微生物不断的分裂生长继续将有机氮分解为无机氮,挥发性盐基氮含量显著提高。
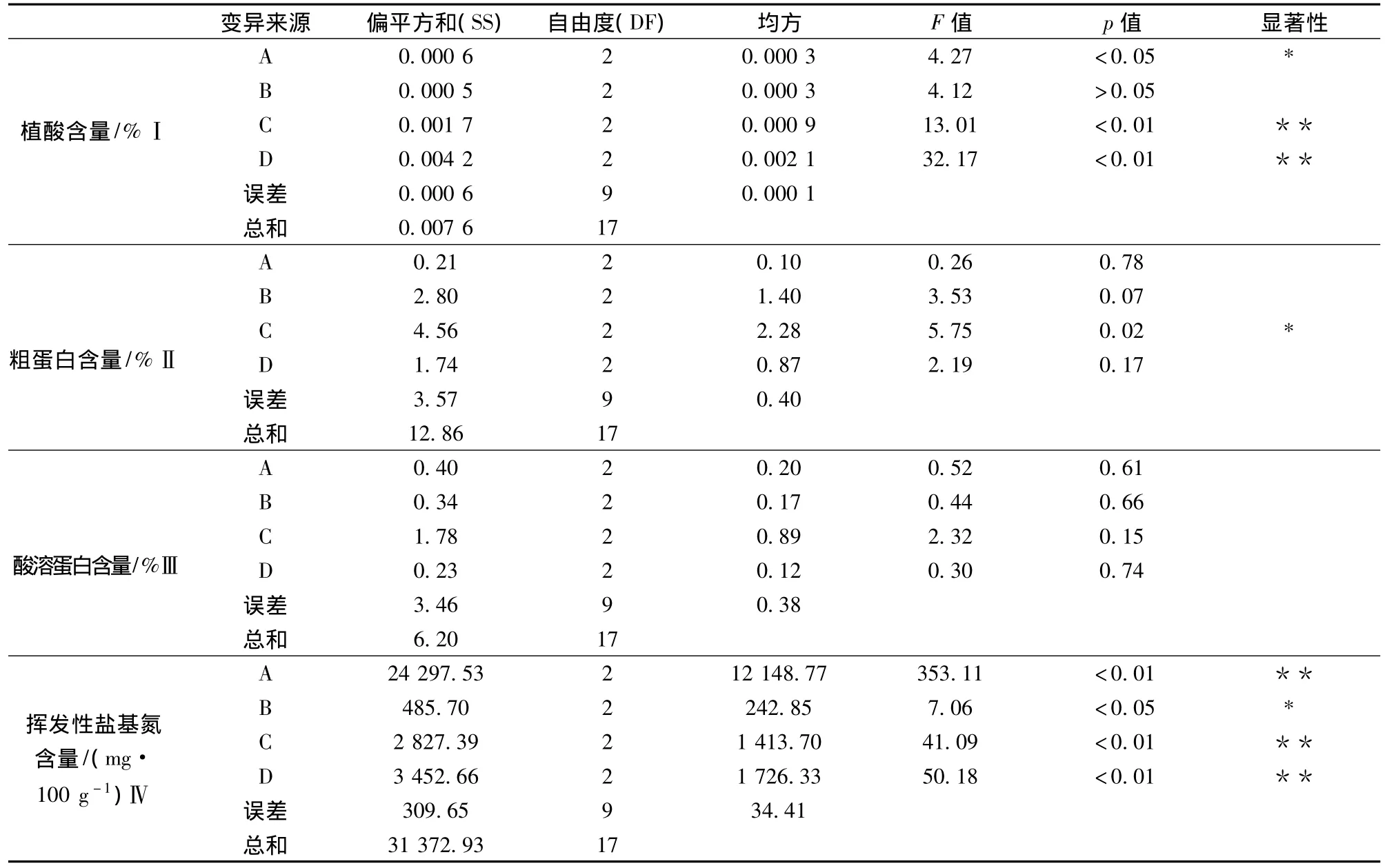
表7 正交实验方差分析结果
最优水平选定,以植酸为主要指标,其较优水平是温度30℃、R-02与KG-109接种比例1∶2、接种量8%、时间10 d;但由表6可知,R-02与KG-109接种比例对植酸含量影响不显著(P>0.05),结合粗蛋白、酸溶蛋白和挥发性盐基氮的结果,R-02与KG-109接种比例为2∶1时酸溶蛋白含量较高、挥发性盐基氮含量较低。故确定最优水平为温度30℃、R-02与KG-109接种比例2∶1、接种量8%、时间10 d。这与试验4组的试验条件一致,在此条件下发酵后植酸含量为0.08%、粗蛋白含量为49.85%、酸溶蛋白为9.07%、挥发性盐基氮为207.55 mg/100 g。
3 结论
R-02与KG-109混菌发酵芝麻粕优于单菌发酵。在温度30℃、R-02与KG-109接种比例2∶1、接种量8%条件下,厌氧发酵10 d,植酸含量可降至0.08%,降解率达到86.21%。同时可提高粗蛋白和酸溶蛋白含量。
[1]Lott J N A,Oekenden I,Raboy,V,et al.Phytic acid and phosphorus in crop seeds and fruits:a global estimate[J].Seed Seience Researeh,2000(10):11-33.
[2]Mukhopadhyay N,Bandyopadhyay S.Extrusion cooking technology employed to reduce the anti-nutritional factor tannin in sesame(Sesamum indicum)meal[J].Journal of Food Engineering,2003,56(2-3):201-202.
[3]Siy R D,Talbot D F.Prearation of low-phytate rapeseed protein by ultrafiltration:I.the aqueous extraction of phytate from deoiled rapeseed meals[J].Journal of the A-merican Oil Chemists’Society,1982,59(4):191-194.
[4]Newkirk R W,Classen H L.In vitro hydrolysis of phytate in canola meal with purified and crude sources of phytase[J].Anim Feed Sci Tech,1998,72(3/4):315-327.
[5]Lanari D,Agaro E D,Turri C.Use of nonlinear regression to evaluate the effects of phytase enzyme treatment of plant protein diets for rainbow trout(Oncorhychus mykiss)[J].Aquaculture,1998,161(1-4):345-356.
[6]Ouoba L I,Rechinger K B,Barkholt V,et al.Degradation of proteins during the fermentation of African locust bean by strains of Bacillus subtilis and Bacillus pumilus for pro-duction of soumbala[J].J Appl Microbiol,2003,94(3):396-402.
[7]Ramachandran S,Roopesh K,Nampoothin K M.et al.Mixed substrate fermentation for the production of phytase by Rhizopus spp.Using oilcakes as substrates[J].Process Biochemistry,2005,40(5):1749-1754.
[8]Singh B,Satyanarayana T.Phytase production by thermophilic mold Sporotrichum thermophile in solid-state fermentation and its application in dephytinization of sesame oil cake [J].Applied Biochemistry and Biotechnology,2006,133(3):239-250.
[9]Soares V F,Castilho L R,Bon E P S,et al.High-yield Bacillus subtilis protease production by solid-state fermentation[J].Applied Biochemistry and Biotechnology,2005,121:311-319.
[10]Hu J,Duvnjak Z.The production of a laccase and the decrease of the phenolic content in canola meal during the growth of the fungus Pleurotus ostreatus in solid state fermentation processes[J].Eng Life Sci,2004,4(1):50-55.
[11]Haug W,Lantzsch H J.Sensitive method for the rapid determination of phytate in cereals and cereal products[J].Journal of the Science of Food and Agriculture.1983,34(12):1423–1426.
[12]Fritsch R J,Martens F,Belitz D.Monitoring Cheddar cheese ripening by chemical indices of proteolysis[J].Z Lebensm Unters Forsch,1992,194(4):330-336.
[13]Chan S T,Yao M W Y,Wong Y C,et al.Evaluation of chemical indicators for monitoring freshness of food and determination of volatile amines in fish by headspace solid-phase microextraction and gas chromatography-mass spectrometry[J].European Food Research and Technology,2006,224(1):67-74.
[14]Roopesh K,Ramachandran S,Nampoothiri K M,et al.Comparison of phytase production on wheat bran and oilcakes in solid-state fermentation by Mucor racemosus[J].Bioresource Technology,2006,97(3):506-511.
[15]Rozan P,C Villaume,M H Bau,et al.Detoxification of rapeseed meal by Rhizopus oligosorus sp.T3:a first step towards rapeseed protein concentrate[J].Ind J Food Sci Technol,1996,31:85-90.
[16]Vig A P,d A Walia.Beneficial effects of Rhizopus oligosorus fermentation on reduction of glucosinolates,fibre and phytic acid in rapeseed(Brassica napus)meal[J].Bioresour Technol,2001,78:309-312.
[17]Heribert Insam,Martin S A Seewald.Volatile organic compounds(VOCs)in soils[J].Biology and Fertility of Soils,2009,46(3):199-213
[18]Patrick Gervais.Water relations in solid-state fermentation[J].Current Developments in Solid-state Fermentation,2008(1):74-116.
[19]Lamberchts C,Boze H,Moulin G,et al.Utilization of phytate by some yeasts[J].Biotechnology Letters,1992,14(1):61-66.
[20]Gautam P,Sabu A,Pandey A,et al.Microbial production of extra-cellular phytase using polystyrene as inert solid support[J].Bioresour Technol,2002,83(3):229-233.
ABSTRACTSingle factor and orthogonal experiment was used to optimize the fermentation condition to reduce the phytase content and increase the beneficial content such as crude protein and acid insoluble protein in the sesame meal.Sesame meal was used as raw materials to ferment with Bacillus Subtilis,Lactobacillus,and Saccharomycetes.The conditions for single factor experiment were as follows:the ratio of material to water was 1∶0.8(g∶mL),the additive amount of phytase was 0.20%,bacteria R-02 and KG-109 was mixed fermented.And the optimal fermentation conditions obtained via orthogonal test were as follows:the temperature was 30℃,the inoculation proportion of R-02 to KG-109 was 2∶1,the inoculation percentage was 8%and the fermentation time was 10 day.Under these fermentation conditions,the content and degradation rate of phytic acid were 0.08%and 86.21%,respectively.The content of crude protein,acid insoluble protein,and volatile basic nitrogen were 49.85%,9.07%and 207.55 mg/100g,respectively.
Key wordssesame meal,phytic acid,solid-state fermentation,optimize
Study on Strains Screening and Fermentation Conditions for Enhance Feed Quality of Sesame Meal
Peng Hui-hui1,Xu Ya-yuan2,Li Lv-mu1,3,Qian Kun4,Xu Fa-zhi3,Wu Dong4,Zhou Fen4,Ding Xiao-ling3
1(College of Tea & Food Science and Technology,Anhui Agricultural University,Hefei 230036,China)
2(College of Life Science ,Anhui Agricultural University,Hefei 230036,China)
3(College of Animal Science and Technology,Anhui Agricultural University,Hefei 230036,China)
4(Anhui Animal Biological Engineering Technology Research Center,Hefei 230031,China)
硕士研究生(李吕木研究员为通讯作者:llm56@ahau.edu.cn)
*安徽省长三角联合科技攻关项目(10140702021);安徽省现代农业(肉禽)项目(2011)
2012-01-26,改回日期:2012-02-22

