肿瘤坏死因子-β对重型再生障碍性贫血患者效应T细胞损伤骨髓造血的影响①
刘 晓 付 蓉 王 珺 王化泉 刘春燕 阮二宝 瞿 文 梁 勇 王国锦 王晓明 刘 鸿 吴玉红宋 嘉 邢莉民 关 晶 李丽娟 邵宗鸿 (天津医科大学总医院血液肿瘤科,天津300052)
获得性重型再生障碍性贫血(SAA)是一组以贫血、感染、出血为临床表现的重度骨髓衰竭性疾病,其发病与CD8+T淋巴细胞功能亢进导致骨髓造血细胞过度凋亡有关[1]。我们既往研究发现,SAA患者Ⅰ型淋巴因子白细胞介素(IL)-2、干扰素(IFN)-γ水平增高,CD8+T细胞比例增加、功能亢进,胞浆内产生肿瘤坏死因子(TNF)增加,血浆中TNF水平增高,且SAA患者外周血活化的细胞毒性T淋巴细胞(CTL)亚群之一CD8+HLA-DR+T细胞比例明显增高,在SAA的免疫发病机制中发挥重要作用[2]。本研究拟体外混合培养SAA患者CD8+HLA-DR+T细胞(效应细胞)与正常人去除CD3+T细胞后的骨髓单个核细胞(BMMNC)(靶细胞),并于培养体系中加入不同浓度TNF-β,通过检测靶细胞凋亡程度说明TNF-β对CD8+HLA-DR+T细胞损伤骨髓造血细胞的影响;同时检测培养上清中IFN-γ、IL-10水平,观察TNF-β对CD8+HLA-DR+T细胞分泌细胞因子的作用。
1 对象与方法
1.1 研究对象 病例为我科2011年2月至2011年7月收治的初诊SAA患者15例,男8例,女7例,中位年龄23(6~46)岁,诊断符合《血液病诊断及疗效标准》中SAA的诊断标准[3]。正常对照15名,均为正常健康人,男9名,女6名,中位年龄26(24~32)岁。研究方案已通过天津医科大学伦理委员会批准,所有研究对象均已签署知情同意书。
1.2 主要试剂与仪器 鼠抗人CD8、鼠抗人HLADR、鼠抗人CD3单克隆抗体及磁珠分选仪均为德国Miltenyi Biotec公司产品;鼠抗人PE-CD8、鼠抗人FITC-HLA-DR、鼠抗人 PE-IgG1、鼠抗人 FITC-IgG1单克隆抗体均为美国BD PharMingen公司产品;FITC标记的细胞膜联蛋白(Annexin V&PI)细胞早期凋亡检测试剂盒为美国BD公司产品;IFN-γ、IL-10酶联免疫吸附试验(ELISA)检测试剂盒为美国RB公司上海分装产品;流式细胞仪为美国BD公司的BD FACSAria。
1.3 实验方法
1.3.1 细胞分选 用含肝素的试管取患者及正常成人骨髓10 ml,PBS 2倍稀释,以淋巴细胞分离液(比重1.077)密度梯度法分离BMMNC。
计数细胞,患者BMMNC约每1×107个细胞中加人20 μl CD8磁珠抗体,4℃孵育15分钟后,洗涤2次,磁性条件下过柱,脱离磁场,充分冲洗柱子,收集细胞。每1×107个细胞加入20 μl CD8解离抗体进行解离,5 μl终止抗体终止解离后,加入 20 μl HLA-DR抗体,4℃孵育15分钟,洗涤2次,磁性条件下过柱后,脱离磁场,充分冲洗柱子,收集细胞。正常成人BMMNC约每1×107个细胞中加人20 μl CD3磁珠抗体,4℃孵育15分钟后,洗涤2次,磁性条件下过柱,收集阴性细胞。
流式细胞仪检测分选细胞纯度。实验管加入上述分选所得细胞1×105、鼠抗人FITC-HLA-DR、PECD8各10 μl。对照管加入上述分选所得细胞1×105及相应同型对照各10 μl。4℃避光孵育20分钟,PBS洗涤2次,上机。
1.3.2 细胞培养 将上述分选所得 SAA患者CD8+HLA-DR+T细胞(效应T细胞)和正常人去除CD3+细胞的BMMNC(靶细胞)平均分成4份,以5×105ml-1细胞浓度置于24孔板中(CD8+HLADR+T细胞与靶细胞比例为1∶1),实验组中加入TNF-β,使其终浓度分别为 15、25、50 ng/ml,每孔中加入12%灭活的小牛血清,用完全RPMI1640调整细胞悬液至每孔2 ml,置于37℃,5%CO2温箱中培养72小时。
1.3.3 细胞凋亡和细胞因子检测 应用Annexin V&PI双标法标记细胞,流式细胞仪检测细胞凋亡率。应用ELISA试剂盒分别检测培养体系上清中IFN-γ、IL-10表达水平。
1.4 统计学处理 采用SPSS13.0统计软件进行分析,对符合正态分布且方差齐性的计量资料,用x±s表示,两组间比较采用配对t检验,以P<0.05为有统计学意义。
2 结果
2.1 流式细胞仪检测分选细胞 SAA患者效应细胞CD8+HLA-DR+细胞纯度均在90%以上,正常对照测定CD3-靶细胞比例在90%以上(图1)。
2.2 Annexin V&PI检测靶细胞凋亡率 流式细胞仪Annexin V&PI双染法检测靶细胞的凋亡情况(见图2)。左下象限(An-,PI-)代表正常活细胞;右下象限(An+,PI-)代表早期凋亡细胞;右上象限(An+,PI+)代表坏死细胞和晚期细胞凋亡;左上象限(An-,PI+)代表收集过程中出现的损伤细胞。从表1可见,15 ng/ml组凋亡率与空白组比较差异无统计学意义(P>0.05);25 ng/ml组凋亡率高于空白组和15 ng/ml组(P均小于0.05);50 ng/ml组凋亡率显著高于空白组(P<0.01)和15 ng/ml(P <0.05);但是 50 ng/ml组与 25 ng/ml组比较差异无统计学意义(P>0.05)。

图1 流式细胞仪检测分选细胞Fig.1 Purity of cells by MACS
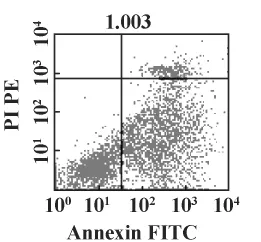
图2 流式细胞术检测细胞凋亡率Fig.2 Apoptotic rate measured by flow cytometry

表1 各组培养体系靶细胞凋亡率Tab.1 Apoptotic rate(AR)of each group
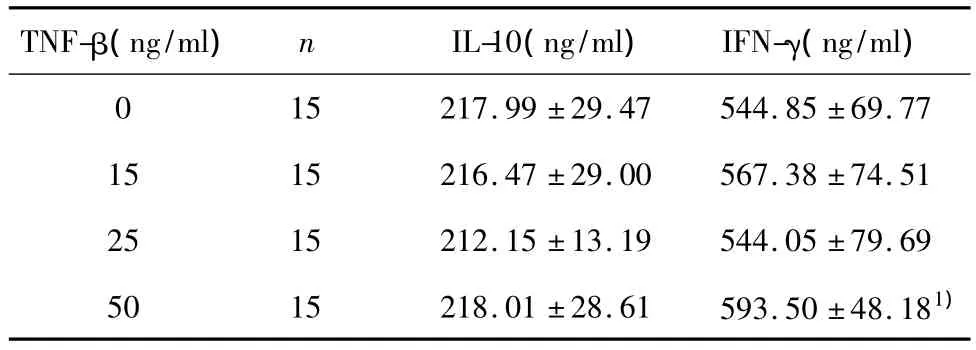
表2 培养体系上清中IFN-γ、IL-10浓度Tab.2 The levels of IFN-γ and IL-10 in culture supernatant of each group
2.3 ELISA法检测培养体系上清中IL-10、IFN-γ水平 IL-10水平各组间无显著差异(P>0.05);50 ng/ml组上清中IFN-γ水平高于空白组(P<0.05),而15 ng/ml组和25 ng/ml组与空白组比较无差异(P >0.05),如表2。
3 讨论
SAA是以骨髓造血功能衰竭和高病死率为特征的血液系统重症。近年来研究发现SAA患者的髓样树突细胞(mDC,DC1)数量增多,Th1/Th2细胞比例失衡,Th1细胞功能亢进,表现为CD4+T细胞比例增高、CD4+IFN-γ+细胞、CD4+IL-2+细胞比例增高,具有保护作用的NK细胞比例下降、造血负调控因子IFN-γ、IL-2等分泌增高、CTL比例增高,抗T细胞球蛋白(ATG/ALG)联合环孢菌素(CsA)的强化免疫抑制治疗(IST)可使近70%的患者达到完全缓解,进一步证实了SAA患者存在免疫激活及免疫耐受机制的异常,导致造血细胞过度凋亡,进而引起自身免疫性骨髓衰竭[4-9]。
CD8+HLA-DR+T细胞是活化的效应T细胞亚群之一,在T细胞介导的自身免疫性疾病(AID)如多发性硬化症(MS)、实验性自身免疫性脑脊髓膜炎(EAE)以及AIDS患者中比例升高,在HIV感染的患儿中比例明显降低[10,11]。既往我们研究显示,在SAA患者中CD8+HLA-DR+T细胞比例明显增高,并随患者病情缓解呈逐步下降趋势,可能是导致SAA骨髓衰竭的主要效应T细胞[2]。
TNF-β是由T淋巴细胞在抗原刺激下产生的淋巴因子,广泛参与炎症反应、细胞毒作用及免疫系统调节[12]。TNF分子激活后可引起受体寡聚从而增加与配体结合时的亲和力,在Fas分子相关蛋白(Fas-associated death dormain,FADD)分子的作用下,TNF与TNFR相互作用后,TNFR通过多聚化反应激活caspase级联反应,并可引起线粒体膜的改变,从而引发细胞凋亡。目前国内外关于TNF-α的研究较多,但缺乏TNF-β的相关报道。本研究发现TNF-β能增强SAA患者效应T细胞凋亡骨髓造血细胞的作用,并且呈浓度依赖性,但在较高浓度时其凋亡细胞作用并不随浓度增大而增高,在25 ng/ml与50 ng/ml间其凋亡细胞作用进入平台期,提示TNF-β也是CTL损伤骨髓造血靶细胞的重要途径之一。但该两组与空白对照组比较虽有统计学意义,然实际数值差别不大,或是体内TNF-β“温和”的发挥造血损伤作用的实际反应,该结论有待进一步研究证实。
INF-γ属Th1型细胞因子,通过激活单核细胞、淋巴细胞和自然杀伤(NK)细胞而调节免疫反应。Gidvani等[13]检测了与AID有关的细胞因子的单核苷酸多态性(SNP),如 IL-6、IL-10、TNF-α、IFN-γ 和TGF-β1,发现 SAA患者均存在这些细胞因子的SNP,特别是IFN-γ和TNF-α,高度提示与SAA的发病有关。CTL一般通过三种方式杀伤靶细胞:细胞因子(TNF、IFN-γ)途径;穿孔素、颗粒酶 B途径;Fas-FasL途径[14]。本实验发现伴随 TNF-β 浓度增加细胞凋亡率增高,培养体系上清中IFN-γ浓度无相应变化,仅于50 ng/ml组有明显增加,说明高浓度的 TNF-β可促进 CD8+HLA-DR+T细胞分泌IFN-γ。
IL-10又称细胞因子生成抑制因子,淋巴细胞(包括CD4+和CD8+T淋巴细胞)、单核细胞、巨噬细胞等髓系细胞是其主要来源,具有强大的免疫抑制及免疫调控作用,在调节肿瘤免疫、炎症反应及自身免疫反应中具有多重作用。IL-10可以强化、延长体外激活的CTL的抗肿瘤作用,抑制并逆转T细胞的凋亡过程[15-17]。本实验显示,不同浓度TNF-β刺激下的CTL分泌IL-10水平无显著差异,提示IL-10对CTL的正反馈作用在CTL杀伤靶细胞的过程中并非重要机制。
综上所述,TNF-β在SAA患者CD8+HLA-DR+T细胞杀伤骨髓造血细胞过程中起重要作用,不仅是效应T细胞损伤靶细胞重要方式之一,并可通过加强效应T细胞分泌造血抑制性因子IFN-γ起正反馈调控作用。
1 Young N S,Bacigalupo A,Marsh J C.Aplastic anemia:pathophysiology and treatment[J].Biol Blood Marrow Transplant,2010;16:S119-125.
2 冯 乐,邵宗鸿,付 蓉 et al.重型再生障碍性贫血患者CD8+效应T细胞损伤骨髓造血途径的研究[J].中华血液学杂志,2011;32(9):595-599.
3 张之南,沈 悌.血液病诊断及疗效标准[M].第3版.北京:科学出版社,2007:19-23.
4 邵宗鸿.再生障碍性贫血的研究[J].基础医学与临床,2007;27(3):233-237.
5 Zonghong Shao,Meifeng T,Huaquan W et al.Circulating myeloid dendritic cells are increased in individuals with severe aplastic anemia[J].Int J Hematol,2011;93:156-162.
6 Solomou E E,Keyvanfar K,Young N S.T-bet,a Th1 transcription factor,is up-regulated in T cells from patients with aplastic anemia[J].Blood,2006;107:3983-3991.
7 何广胜,邵宗鸿,和 虹et al.重型再生障碍性贫血患者骨髓中辅助性T细胞亚群数量及功能的变化[J].中华血液学杂志,2004;25(10):613-618.
8 李智赏,邵宗鸿,付 蓉et al.重型再生障碍性贫血患者外周血自然杀伤细胞亚群百分比及功能变化[J].中华医学杂志,2011;91(16):1084-1087.
9 Passweg J R,Marsh J C.Aplastic anemia:first-line treatment by immunosuppression and sibling marrow transplantation[J].Hematology Am Soc Hematol Educ Program,2010;1:36-42.
10 Mekmullica J,Brouwers P,Charurat M et al.Early immunological predictors of neurodevelopmental outcomes in HIV-infected children[J].Clin Infect Dis,2009;48:338-346.
11 Viallard J F,Blanco P,André M et al.CD8+HLA-DR+T lymphocytes are increased in common variable immunodeficiency patients with impaired memory B-cell differentiation [J].Clin Immunol,2006;119:51-58.
12 Takaoka Y,Abe Y,Haraguchi R et al.Lymphotoxin(TNF-beta)[J].Nihon Rinsho,2010;68:93-95.
13 Gidvani V,Ramkissoon S,Sloand E M et al.Cytokine gene polymorphisms in acquired bone marrow failure [J].Am J Hematol,2007;82(8):721-724.
14 Keckler M S.Dodging the CTL response:viral evasion of Fas and granzyme induced apoptosis[J].Front Biosci,2007;12:725-732.
15 Fujii S,Shimizu K,Shimizu T et al.Interleukin-10 promotes the maintenance of antitumor CD8+T cell effector function in situ[J].Blood,2001;98:2143-2151.
16 Taga K,Mostowski H,Tosato G.Human interleukin-10 can directly inhibit T-cell growth[J].Blood,1993;81(11):2964-2971.
17 Cohen S B,Crawley J B,Kahan M C et al.Interleukin-10 rescues T cells from apoptotic cell death:association with an upregulation of Bcl-2[J].Immunology,1997;92:1-5.

