母亲过敏性哮喘病史对新生儿调节性T细胞的影响
刘 晶 张 捷 徐 伟 许溟宇 任 锦 闫冰迪 李成玉 马忠森
(吉林大学第二医院呼吸内科,长春130041)
近几年,过敏性哮喘的发病率越来越高,而母亲的过敏性哮喘病史是后代发生过敏性疾病的重要危险因素[1,2]。本研究系统地观察了母亲有过敏性哮喘病史的新生儿调节性T细胞数量和功能的状况,从而进一步明确探讨这些高风险儿童易患过敏性疾病的早期免疫失衡机制,为早期预防过敏性疾病的发生奠定基础。
1 对象与方法
1.1 对象 2005~2010年来自长春市的70例孕妇在产前被招募,经伦理委员会批准,并填写相应的调查表及同意书。在分娩过程中采集新生儿胎儿脐带血。采用前瞻性双盲对照研究方法。母亲有过敏性哮喘病史的新生儿为哮喘组,母亲为健康个体的为对照组。过敏性哮喘诊断按照2006年支气管哮喘的诊断指南,且皮肤试验阳性或血清过敏原特异性IgE阳性或有明确的过敏史。最后入选的过敏组为22例(除2例母亲分别在孕20~22周和孕28~32周应用小剂量吸入糖皮质激素外,其余母亲均处于哮喘控制阶段,未应用相应药物),对照组为40例。两组新生儿Apgar指数均正常,种族、胎龄、性别、身高、体重没有差别。母亲的年龄、分娩方式、吸烟人数比例和分娩及流产次数在两组之间也没有差别。排除标准为:母亲患有自身免疫性疾病,在怀孕期间应用影响免疫系统药物,分娩前1个月内有感染,应用抗生素,在分娩过程中出现异常,或新生儿不健康。
1.2 脐带血单个核细胞(Cord blood mononuclear cell,CBMC)的分离和培养条件 所有入组孕妇在分娩后,立即采集新生儿脐带静脉血20 ml,肝素抗凝,室温24小时内应用Ficoll梯度离心法分离CBMC。每例CBMC均同时分为5个刺激组(见表1)在6孔培养板上进行培养:
其中,LpA 为 TLR4(Toll like receptor 4,Toll样受体4)的配体,Ppg为 TLR2(Toll like receptor 2,Toll样受体2)的配体,以上试剂均为Sigma公司提供。细胞在37℃,5%CO2条件下在培养箱中培养3天后,收集细胞和上清液备用。
1.3 细胞因子检测 应用人类多细胞因子检测试剂盒 IL-10、IL-13、IFN-γ(Biorad 公司)在 Luminex检测仪(BioRad公司)上检测各种细胞因子浓度,单位为pg/ml。
1.4 流式细胞技术检测淋巴细胞中CD4+CD25+Foxp3+T细胞的百分率 细胞培养3天后,用5 ml RPMI洗涤,然后用RPMI配成1 ×107ml-1浓度的细胞悬液。加入抗人CD4-FITC抗体(10 μl/1×106细胞),抗人 CD25-PC5 抗体(10 μl/1 ×106细胞)(Beckman Coulter公司)在4℃避光孵育30分钟。然后按照Foxp3染色试剂盒(Natutec eBioscience公司)的说明书,应用Fixation/Permeabilization工作液使细胞固定和渗透性增强,然后加入抗人Foxp3-PE抗体(20 μl/L×106细胞)进行细胞内Foxp3染色。最后在流式细胞仪(BD Biosciences公司)上,检测CD4+CD25+Foxp3+T细胞在淋巴细胞中的百分率。应用CellQuest software分析软件分析结果。同型IgG对照抗体染色后阳性率均低于0.05。
1.5 CD4+CD25+T调节性细胞分离和功能检测分离胎儿脐带血中CBMC,然后应用CD3+T细胞和CD4+CD25+T细胞分离试剂盒(Miltenyi Biotec公司,德国)从CBMC中分别分离CD3-T细胞,CD4+CD25-T细胞和CD4+CD25+T细胞。以上分离细胞的纯度经流式检测均大于95%。应用5 μmol/L CFSE(CellTraceTMCFSE Cell Proliferation Kit invitrogen公司,德国)标记后的CD4+CD25-T细胞(2×104/孔)与放射去活化的CD3-T细胞(4×104/孔)和CD4+CD25+T细胞(2×104/孔)共同在 PHA(0.8 μg/ml)刺激下培养,与不加入 CD4+CD25+T细胞的对照组比较。培养3天后,收集上清,检测细胞因子浓度,方法同前。收集细胞在流式细胞仪上,检测CFSE荧光强度,计算新分裂的CD4+CD25-T效应细胞的百分率。抑制率=(不加CD4+CD25+T细胞组结果-加CD4+CD25+T细胞组结果)/不加CD4+CD25+T细胞组结果。

表1 各组培养条件Tab.1 Culture conditions of different stimuli
1.6 统计学处理 数据应用SigmaStat1.0软件分析。计量数据根据是否呈正态分布,分别采用t检验或Mann-Whitney秩和检验。
2 结果
2.1 哮喘组CD4+CD25+Foxp3+调节性T细胞数量在Ppg刺激后低于对照组 在无刺激时及PHA和LpA刺激后,哮喘组和对照组新生儿淋巴细胞中CD4+CD25+Foxp3+T细胞百分率无明显差别。但Ppg刺激后,哮喘组淋巴细胞中CD4+CD25+Foxp3+T细胞的百分率明显低于对照组(1.16±0.36 vs 1.76±0.36,t=1.86,P=0.03),见表 2,差异有统计学意义,说明母亲的过敏性哮喘病史使新生儿调节性T细胞在Ppg诱导的TLR2免疫反应途径上数量下调。

表2 CD4+CD 25+Foxp3+T细胞数量(%)Tab.2 The percentage of CD4+CD25+Foxp3+T cells in CBMC of offspring of non-asthma(control)and asthma(asthma)mothers(%)
2.2 哮喘组调节性T细胞相关细胞因子IL-10的分泌在Ppg刺激后低于对照组 在哮喘组和对照组,几种刺激均可增加IL-10、IL-13和IFN-γ在CBMC中的分泌浓度(与无刺激组比较,P均<0.05)。无刺激时和PHA、LpA和Derf1刺激后,哮喘组和对照组各种细胞因子的分泌无差别。但Ppg刺激后,哮喘组CBMC分泌IL-10浓度小于正常对照组新生儿(837 vs 1312,T=2025,P=0.03),差异有统计学意义。哮喘组分泌IL-13浓趋向于大于对照组(31.7 vs 19.1,T=1351,P=0.1,见表 3),但差异无统计学意义。而对于IFN-γ的分泌浓度,在二组之间无差别(P>0.05),说明母亲的过敏性哮喘病史使新生儿在TLR2免疫途径上IL-10分泌下调,而同时存在IL-13产生增多的趋势。
2.3 哮喘组调节性T细胞体外对效应细胞的抑制功能低于对照组 对照组新生儿的CD4+CD25-T效应细胞与CD3-T细胞在PHA刺激后共同培养后,81.6%效应细胞分裂增殖,但在加入 CD4+CD25+T调节性细胞共同培养组,只有68.9%效应细胞分裂增殖,故CD4+CD25+T调节性细胞对于效应细胞增殖的抑制率为20.9%(算法见1.5),而在哮喘组抑制率仅为3.2%(见表4),明显低于对照组,差异有统计学意义(20.9%vs 3.2%,t=2.42,P=0.05)。此外,在哮喘组 CD4+CD25+T 调节性细胞对效应细胞分泌IL-13的抑制率也趋向于低于对照组(79.1%vs 51.6%,t=1.88,P=0.07),但差异无统计学意义(见表3)。而CD4+CD25+T调节性细胞对效应细胞分泌IFN-γ抑制作用在二组之间无差别(t=0.87,P=0.57),说明母亲的过敏性哮喘病史使新生儿调节性T细胞对效应细胞尤其Th2细胞的抑制功能下调。
3 讨论
母亲过敏病史对后代的影响可以从新生儿期甚至胚胎期开始,然而这种影响的免疫机制尚不十分明确。除了传统上的Th1/Th2细胞途径失衡学说外,近些年调节性T细胞在过敏性哮喘的发病机制中所起的作用日益受到重视。而母亲的哮喘病史对新生儿免疫反应的影响则可能表现在调节性T细胞的异常上[3]。对于新生儿免疫系统的发育,环境因素起到很重要作用,例如在富含微生物的生活环境中成长起来的儿童患过敏性疾病的风险相对较小[4,5]。这种影响主要与TLR2和TLR4免疫途径相关联[6,7]。本研究在体外应用LpA和Ppg分别诱导新生儿的TLR4和TLR2先天性免疫反应;同时也应用PHA和Derp1刺激新生儿免疫反应,然后系统地研究了哮喘组调节性T细胞数量和功能的情况。结果发现,哮喘组新生儿脐带血中调节性T细胞数量和功能均下调,并存在对Th2细胞的抑制功能的部分缺失,这可能部分解释母亲有过敏性哮喘病史的儿童更易患哮喘等过敏性疾病的原因,而这种易患性可能从新生儿甚至胎儿时期就已经开始。
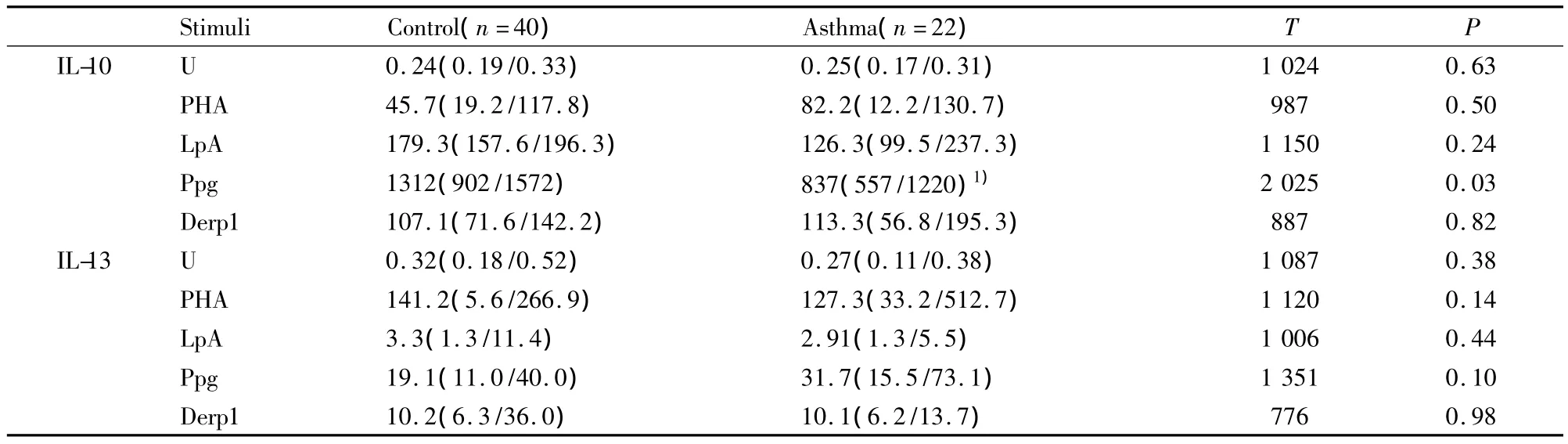
表3 细胞因子IL-10和IL-13产生浓度(pg/ml)Tab.3 The production of cytokines IL-10 and IL-13(pg/ml)in CBMC of offspring of non-asthma(control)and asthma(asthma)mothers
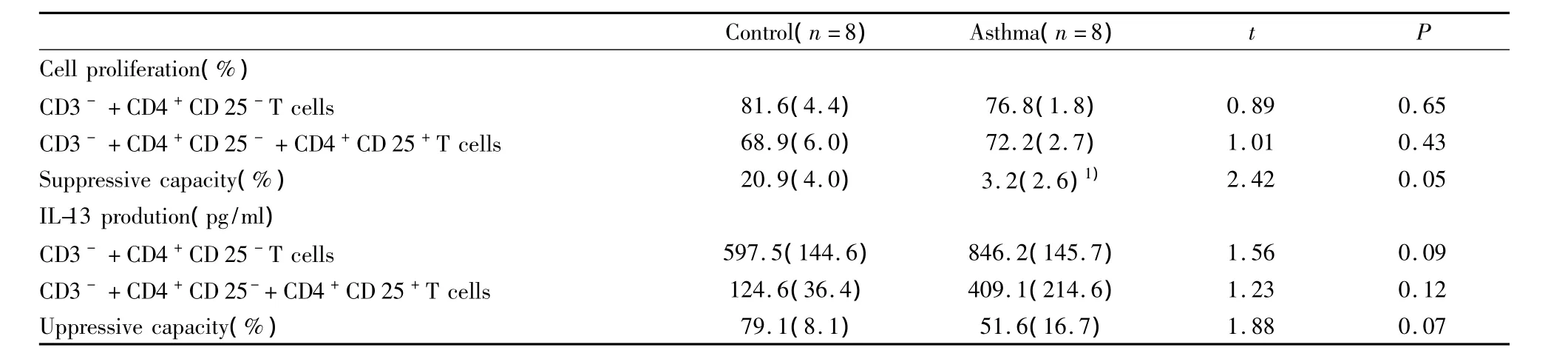
表4 调节性T细胞对效应细胞的抑制功能Tab.4 The suppressive capacity of CD4+CD25+T reg cells on CD4+CD25 -T effector cells in CBMC of control and asthma mothers
生命早期免疫系统的发生发展对于儿童今后是否易患过敏性疾病至关重要[3,4],因此我们可以认为母亲的哮喘病史可能通过两种途径导致新生儿免疫功能异常:一种是在胚胎时期受子宫内膜及胎盘免疫环境的影响,另外一种是通过遗传作用。这两种作用均可影响新生儿的免疫细胞。目前除了传统的Th1/Th2免疫失衡学说外,调节性T细胞在过敏性哮喘发病及治疗机制中的作用日益受到重视[8-10],尤其在新生儿免疫未成熟期,调节性T细胞可能在Th1/Th2轴向分化过程中起到重要调节作用。
CD4+CD25+是调节性T细胞较常用的表面标志,而Foxp3则是调节性T细胞最特异的转录因子,Foxp3可控制调节性T细胞的分化和发展[11];IL-10是分泌性调节性T细胞相对特异的细胞因子。本研究选用了以上这几种标志,并应用不同的实验方法从基因表达、细胞表面标志染色及细胞因子分泌等不同层面检测了调节性T细胞的数量和功能情况,结果具有一致性,即与对照组相比,哮喘组新生儿的CD4+CD 25+Foxp3+T细胞数量,IL-10分泌浓度在TLR2免疫途径上(Ppg刺激后)均存在一定的免疫缺陷,在PHA刺激后中也部分降低。同时我们体外分离CD4+CD25+调节性T细胞,与CD4+CD25-效应性T细胞共同培养,以检测CD4+CD25+调节性T细胞的抑制功能,同样发现在哮喘组新生儿调节性T细胞的功能在PHA刺激后也被下调。
为了进一步探讨这种调节性T细胞的数量和功能的缺陷对其他免疫细胞的作用,本研究同时也检测了母亲过敏性哮喘病史对新生儿Th1和Th2细胞的影响。结果发现,TLR2免疫途径上,哮喘组新生儿CBMC分泌IL-13的浓度趋向于低于对照组,而IFN-γ分泌浓度在两组间无差别。在调节性T细胞功能研究中,来自于哮喘组新生儿的CD4+CD 25+调节性T细胞对效应细胞活化后分泌IL-13能力的抑制作用低于对照组,这提示调节性T细胞功能和数量下调,对于Th2细胞的抑制作用减弱,从而使Th2细胞反应相对增强[9],这可能导致新生儿将来患过敏性哮喘的风险增加。
从本研究结果可以发现,调节性T细胞的异常在TLR2免疫途径上表现得较明显。而在过敏性疾病发病的卫生环境假说中,研究表明生命早期生活环境中微生物含量增加,可通过TLR2免疫途径影响婴幼儿免疫系统,Th1免疫途径增强,Th2免疫途径相对减弱,从而向不易患过敏性疾病的方向发展[4-6],这提示我们可以探索通过TLR2免疫途径,早期干预这些母亲有哮喘病史的新生儿的调节性T细胞的异常,从而达到早期预防过敏性疾病的目的。
总之,母亲有过敏性哮喘病史的新生儿脐带血中,调节性T细胞的数量和功能存在一定程度上的缺陷,以上发现为我们进一步深入研究调节性T细胞在过敏性哮喘发病中的机制及早期预防奠定了基础。
1 Wright A L.The epidemiology of the atopic child:who is at risk for what?[J].J Allergy Clin Immunol,2004;113(Suppl 1):S2-S7.
2 Litonjua A A,Carey V J,Burge H A et al.Parental history and the risk for childhood asthma.Does mother confer more risk than father?[J].Am J Respir Crit Care Med,1998;158:176-181.
3 Schaub B,Campo M,He H et al.Neonatal immune responses to TLR2 stimulation:influence of maternal atopy on Foxp3 and IL-10 expression[J].Respir Res,2006;7:40-49.
4 Ege M J,Bieli C,Frei R et al.Prenatal farm exposure is related to the expression of receptors of the innate immunity and to atopic sensitization in school-age children[J].J Allergy Clin Immunol,2006;117(4):817-823.
5 von Mutius E,Radon K.Living on a farm:impact on asthma induction and clinical course[J].Immunol Allergy Clin N Am,2008;28:631-647.
6 Velasco G,Campo M,Manrique O J et al.Toll-like receptor 4 or 2 agonists decrease allergic inflammation[J].Am J Respir Cell Mol Biol,2005;32(3):218-224.
7 Eder W,Klimecki W,Yu L et al.Toll-like receptor 2 as a major gene for asthma in children of European farmers[J].J Allergy Clin Immunol,2004;113(3):482-488.
8 Wing K,Sakaguchi S.Regulatory T cells as potential immunotherapy in allergy[J].Curr Opin Allergy Clin Immunol,2006;6(6):482-488.
9 Cottrez F,Hurst S D,Coffman R L et al.T regulatory cells 1 inhibit a Th2-specific response in vivo[J].J Immunol,2000;165(9):4848-4853.
10 Strickland D H,Stumbles P A,Zosky G R et al.Reversal of airway hyperresponsiveness by induction of airway mucosal CD4+CD25+regulatory T cells[J].J Exp Med,2006;203(12):2649-2660.
11 Hori S,Nomura T,Sakaguchi S.Control of regulatory T cell development by the transcription factor Foxp3[J].Science,2003;299(5609):1057-1061.

