经链球菌菌体制剂OK-432刺激的树突状细胞对自然杀伤细胞增殖及功能的影响
于丽梅 陈剑群 陈复兴 刘军权 周忠海 陈 玲
(徐州医学院附属医院消化科,徐州221002)
肝癌是消化系统最常见的恶性肿瘤之一,为我国第2位恶性肿瘤致死病因,世界各地的肝癌每年新增病例约100万[1]。早期通过手术、移植或介入等,5年生存率虽可达到70%左右;但2年复发率依然高达50%,且现有治疗手段疗效均欠佳[2]。因此如何提高肝癌患者的生存状况,是肿瘤学界面临的严峻挑战[3]。溶血性链球菌菌体制剂OK-432作为GMP(Good manufacturing products)级的免疫生物效应修饰剂和处方药,早已用于治疗各种肿瘤[4]。OK-432可增强 NK细胞、淋巴细胞等细胞的细胞毒作用,并促进干扰素、IL-2、TNF-α等的分泌,调节机体的抗肿瘤免疫反应[5]。较其它DC成熟诱导剂相比,促进未成熟树突状细胞(immature DC,imDC)成熟的能力更强,而且具有更好的应用前景[6-10]。近年肿瘤免疫治疗已成为一种新的治疗模式,而在肿瘤免疫中NK细胞构成第一道免疫杀伤防线,具有很强的细胞毒作用,而树突状细胞是人体内抗原递呈功能最强的细胞,是启动、调控、维持免疫反应的中心环节[11,12]。DC和NK细胞之间存在复杂的双向通信,两者的相互作用不仅影响了免疫反应的启动,而且决定其结局。其中应用DC与NK细胞体外共培养后联合输注治疗恶性肿瘤的研究越来越受到重视。本研究探讨OK-DC对NK细胞扩增及其功能的影响。
1 材料与方法
1.1 材料 胎牛血清(FCS)、RPMI1640培养基购于Gibco公司;重组人白细胞介素2(rhIL-2)购自厦门特宝生物工程股份有限公司;OK-432购于山东鲁抗制药公司;噻唑蓝(MTT)、DMSO(二甲亚砜)、FITC标记的CD16/CD56购于Sigma公司;鼠抗人PE 标记的 CD1a、CD3、CD86、CD80,鼠抗人 FITC 标记的CD83购于BD公司;乳酸脱氢酶试剂盒购于日本世诺临床诊断制品株式会社;PE标记的穿孔素、颗粒酶B及APC标记的鼠抗人CD107a购于杭州联科生物;人肝癌HepG2细胞株由徐州医学院肿瘤科实验室液氮保存。
1.2 方法
1.2.1 细胞培养 人类外周血单个核细胞(Peripheral blood mononuclear cell,PBMC)分离、DC 培养[13],于第6天时将DC分2组:(1)imDC组:不加OK-432;(2)OK-DC组:加入终浓度为5μg/ml的OK-432。48小时后FCM检测CD1a、CD83高表达,收获DC与NK细胞混合培养。
NK细胞培养用含10%FCS的RPMI1640培养液调整人PBMC浓度为2×105ml-1,加入6孔板,每孔4 ml,并加入 rhIL-2(终浓度 500 U/ml),在37℃、5%CO2、饱和湿度培养箱中培养,每3天半量换液并补足rhIL-2。
1.2.2 实验分组 NK细胞于培养8天后收集细胞,分组处理如下:(1)对照组:单纯NK组;(2)OKDC 组:OK-DC 与 NK 细胞以 1∶1、1∶5、1∶10、1∶20、1∶40的比例混合;(3)imDC组:imDC与NK细胞以(2)的比例分组,补充相应的细胞因子。
1.2.3 MTT法检测OK-432对DC增殖影响 取培养6天的DC,接种于96孔板中,0.2 ml/孔,细胞浓度为1 × 106ml-1,于 37℃、5%CO2培养箱中培养。加入 OK-432(终浓度分别为 80、40、20、10、5、2.5、1.25、0.6、0.3、0.15 μg/ml),同时设不加药物的对照组,每组5个复孔。孵育48小时后每孔加MTT液(5 mg/ml)20 μl,于 37℃、5%CO2培养箱中培养4小时,弃上清,加入DMSO 150μl,在570nm波长酶标仪上测定各孔光密度值(OD)。细胞增殖率=(实验组A值/对照组A值-1)×100%。
1.2.4 NK 细胞增殖检测 分别于共培养 0、2、4、6天取少许细胞悬液用台盼蓝拒染法检测细胞存活率,并进行细胞计数。每样本NK细胞扩增倍数=计数时细胞总数×本样本CD3-CD16+56+表达百分率/(初始细胞数×初始细胞CD3-CD16+56+表达百分率)。
1.2.5 FCM检测DC表型表达 收集各组DC,调整细胞浓度为 1×107ml-1,按照试剂说明加入CD80、CD83、CD86 抗体,37℃避光孵育 15 分钟,洗涤后流式细胞仪检测表型表达情况。
1.2.6 FCM 检测 NK 细胞表面 PFP、GraB、CD107a表达 收集各组细胞,每管加入相应量CD3、CD56抗体及PFP、GraB、CD107a抗体,混匀后室温暗处结合15分钟,离心后加入PBS重悬细胞,然后上机检测。
1.2.7 LDH释放法检测NK细胞杀伤活性 收集经DC作用的NK细胞和本室液氮复苏后的HepG2细胞,生理盐水洗涤,调整各组NK细胞和HepG2细胞浓度分别为2 ×106ml-1和2 ×105ml-1,使效靶细胞比例为10∶1。混合后置于37℃、5%CO2培养箱中孵育6小时,1500 r/min离心10分钟,收集上清液。全自动生化分析仪340 nm波长下测定上清液吸光度值(A),每样本设5个复管。杀伤活性(%)=(A实验组-A效应细胞自然释放组)/(A靶细胞最大释放组-A靶细胞自然释放组)×100%。
2 结果
2.1 OK-432对 DC增殖的影响 OK-432(5 μg/ml)作用DC 48小时后,DC的增殖率较对照组和其它各个浓度组显著增高,增殖达到最佳(30%),差异有统计学意义(P<0.05),其余各组间比较无显著差异。OK-432浓度超过5 μg/ml和低于5 μg/ml时DC的增殖率均逐渐下降,见图1。
2.2 NK细胞扩增 NK和DC共培养第4天时1∶5(OK-DC)组、1∶20(OK-DC)组 NK 细胞扩增倍数明显高于对照组,并高于同比例未处理组,差异有统计学意义(P<0.05);于第6天时1∶5(OK-DC)组NK细胞扩增倍数达最大,且高于1∶20(OK-DC)组和其它各组(P <0.05),见表1。
2.3 DC免疫表型检测 处理组较对照组能显著增强 CD80、CD83、CD86 的表达(P <0.05);5 μg/ml组与对照组、1.25 μg/ml组、20 μg/ml组相比,CD80、CD83、CD86分子的表达有显著差异(P<0.05),见表2 及图2 ~4。
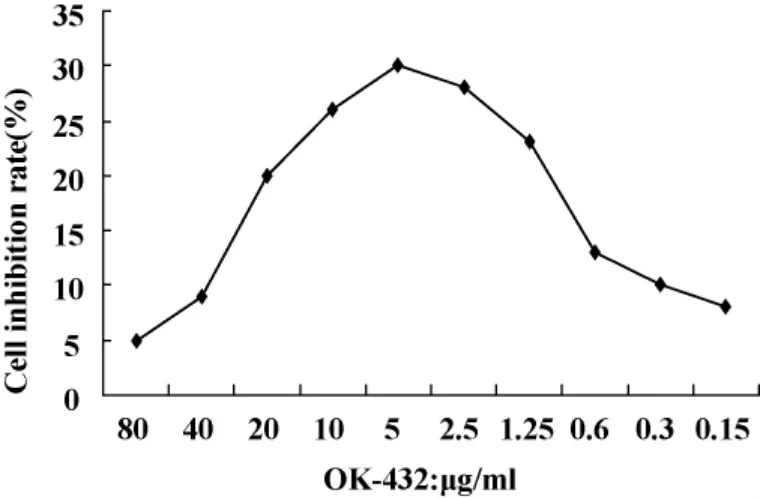
图1 不同浓度OK-432对DC增殖的影响(±s,n=5)Fig.1 The effect of different concentrations of OK-432 on DC growth(±s,n=5)

表1 NK细胞增殖倍数Tab.1 The multiplication of NK cells
2.4 NK细胞释放 PFP、GraB、CD107a的检测 NK与DC共培养4天后,各组释放 PFP、GraB、CD107a较对照组明显上升,差异有统计学意义(P<0.05);1∶5(OK-DC)组与1∶5(imDC)组两组间相比有显著差异(P <0.05),1∶20(OK-DC)组与1∶20(imDC)组两组间也有明显差异(P<0.05);1∶5(OK-DC)组与1∶20(OK-DC)组两组相比有明显差异(P <0.05),见表3。
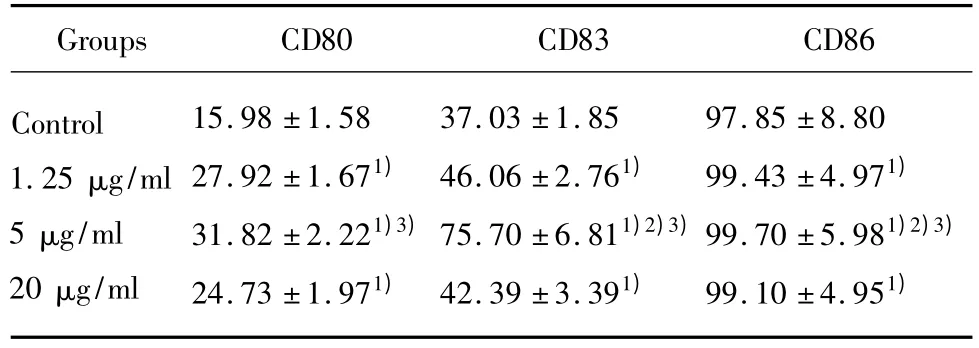
表2 不同浓度OK-432刺激的DC表型表达Tab.2 The expression of CD80,CD83 and CD86 of DC stimulated by different concentrations of OK-432
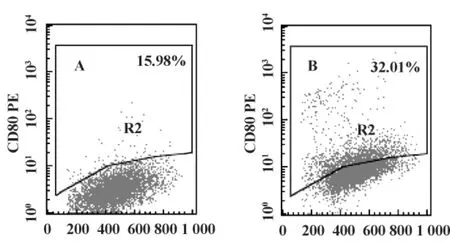
图2 OK-432作用于DC 48小时后的CD80检测结果Fig.2 The CD80 expression of DC stimulated by OK-432 after 48 hours
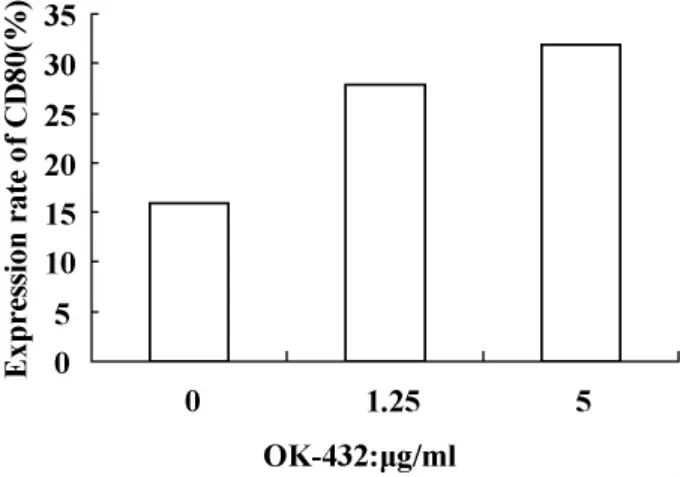
图3 OK-432作用DC 48小时后CD80的表达(±s,n=5)Fig.3 The CD80 expression of DC cultured with OK-432 for 48 hours(±s,n=5)
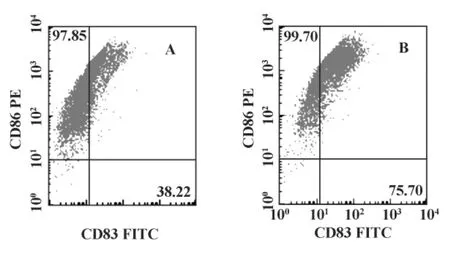
图4 OK-432作用于DC 48小时后的CD83、CD86检测结果Fig.4 The CD83,CD86 expression of DC stimulated by OK-432 after 48 hours
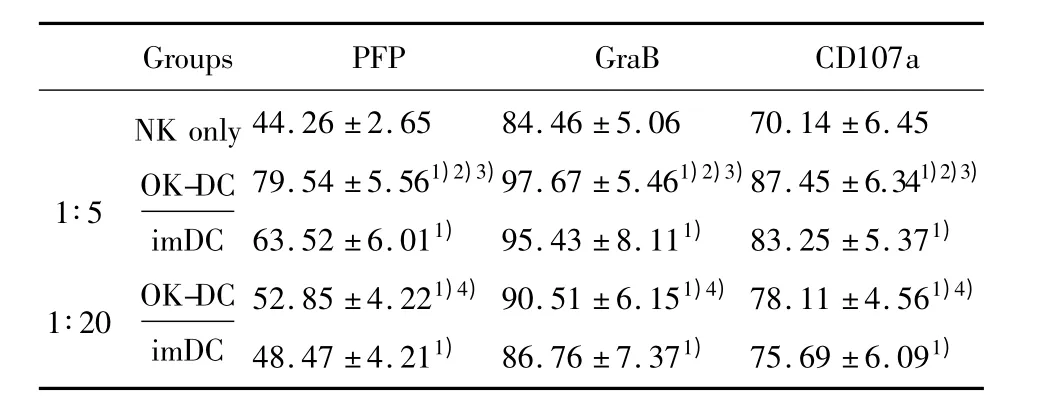
表3 NK细胞PFP、GraB、CD107a的流式检测结果Tab.3 The FCM result of PFP,GraB,CD107a in the NK cells
2.5 NK细胞杀伤活性的检测 NK与DC共培养4天后,1∶5(OK-DC)组对HepG2细胞的杀伤活性(67.12±5.36)%达到最大,显著高于对照组的(50.23 ± 4.02)%、1∶5(imDC)组的(63.11 ±5.46)%和1∶20(OK-DC)组的(58.42 ±4.31)%,差异有统计学意义(P<0.05);1∶20(OK-DC)组与1∶20(imDC)组两组的杀伤活性(58.42 ±4.31)%、(55.34 ±3.43)%相比差异显著(P <0.05),各实验组与对照组比较亦有显著差异(P<0.05)。
3 讨论
在肝癌患者过继免疫治疗中,NK细胞显示出一定抗肿瘤疗效。NK细胞可以在细胞、分子及基因水平抑制肿瘤转移及复发,具有天然杀伤肿瘤细胞的能力,最新研究发现NK细胞还具有适应性免疫的特性[14,15]。
Buentke等[16]通过取感染马拉色霉菌的患者皮肤NK和DC组织,观察到密切接触DC的NK细胞明显增多,首次揭示NK、DC在体内具有相互作用。目前研究发现在感染或肿瘤免疫应答中均发现NK细胞与 DC 之间有相互作用[17]。Granucci等[18]指出DC分泌的IL-2可以促使NK细胞活化,而且IL-2似乎比白细胞介素12(IL-12)或白细胞介素18(IL-18)更能诱导它产生干扰素 γ(Interferonγ,IFN-γ)。将NK细胞和未致敏DC通过过继免疫的方法联合输入肿瘤病人体内,可增加二者直接接触和相互作用的机会,制造一种“适宜的免疫微环境”,促使NK直接杀伤肿瘤细胞,释放抗原,并利用DC天然的抗原识别、加工和提呈能力,诱发DC特异性致敏,促使DC成熟,启动初始免疫,进而推动继发免疫的进行,诱导特异性细胞毒性T细胞(Cytotoxic T lymphocyte,CTL)的免疫应答。NK细胞杀伤靶细胞主要是通过PFP和GraB引起靶细胞的裂解[19]。穿孔素是存在于NK细胞胞质中的细胞毒颗粒,能以钙离子依赖方式在靶细胞膜上形成跨膜通道,导致靶细胞渗透性溶解[20]。GraB不能单独进人靶细胞内,它必须在PFP使靶细胞形成孔后才能通过孔进入,并激活膜上的蛋白酶而引发凋亡[21,22]。研究认为,穿孔素能够降低内体膜稳定性从而促进GraB的内化及释放[23]。GraB具有天冬氨酸转氨酶(Aspartate aminotransferase,AST)活性,除可在胞浆中激活半胱氨酸天冬氨酸蛋白酶(Cysteinasparate protease,Caspase)级联反应启动细胞凋亡外,还可直接迁移至细胞核降解脱氧核糖核酸(Deoxyribonucleic acid,DNA),诱导Caspase非依赖的细胞死亡[24]。此外,NK细胞表面表达Fas配体(Fas ligand,FasL)和肿瘤坏死因子相关的凋亡诱导配体(TNF-related opoptosis-inducing ligand,TRA IL)可通过与靶细胞上的受体结合引起靶细胞的凋亡。NK细胞也可被肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)激活杀伤靶细胞[25]。
本实验证实OK-432(终浓度5 μg/ml)促进DC增殖并促进CD80、CD83、CD86的高表达,也即能促进DC成熟。因为DC只有经促成熟因子作用,才能成为成熟 DC,并且高表达 CD1a、CD80、CD83、CD86等分子,其中CD83是DC成熟的标志。DC和NK细胞共培养过程中,1∶5组NK细胞扩增倍数明显高于其它各组,且同比例OK-DC组扩增明显高于im-DC组,证实OK-DC能以剂量依赖的方式增加NK细胞的扩增倍数。研究发现CD107a是NK细胞活化的一个重要标志,与细胞毒活性密切相关,可作为NK 细胞功能活性的指标[26,27],且 CD107a 表达水平的上调与NK细胞分泌细胞因子的增多及NK细胞对靶细胞的杀伤作用的增强高度相关。本实验1∶5(OK-DC)组释放 PFP、GraB、CD107a与其它各组相比差异显著,证实了OK-DC能以剂量依赖的方式增强NK细胞的功能,以1∶5比例达到最佳。这也符合 Piccioli等[28]观点,NK、DC 通过细胞间的直接接触起作用,而且以1∶5的最佳比例起作用。NK、DC相互作用不仅存在作用部位差异,还存在接触依赖性和剂量依赖性。LDH释放法检测NK细胞杀伤活性,显示1∶5(OK-DC)组对HepG2细胞的杀伤活性达到最大。提示NK细胞和DC共培养能增强NK细胞的功能,从而增强了NK细胞杀伤肝癌细胞的活性,可能与增加 NK扩增倍数和 PFP、GraB、CD107a的表达有关。
OK-DC与NK细胞共培养在肿瘤免疫治疗中的研究目前尚未有系统报道,因此两者的共作用有望成为肿瘤免疫治疗的新热点。
1 Schütte K,Bornschein J,Malfertheiner P.Hepatocellular carcinoma--epidemiological trends and risk factors[J].Dig Dis,2009;27(2):80-92.
2 Rahbari N N,Mehrabi A,Mollberg N M et al.Hepatocellular carcinoma:current management and perspectives for the future[J].Ann Surg,2011;253(3):453-469.
3 Aravalli RN,Steer C J,Cressman E N.Molecular mechanisms of hepatocellular carcinoma[J].Hepat Ology,2008;48(6):2047-2063.
4 Okamoto M,Ohe G,Furuichi S et al.Enhancement of anti-tumor immunity by lipoteichoic acid-related molecule isolated from OK-432,a streptococcal agent,in athymic nude mice bearing human salivary adenocarcinoma:role of natural killer cells[J].Anticancer Res,2002;22(6A):3229-3239.
5 Fujimoto T,Duda R B,Szilvasi A et al.Streptococcal preparation OK-432 is a potent inducer of IL-12 and a T helper cell 1 dominant state[J].J Immunol,1997;158(12):5619-5620.
6 Ogihara T,Iinuma H,Okinaga K.Usefulness of immuno-modulators for maturation of dendritic cells[J].Int J Oncol,2004;25(2):453-459.
7 Nakahara S,Tsunoda T,Baba T et al.Dendritic cells stimulated with a bacterial product,OK-432,efficiently induce cytotoxic T lymphocytes specific to tumor rejection peptide[J].Cancer Res,2003;63(14):4112-4118.
8 Tamada K,Harada M,AbeK et al.Antitumor vaccination effect of dendritic cells can be augmented by locally utilizing Th1-type cytokines from OK432-reactive CD4+T cells[J].Cancer Immunol Immunother,1998;46(3):128-136.
9 Itoh T,Ueda Y,Okugawa K et al.Streptococcal preparation OK-432 promotes functional m aturation of human monocyte-derived dendritic cells[J].Cancer Immunol Immunother,2003;52(4):207-214.
10 Sakakibara M,Kanto T,Inoue M et al.Quick generation of fully mature dendritic cells from monocytes with OK-432,lowdose prostanoid,and interferon-alpha as potent immune enhancers[J].J Immunother,2006;29(1):67-77.
11 Kim R,Emi M,Tanabe K.Cancer immunoediting from immune surveillance to immune escape[J].Immunology,2007;121(1):1-14.
12 Chijioke O,Munz C.Interactions of human myeloid cells with natural killer cell subsets in vitro and in vivo [J].J Biomed Biotechnol,2011;(251679):1-7.
13 黄红艳,王 营,陈复兴et al.姜黄素诱导的免疫耐受性人树突状细胞的研究[J].中国免疫学杂志,2011;27(7):612-613.
14 Hoover R G,Gullickson G,Kornbluth J.Impaired NK cytolytic activity and enhanced tumor growth in NK lytic-associated molecule-deficient mice[J].J Immunol,2009;183(11):6913-6921.
15 Sun J C,Beilke J N,Lanier L L.Adaptive immune features of natural killer cells[J].Nature,2009;457(7229):557-561.
16 Buentke E,Heffler L C,Wilson J L et al.Natural killer and dendritic cell contact in lesional atopic dermatitis skin-Malassezia-influenced cell interaction[J].J Invest Dermatol,2002;119(4):850-857.
17 Schmitz M,Zhao S,Deuse Y et al.Tumoricidal potential of native blood dendritic cells:direct tumor cell killing and activation of NK cell-mediated cytotoxicity[J].Immunol,2005;174(7):4127-4134.
18 Granucci F,Zanoni I,Pavelka N et al.A contribution of mouse dendritic cell-derived IL-2 for NK cell activation[J].J Exp Med,2004;200(3):287-295.
19 Suwa T,Saio M,Umemura N et al.Preoperative radiotherapy contributes to induction of proliferative activity of CD8+tumor-infiltrating T-cells in oral squamous cell carcinoma[J].Oncol Rep,2006;15(4):757-763.
20 Urrea M R,Gil J,Rodriguez-Sainz C et al.Functional assessment of perforin C2 domain mutations illustrates the critical role for calciumdependent lipid binding in perforin cytotoxic function[J].Blood,2009;113(2):338-346.
21 0zdemir O,Savasan S.Combinational IL-2/IL-15 induction does not further enhance IL-15 induced lymphokine-activated killer cell cytotoxicity against human leukemia/lymphoma cells[J].Clin Immunol,2005;115(3):240-249.
22 Takata H,Takiguchi M.Three memory subsets of human CD8+T cells differently expressing three cytolytic effector molecules[J].J Immunol,2006;177(7):4330-4340.
23 Keefe D,Shi L,Feske S et al.Perforin triggers a plasma membranerepair response that facilitates CTL induction of apoptosis[J].Immunity,2005;23(3):249-262.
24 Lord S J,Rajotte R V,Korbutt G S et al.Granzyme B:a natural born killer[J].Immunol Rev,2003;193(1):31-38.
25 Fietta P,Delsante G.Focus on human natural killer cells[J].Riv Biol,2009;102(2):219-235.
26 Alter G,Malenfant J M,Altfeld M.CD107a as a functional maker for the identification of natural killer cell activity[J].J Immunol Methods,2004;294(1-2):15-22.
27 Aktas E,Kucuksezer U C,Bilgic S et al.Relationship between CD107a expression and cytotoxic activity[J].Cell Immunol,2009;254(2):149-154.
28 Piccioli D,Sbrana S,Melandri E et al.Contact-dependent stimulation and inhibition of dendritic cells by natural killer cells[J].J Exp Med,2002;195(3):335-341.

