传染性胰脏坏死病毒逆转录聚合酶链式反应法(RT-PCR)的研究
吴 斌,肇慧君,李 叶,胡晓利
(1.辽宁出入境检验检疫局,辽宁大连 116001;2.江苏洋河酒厂,江苏宿迁 223725 )
传染性胰脏坏死病毒(Infectious pancreatic necrosis virus,IPNV)是一种经济上非常重要的鱼病原体,在幼大马哈鱼中能够引起及其严重的感染,导致高的死亡率。最初只在北美及欧洲的一些国家流行,近年来随着水生动物进口贸易的增加,传染性胰脏坏死病已传入我国并在一些地区流行,造成了严重的经济损失。
RT-PCR是针对RNA病毒的一种检测方法,目前发展已非常成熟,证实是一种快速、准确、灵敏和方便的方法[1]。本文针对IPNV A片段VP5基因和VP3基因分别设计了两对特异性引物,同时优化了反应体系和反应条件。最终用优化好的反应条件对从人工感染的斑马病鱼中提取的核酸进行扩增,分别扩增出了224 bp和206 bp的目的条带。
1 材料与方法
1.1 材料
1.1.1 毒株与细胞 IPNV毒株、CHSE-214(大鳞大麻哈鱼胚胎细胞系)、EPC(鲤鱼上皮瘤细胞)、FHM(鲤鱼上皮细胞)冻存细胞由本室保存提供。
1.1.2 主要试剂 胎牛血清购自杭州四季青生物公司;M199购自GIBCO公司;Taq DNA聚合酶、dNTP、DEPC、逆转录酶、DNA片段纯化试剂盒、PCR产物克隆用载体、DNA Marker均购自大连宝生物工程公司;凝胶回收试剂盒和质粒提取试剂盒购自OMEGA公司。
1.1.3 引物序列 根据测序结果,使用Primer Premier 5.0 软件设计2对RT-PCR引物(表1)。并通过NCBI数据库进行BLAST验证引物序列特异性后,由大连宝生物工程有限公司合成。
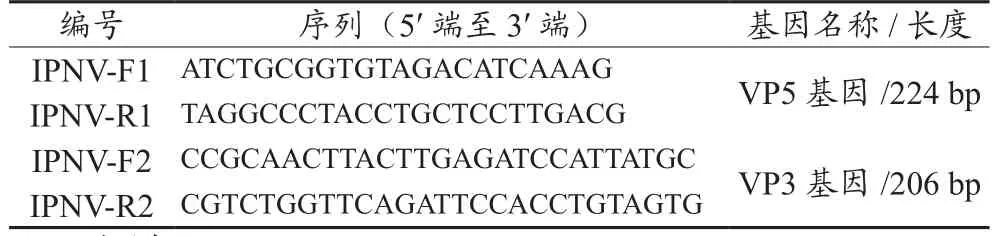
表1 本试验设计IPNV的两对引物
1.2 方法
1.2.1 反转录条件优化 在PCR管中加入RNA模板 5 µL、5 µL 的 5倍逆转录酶浓缩缓冲液、2 µL dNTP、0.5 µL RNA酶抑制剂(20U)、1 µL逆转录酶AMV(10IU),加 DEPC 水至 25 µL[2]。42 ℃ 60 min反应,合成模板cDNA。
1.2.2 PCR扩增反应条件优化 用引物F1和R1时,本试验采用两步法进行扩增,而用引物F2和R2时,则采用一步法进行扩增,并对dNTP、Mg2+和引物的浓度进行优化[3],试剂配方分别为:
F1/R1:10×PCR Buffer 4.0 µL,dNTPs Mixture 3.0 µL,MgCl2(25mM) 2.5 µL,TaqPolymerase 0.5 µL,IPNV-F1(20 pmol/µL)1.5 µL,IPNV-R1(20 pmol/µL)1.5 µL,cDNA 5.0 µL,ddH2O 32.0 µL,总计 50.0 µL;
F2/R2:10×E×Buffer 5.0 µL,MgCl2(25mM)3.0 µL,dNTPs Mixture 4.0 µL,E×Taq E 0.5 µL,IPNV-F2(20 pmol/µL) 2.5 µL,IPNV-R2(20 pmol/µL) 2.5 µL,AMV(5 u/µL) 1.0 µL,RNaSin(40 u/µL)0.25 µL,RNA 5.0 µL,ddH2O 26.25 µL,总计 50 µL。1.2.3 RT-PCR特异性试验 采用优化后的反应体系和扩增条件,用IPNV的引物对IPNV、IHNV、SVCV、VHSV和ISA的RNA进行RT-PCR检测,确定方法特异性。
1.2.4 RT-PCR的灵敏度试验 取200 µL病毒悬液,提取RNA[4],然后对RNA进行10倍系列稀释,每个稀释度进行RT-PCR,以检测方法的灵敏度。
2 结果与讨论
2.1 RT-PCR反应条件的优化
2.1.1 Mg2+浓度优化
Mg2+浓度优化的电泳图见图1,当Mg2+的浓度为1.0~3.0 mM/L时,两对引物所扩增的条带均很亮。使用F1/R1时,Mg2+终浓度为1.0 mM/L时,特征条带最亮。使用F2/R2时,Mg2+终浓度为3.0 mM/L时,特征条带最亮,形成的引物二聚体相对也少。因此,使用引物F1/R1和F2/R2扩增目的片段时,Mg2+的最佳终浓度分别为1.0 mM/L和3.0 mM/L。
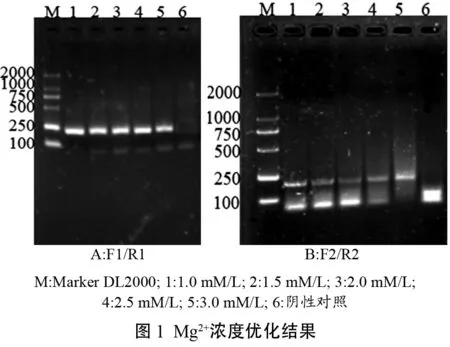
2.1.2 dNTP浓度优化
dNTP浓度优化的电泳图见图2,反应体系中dNTP终浓度为1.0 mM/L~3.5 mM/L,两对引物所扩增的RT-PCR产物均形成较亮的特征条带,当使用F1/R1时,dNTP的终浓度为2.0mM/L时,特征条带最亮。当使用F2/R2时,dNTP的终浓度为2.5mM/L时,特征条带最亮。因此,选择终浓度为2.0mM/L和2.5mM/L分别作为其最适浓度。
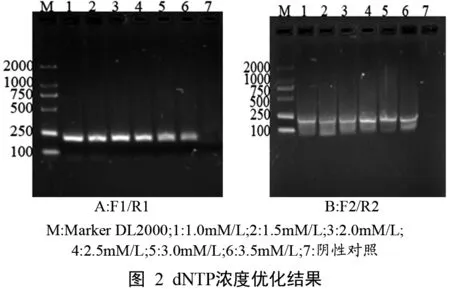
2.1.3 引物浓度优化
引物浓度优化电泳图见图3,引物终浓度为0.8mM/L-2.4mM/L,当使用F1/R1时,引物的终浓度为0.8mM/L时,引物二聚体最少,且特征条带亮度很高,随着引物浓度得增加出现了引物二聚体,说明引物有剩余。当使用F2/R2时,引物的终浓度为1.2mM/L时,特征条带最亮。因此,分别选择0.8mM/L、1.2mM/L的引物浓度最为RT-PCR的最适终浓度。
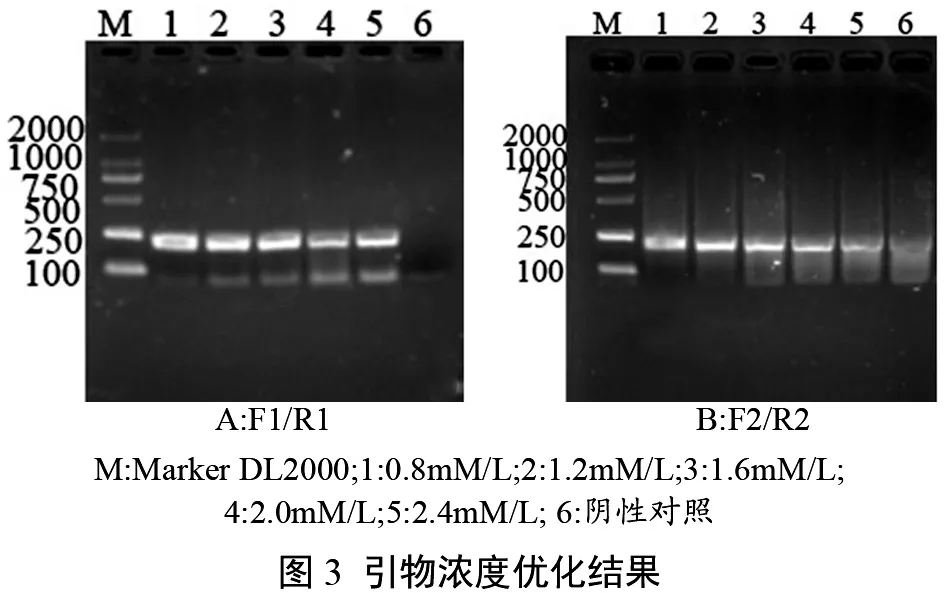
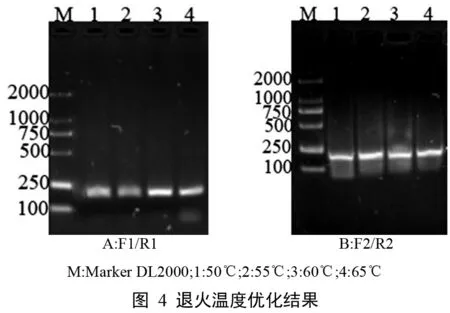
2.1.4 退火温度优化
依据优化后的组分配置反应体系进行RTPCR优化退火温度,电泳结果见图4,退火温度从50~65 ℃,均可扩增出特征条带,退火温度分别为60 ℃、65 ℃时,扩增产物电泳条带较亮,更高或更低退火温度下扩增,电泳条带亮度有减弱趋势,故分别选择60℃、65℃为最适退火温度。
综合以上优化的各反应条件,当使用引物F1/R1对IPNV进行PCR反应,确定其反应条件为:
10×PCR Buffer 4.0 µL,dNTPs Mixture 4.0 µL,MgCl2(25mM) 2.0 µL,TaqPolymerase 0.5 µL,IPNV-F1(20 pmol/µL) 2.0 µL,IPNV-R1(20 pmol/µL)2.0 µL,cDNA 5.0 µL,ddH2O 30.5 µL,总计 50.0 µL。
使用引物F2/R2对IPNV进行扩增,本研究使用了一步法,经过反应条件的优化,确定其反应条件为:
10×E×Buffer 5.0 µL,MgCl2(25mM) 6.0 µL,dNTPs Mixture 5.0 µL,IPNV-F2(20 pmol/µL) 3.0 µL,IPNV-R2(20 pmol/µL) 3.0 µL,E×Taq E 0.5 µL,AMV(5 u/µL) 1.0 µL,RNaSin(40 u/µL)0.25 µL,RNA 5.0 µL,ddH2O 21.25 µL,总计 50.0 µL。
PCR反应程序为:95 ℃变性5 min;接着进行35个循环(94 ℃变性30 s,60 ℃退火40 s,72 ℃延伸40 s);72 ℃延伸7 min。反应结束后,取8 µL RTPCR扩增产物经2.0%琼脂糖凝胶电泳鉴定,紫外拍照。
一步法RT-PCR反应程序为:50 ℃反转录30 min;95 ℃变性2 min;接着进行40个循环(95 ℃变性 30 s,65 ℃退火 30 s,72 ℃延伸 1 min);72 ℃延伸7 min。反应结束后,取8 µL RT-PCR扩增产物经2.0%琼脂糖凝胶电泳鉴定,紫外拍照。
2.2 RT-PCR的特异性试验
用IPNV的两对引物对IPNV、IHNV、SVCV、VHSV和ISA进行RT-PCR,结果如图5所示。用两对引物检测IPNV时,两个阳性对照分别扩增出了224 bp和206 bp的目的片段,其他RNA病毒和阴性对照没有产生目的条带,因此,两对引物R1/F1、R2/F2具有很高的特异性。

2.3 RT-PCR灵敏度试验
10倍系列稀释病毒RNA,每个稀释度取5 µL进行RT-PCR,结果如图6所示,随着稀释度的增加,条带也逐渐的变暗,检测结果的最大稀释度为10-6,相应的灵敏度为1pgRNA。
3 讨论

RT-PCR技术是根据某个特定病毒的核苷酸序列设计特异性引物,通过核酸的扩增来达到检测目的。对水生动物病毒的检测通常是先将病料在该病毒的敏感细胞中培养,初步观察其病变情况,然后再进行进一步的鉴定,但是在没有敏感细胞的情况下可对病料直接提取RNA进行RT-PCR反应。而有关IPNV基因组的数据库已经建立,因此该方法可将致使鱼发病的病毒鉴定到种。因此在水生动物进出口检测和疾病预防中,RT-PCR技术成为了一个常用的手段。若在鱼类病毒的检测过程中,将RT-PCR技术和细胞培养技术结合使用,其检测灵敏度和病毒检出率会更高。
本文通过优化RT-PCR的反应条件和体系,建立了应用RT-PCR检测IPNV-Sp的方法,该方法特异敏感,并成功用此方法对人工感染IPNV的斑马鱼进行了检测。该方法对IHNV、SVCV、VHSV和ISA的核酸均没有扩增,其检测极限为1 pg的RNA。
本文建立的RT-PCR方法中,针对IPNV片段A的VP5和VP3分别设计了两对引物,一对引物用两步法,另一对引物采用了一步法,通过比较发现一步法可以避免气溶胶的形成,而采用两步法时在阴性对照中出现了和目的片段大小相同的条带,因此有可能是因为空气中存在气溶胶。
[1]江育林,徐伯亥,李伟,等. 虹蹲传染性胰脏坏死病毒(IPNV)的初步研究[J]. 水生生物学报,1989,13(4):353-358.
[2]Williams K,Blake S,Sweeney A,et al. Multiplex reverse transcriptase PCR assay for simultaneous detection of three fish viruses[J]. Clin Microbiol,1999,37(12):4139-4141.
[3]Alonso M,Rodriguez S,Perez Prieto S I .Nested PCR improves detection of infectious hematopoietic necrosis virus in cells coinfected with infectious pancreatic necrosis virus[J]. J Virol Methods,1999,81(1/2):1-9.
[4]Cutrin J M,Lopez-Vazquez C,Olveira J G,et al. Isolation in cell culture and detection by PCR-based technology of IPNV-like virus fromLeucocytes of carrier turbot,Scophthalmus maximus(L.)[J]. J Fish Dis,2005,28(12):713-722.

