新孢子虫SRS2基因的克隆及原核表达
邢小勇,王 权,温峰琴,郝宝成,项海涛,胡永浩
(1.甘肃农业大学动物医学院,甘肃兰州 730070;2.中国农业科学院上海兽医研究所,上海 200241;3.中国农业科学院兰州畜牧与兽药研究所,甘肃兰州 730050)
新孢子虫病是由新孢子虫(Neospora caninum)引起的一种主要危害犬和奶牛的原虫病。本病主要引起孕畜流产、死胎以及新生畜运动障碍和神经系统疾病病[1]。新孢子虫病在世界上主要奶牛养殖大国广泛流行,美国加利福尼亚州奶牛新孢子虫病造成的直接经济损失每年达3500万美元,每年给澳大利亚肉牛、奶牛业造成的损失达1亿多美元;在美国、英国、韩国分别有42.5%、12.5%、19.5%的牛流产是由新孢子虫病引起的[2-4];我国台湾地区牛血清中新孢子虫抗体阳性率高达44.9%[5]。因此,新孢子虫病被认为是世界上奶牛产业国家奶牛流产的主要原因之一。有效控制该病主要依靠疫苗接预防和淘汰阳性奶牛。目前用于诊断和制造疫苗的新孢子虫蛋白主要集中在几种表面蛋白和致密颗粒抗原,如NcSRS2、NcSAG1、NcDG1、NcDG2和NcGRA2等。NcSRS2(Nc-p43)是新孢子虫的主要表面蛋白之一。NcSRS2在速殖子和缓殖子阶段均能表达,NcSRS2基因的ORF为1206 bp,编码401个氨基酸,表达的蛋白分子量为43kDa,并且在其N端含有53个氨基酸大小的信号肽。其作用是介导虫体入侵宿主细胞,抗NcSRS2的单克隆抗体能阻断这一作用。NcSRS2基因已经成功在昆虫杆状病毒系统中得到表达,并且证实NcSRS2是一种含有糖基磷脂酰肌醇锚的跨膜蛋白,可用做诊断和疫苗的免疫原[6]。本实验拟通过克隆NcSRS2基因的部分片段,并进行原核蛋白表达,为制备新孢子虫亚单位疫苗和诊断试剂奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株与载体 pMD19-T克隆载体购自宝生物(大连)工程有限公司;pET-32a表达载体由本实验室保存;大肠杆菌DH5α、BL21菌种由本实验室保存。
1.1.2 主要生化试剂及工具酶 TaqMix购于广州东盛生物科技有限公司;T4DNA连接酶、EcoRⅠ、XhoⅠ购自宝生物(大连)工程有限公司;DNA凝胶回收试剂盒为美国AXYGEN产品。
1.2 方法
1.2.1 DNA模板提取 取蛋白酶K消化液滴加到含有新孢子虫虫体的新孢子虫荧光抗体检测试剂盒的玻板上,水浴过夜。利用基因组提取试剂盒从消化液中提取新孢子虫DNA,置-70 ℃备用。
1.2.2 NcSRS2序列分析与引物设计 利用DNAStar5.0软件对GeneBank中发表的NcSRS2基因序列(登录号AY940488)进行抗原性和疏水性等分析。根据GeneBank中登陆的NcSRS2序列(登录号AY940488),用本地引物设计软件Primer Premier5.0在163-1141 bp上设计上下游引物,并在引物两端分别加上EcoRⅠ和XhoⅠ酶切位点(下划线表示酶切位点)。上游引物:5‘AATGAATTCCCGTTCAAGTCGGAA‘3;下游引物:5‘TTACTCGAGCGTCACATGCATCTCC‘3,引物由美国Invitrogen英杰生命技术有限公司合成。
1.2.3 目的基因体外扩增与TA克隆 PCR反应程序为:95 ℃ 5 min;94 ℃ 1 min,58 ℃ 1 min,72 ℃ 1.5 min,30个循环;72 ℃ 10 min。将纯化片段与PMD19-T载体相连,获得重组质粒重组质粒pMD19T-dNcSRS2t。对提取的质粒分别进行PCR及双酶切鉴定。
1.2.4 目的基因重组表达质粒的构建 提取pMD19TNcSRS2t和pET-32a质粒,用EcoRⅠ和XhoⅠ进行双酶切,37 ℃酶切3 h后,1%琼脂糖电泳分析酶切结果并回收酶切产物。将回收的酶切目的基因与载体DNA的进行连接与转化。提取质粒,酶切鉴定正确后,阳性质粒转化到大肠杆菌BL21,并进行PCR和酶切鉴定。
1.2.5 蛋白诱导表达与纯化 将转化到大肠杆菌BL21感受态细胞中,选择IPTG浓度、诱导温度和时间等因素进行蛋白表达条件的优化。在IPTG至终浓度为1mM、37 ℃诱导6 h时蛋白表达量最高,按此条件大量诱导菌体收集菌液,离心收集,冰浴超声至悬浮液透明,使菌体裂解,同时制备包涵体和上清。进行表达产物的聚丙烯酰胺凝胶电泳分析。
1.2.6 表达蛋白的Western-blot分析 采用半干转印法,对诱导表达目的产物进行免疫转印。取出NC膜,用PBS缓冲液洗10 min,然后置于盛有10mL的封闭液中(含5%脱脂奶的pH7.6的PBST缓冲液)的平皿中,室温下过夜。封闭结束后,用PBST冼NC膜3次,然后将其放入10 mL(其中含有5%脱脂奶)用PBST 1:200倍稀释的牛抗新孢子虫阳性血清中,室温缓慢摇动2 h;然后用PBST漂洗滤膜3次,每次10~15 min。洗毕,将膜放入PBST(含有5%脱脂奶)1:2000倍稀释的辣根过氧化物酶标记的兔抗牛IgG(酶标二抗),室温下轻摇孵育2 h,取出用PBST冲洗4次,每次间隔5 min,最后用PBS缓冲液冲洗10 min。然后将漂洗后NC膜转移到DAB显色液中,室温避光轻摇2~10 min观察显色情况,等抗原区出现明显褐色条带时取出,并用去离子水洗涤,终止反应。
2 结果与分析
2.1 目的基因的扩增与鉴定
用设计的上下游引物对NcSRS2基因进行扩增,PCR产物经琼脂糖凝胶电泳分析,结果表明在998 bp处有一清晰的带(图1),大小与预期结果相符,说明引物设计合理,PCR条件正确。
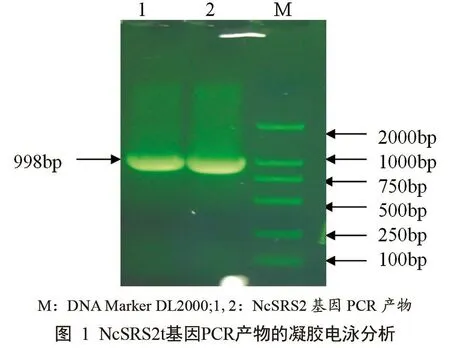
2.3 重组质粒PMD19T-NcSRS2的PCR鉴定
PCR产物与PMD19T载体进行重组连接后转化DH5a感受态细胞,经过蓝白斑筛选重组的转化体。挑选白色菌落分别接种于5 mL的含AMP的LB培养基中,37 ℃过夜培养,提取质粒,以提取质粒为模板,进行PCR检测,结果扩出998 bp大小的片段(图2),与预期结果相符。

2.4 重组质粒PMD19T-NcSRS2的酶切鉴定
对获得重组质粒PMD19T-NcSRS2进行酶切鉴定,切出了998 bp和2692 bp大小片段(图3),与预期相符。
2.5 重组质粒pET32a-NcSRS2t的PCR鉴定
用EcoRⅠ、XhoⅠ双酶切pMD19T-NcSRS2t重组载体与pET32a载体,分别回收NcSRS2t和双酶切后的pET32a载体,连接转化后,挑选菌落分别接种于5 mL的含AMP的LB培养基中,37 ℃过夜培养,提取质粒,以提取质粒为模板,进行PCR检测,结果扩出998 bp大小的片段(图4),与预期结果相符。


2.6 重组质粒pET32a-NcSRS2t的酶切鉴定
对获得重组质粒进行酶切鉴定,切出了998 bp和5866 bp大小片段(图5),与预期相符。

2.7 重组蛋白的纯化与Western blotting分析
应用12%的SDS-PAGE对纯化前和纯化后的蛋白进行比较,纯化后的杂蛋白较少,表明纯化效果较理想。M为普通蛋白Marker,1为纯化前的蛋白,2为纯化后的蛋白。对NcSRS2t基因表达载体的工程菌株的重组蛋白进行Western blotting检测,发现在相对分子量约为53.1KD处有一特异条带(图6),表明此表达产物含有能与新孢子虫阳性血清反应的抗原表位。

3 讨论与分析
3.1 NcSRS2基因包含一个由1203个核酸组成的开放阅读框,编码一个由401个氨基酸组成的蛋白,该蛋白包含有一个53个氨基酸的信号肽。研究表明NcSRS2表面蛋白主要在速殖子和缓殖子阶段表达,表达的蛋白在介导寄生虫的粘附和入侵过程中起主要的作用。Hemphilld等证实新孢子入侵宿主细胞是一个受体-配体结合模式的过程,而且该过程是以蛋白-蛋白而不是蛋白-糖类物质的结合模式进行[7]。NcSRS2是新孢子虫主要的表面蛋白之一,很多实验证明NcSRS2在诊断和预防方面意义重大。
3.2 本实验应用DNAstar 等分子生物学软件氨基酸序列中稀有密码子情况,发现NcSRS2编码的氨基酸序列中含有一定的稀有密码子,特别是第6、9、16、21位和25、26位连续出现稀有密码子,这对蛋白的表达是非常不利得。Eui-Sun SON等以GST融合的形式分别表达了NcSRS2全长,去除N端信号肽和C端疏水区域,去除N端信号肽和C端疏水区域后靠近N端的2/3部分、全长C端的2/3部分、全长N端的1/3部分、全长中间1/3部分和全长C端的1/3部分,结果表明NcSRS2的主要抗原位点在靠近C端的2/3处[8]。而且考虑到N端还是C端都有疏水区和稀有密码子的情况,决定去除N端和C端的疏水序列改用融合蛋白表达载体,在不影响抗原性的前提下实现高效表达。本实验成功地构建了PET-32a-SRS2基因的原核表达载体,经测序分析表明,所构建的载体含SRS2的163-1141基因片段。该载体能在大肠杆菌BL21中高效表达,表达产物大部分以上清形式存在,经纯化后,杂条带很少,纯化效果很好,可以用作下一步实验。纯化后的产物通过Western blotting 检测,结果表明表达的产物可以和天然的抗新孢子虫牛阳性血清反应,说明该表达产物具有很好的反应原性,可以用来作为良好的诊断抗原。
[1]Perez E,Gonzalez O,Dolz G,et al.First report of bovine neosporosis in dairy cattle in Costa Rica[J].Vet Rec.1998,142(19):520-521.
[2]Anderson mL,Andrianarivo A G,Conrad P A.Neosporosis in cattle[J].Anim Repr Sci,2000,60:417-420.
[3]Hemphill A,Gottstein B. A European perspective on Neospora caninum[J]. Intern J Parasitol,2000,30(8):877-924.
[4]Kim JH,Sohn HJ,Hwang WS,et al. In vitro isolation and characterization of bovine Neospora caninum in Korea[J].Vet Parasitol,2000,90(1/2):147-154.
[5]Ooi HK,Huang CC,Yang CH,et al. Serological survey and first finding of Neospora caninum in Taiwan,and the detection of its antibodies in various body fluids of cattle[J].Vet Parasitol,2000,90(1/2):47-55.
[6]Nishikawa Y,Tragoolpua K,Makala L,et al.Neospora caninum NcSRS2 is a transmembrane protein that contains aglycosylphosphatidy linositol anchor in insect cells[J].Vet Parasitol,2002,109(3/4):191-201.
[7]Hemphill A,Gottstein B,Kaufmann H.Adehesion and invasion of bovine endothelial cells by Neospora caninum[J].Parasitol,1996,112(2):183-197.
[8]SON E S,Ahn H J,Kin J H,et al.Determination of antigenic domain in GST fused major surface protein(Nc-p43)of Neospora caninum[J].The Korean Journal of Parasitology,2001,39(3):241-246.

