腹腔冲洗液BNIP3基因甲基化与胃癌患者腹膜微转移及疾病的相关性研究
王银玲,王亿龙,王齐晖,李花,周立平,李富顺
(中国医科大学附属第一医院1.检验科;2.肿瘤放射治疗科,沈阳 110001)
胃癌是最常见的消化道恶性肿瘤,其死亡率占恶性肿瘤死亡率的第一位[1],尽管行胃癌根治术后,5年生存率仅为35%,而且术后转移和复发较为常见,其中腹膜转移最常见,约占总复发的30%~50%[2]。腹腔冲洗细胞学(peritoneal lavage cytology,PLC)检查方法是目前最常用的腹腔脱落细胞学检测方法,但该细胞学检查灵敏性较低,很难早期发现腹腔内脱落的癌细胞[3,4]。
近年来随着寡核苷酸芯片技术的发展,应用甲基化特异的聚合酶链式反应(methylation-specific polymerase-chain reaction,MSP)方法检测微量肿瘤相关基因,使肿瘤微转移的检测成为可能。BNIP3是BCL-2蛋白家族促凋亡成员,属于典型的抑癌基因,该基因启动子区甲基化状态改变是肿瘤发生发展的关键因素之一。本研究应用MSP方法检测胃癌组织及腹腔冲洗液中游离细胞BNIP3基因启动子区甲基化,探讨其在胃癌腹膜微转移诊断中的应用价值。
1 材料与方法
1.1 临床资料
以我院2008年1月至2010年1月在肿瘤外科手术治疗的80例胃癌患者为研究对象,其中男48例,女32例,年龄31~79岁,平均51.4岁。术前胃镜检查及病理确诊为胃癌,术前均未行放化疗。临床病理指标及PS因素均按日本胃癌病理规约标准[5],即 P(+):肉眼腹膜转移;S(+):显微镜下浆膜受侵。本研究所有患者均自愿加入并签署知情同意书。
1.2 方法
1.2.1 标本采集:术中仔细止血,若已有腹水,直接吸出100 mL,若无腹水,于Douglas窝、左膈下置入16号导尿管注入生理盐水100 mL,轻轻搅动后吸出,于0℃下1 200 r/min离心10 min弃上清液,离心后取沉淀,均分成两份,一部分行伊红染色(HE),另一部分沉渣标本于-80℃下保存以备DNA提取。
1.2.2 提取基因组DNA:苯酚氯仿方法提取组织及腹腔冲洗液基因组DNA,乙醇沉淀。DNA浓度根据紫外分光光度计(260 nm)吸光度确定,并根据260∶280 nm吸光度比值确认DNA纯度。提取DNA-80℃保存备用。
1.2.3 MSP:取 1 μg基因组 DNA,65℃重亚硫酸盐处理 12 h(CpGennome DNA Modification Kit,Intergen,美国),处理基因组DNA(具体方法按说明书),保存于-80℃备用;使用基因BNIP3甲基化引物和非甲基化引物行PCR扩增,引物序列如下:甲基化引物,5′-TAGGATTCGTTTCGCGTACG-3′(sense),5′-ACCGCGTCGCCCATTAACCGCG-3′(antisense);非甲 基 化 引 物 ,5′-TAGGATTTGTTTTGTGTATG-3′(sense),5′-ACCACATCACCCATTAACCACA-3′(antisense)。反应体系包括重亚硫酸盐处理后模板DNA 2 μL,BNIP3相应的甲基化和非甲基化特异性引物各 0.5 μL,去离子水 16.875 μL、10×PCR 缓冲液(含15 mmol/L MgCl2)2.5 μL、dNTP 混合物 2.5 μL、Taq DNA 聚合酶(Ampli Taq Enzyme,Roche,美国)0.125 μL等,总反应体系25 μL。扩增条件为95℃变性10 min;94℃变性 1 min,59℃退火 1 min,72℃延伸1 min,共35个循环。取PCR产物10 μL,3%琼脂糖凝胶电泳,用GDS8000(UVP,美国)凝胶成像仪拍照分析。
1.3 统计学分析
所有资料采用SPSS 13.0软件进行分析。计数资料组间比较采用Fisher精确概率法,P<0.05为差异有统计学意义。
2 结果
2.1 BNIP3基因启动子区异常甲基化
80例胃癌组织及相应癌旁组织,胃癌组、癌旁组BNIP3基因启动子区甲基化阳性率分别为83.75%(67/80)、13.75%(11/80),差异有统计学意义(P<0.05,见表 1。
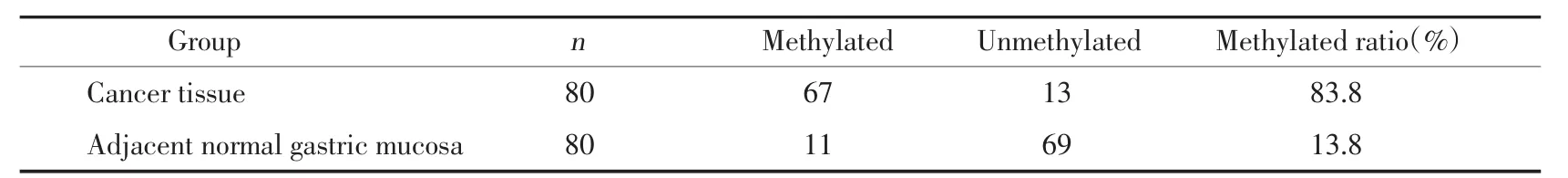
表1 胃癌组织与癌旁组织BNIP3甲基化阳性率Tab.1 Methylated ratio ofBNIP3in cancer tissues and noncancerous tissues
2.2 腹腔冲洗液中BNIP3基因启动子区甲基化与胃癌病理特征的关系
如表2所示,BNIP3甲基化阳性率在PTNM分期、淋巴结转移,肿瘤浸润深度间比较,统计分析显示差异均有统计学意义(P<0.05):随着临床分期的增加,BNIP3甲基化阳性率明显升高;有淋巴结转移的患者的甲基化率为88.9%,较未转移的患者阳性率明显升高;PS因素与BNIP3甲基化阳性率的关系显示,在浆膜受侵S(+)及肉眼可见腹膜转移P(+)的14例中,BNIP3甲基化阳性率为100%,同时随着肿瘤浸润深度的增加,BNIP3甲基化阳性率也明显增加。
2.3 MSP法检测腹腔冲洗液肿瘤相关基因BNIP3甲基化阳性率与PLC法检测腹腔冲洗液脱落癌细胞的阳性率
80例胃癌患者腹腔冲洗液中,同时用MSP法检测BNIP3甲基化和PLC法检测脱落癌细胞:PLC阳性23例,MSP检测BNIP3甲基化阳性58(58/80)例,且PLC检测阳性者MSP法检测均为阳性,MSP法检测阴性者中无PLC阳性,MSP法检测腹腔冲洗液肿瘤相关基因BNIP3甲基化阳性率显著高于PLC法,差异有统计学意义(P<0.05),见表3。
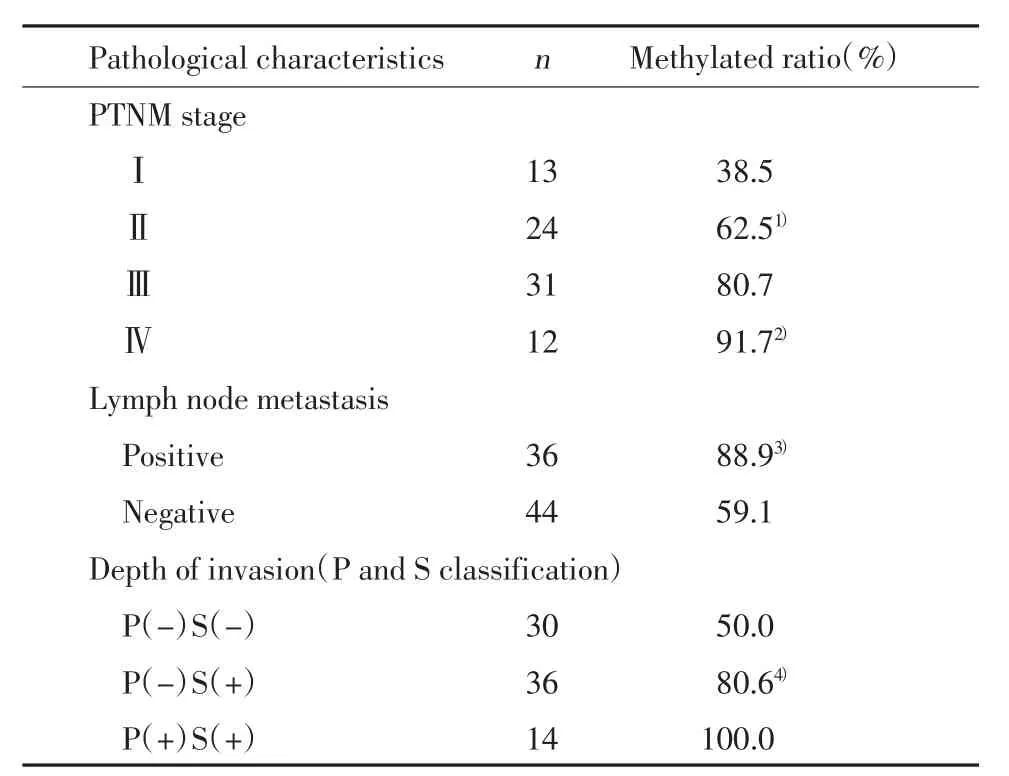
表2 腹腔冲洗液BNIP3甲基化状态与胃癌病理特征的关系Tab.2 Relationship between the methylation status ofBNIP3and pathological characteristics in peritoneal wash samples

表3 MSP法与PLC法检测腹腔冲洗液的结果Tab.3 Results of MSP and PLC tested in peritoneal wash samples
3 讨论
胃癌术后的复发与转移是胃癌患者死亡的主要原因,尤以腹膜微转移最常见,多由腔内游离癌细胞和残余微小转移灶的存在导致[6]。有研究[7]认为,腹腔内游离癌细胞是腹膜转移的先决条件,是影响胃癌预后的独立危险因素之一。因此早期发现腹腔内游离的癌细胞并给予有效的阻断治疗,是改善胃癌患者预后、提高疗效的关键。
目前临床上常用的检测方法是PLC,但其敏感性较低,近年来随着寡核苷酸芯片技术的发展,应用MSP法检测微量肿瘤相关基因甲基化,大大提高了检测的灵敏度。本研究资料显示80例胃癌患者腹腔冲洗液中,PLC检测阳性者MSP法检测均为阳性,MSP法检测阴性者中无PLC阳性,MSP法检测腹腔冲洗液肿瘤相关基因BNIP3甲基化阳性率(72.5%)显著高于PLC法检测脱落癌细胞阳性率(28.75%)。由此可见应用MSP法检测腹腔冲洗液BNIP3甲基化可作为胃癌早期微转移的辅助诊断方法之一。
已有研究报道人体组织细胞中BNIP3基因异常甲基化与该基因沉默及胃肠肿瘤的发生密切相关[8]。但国内尚未见腹腔冲洗液中游离细胞BNIP3基因异常甲基化与疾病进展的研究报道。本研究显示胃癌组织的BNIP3甲基化阳性率显著高于癌旁组织,提示BNIP3基因甲基化与胃癌密切相关。分析其机制可能为[9,10]:(1)BNIP3 编码产物含有凋亡效应结构域和跨膜结构域,属于促凋亡家族成员,能与BCL-2,BCL-XL,EIB19k等抗凋亡蛋白相互作用,促进细胞凋亡。故BNIP3不表达或弱表达导致凋亡信号通路受阻,从而导致恶性肿瘤的发生、发展。(2)DNA甲基化调控该基因的转录水平(可在转录起始阶段),即通过基因启动子及其附近区域内CpG岛胞嘧啶的甲基化关闭某种组织或细胞不必需的基因,如肿瘤抑制基因,细胞周期调节基因,抑制肿瘤转移和浸润基因等,进而导致细胞增殖和分化的相关基因表达异常,造成细胞失去对正常过程的控制而发生恶变形成肿瘤。
本研究首次对胃癌患者腹腔冲洗液游离细胞BNIP3基因甲基化进行检测,结果提示腹腔冲洗液BNIP3异常高甲基化与疾病进展有关。
综上所述,应用MSP法检测腹腔冲洗液游离细胞BNIP3基因甲基化可作为早期预测胃癌腹膜微转移及评估疾病进展的有效手段。若能将传统细胞学检测方法与基因甲基化联合检测,可为早期发现胃癌微转移提供高敏感性、高特异性的辅助诊断,为评估患者的病情及选择合理的治疗方案提供科学依据。
[1]杨军,刘妮,康安静,等.TMEM16A在胃腺癌中的表达及意义[J].南方医科大学学报,2012,32(6):794-797.
[2]Yonemura Y,Bandou E,Kawamura T,et al.Quantitative prognostic indicators of peritoneal dissemination of gastric cancer[J].Eur J Surg Oncol,2006,32(6):602-606.
[3]Nakagawa S,Nashimoto A,Yabusaki H.Role of staging laparoscopy with peritoneal lavage cytology in the treatment of locally advanced gastric cancer[J].Gastric Cancer,2007,10(1):29-34.
[4]费建东,聂双发,梁峰.胃癌患者腹腔冲洗液中CEAmRNA及DDCmRNA表达对判断腹腔微转移的临床意义[J].现代预防医学,2011,38(24):5024-5028.
[5]Japanese Gastric Cancer Association.Japanese classification of gastric carcinoma-2nd English edition[J].Gastric Cancer,1998,1(1):10-24.
[6]Harrison LE,Choe JK,Goldstein M,et al.Prognostic significance of immuneoh-istochemical micrometastases in node negative gastric cancer patients[J].J Surg Oncol,2004,73(3):153-157.
[7]杨宁,王文秀,赫文,等.免疫磁珠技术检测胃癌患者腹腔微小转移的研究[J].哈尔滨医科大学学报,2006,40(6):486-488.
[8]Murai M,Toyota M,Suzuki H,et al.Aberrant methylation and silencing of the BNIP3 gene in colorectal and gastric cancer[J].Clin Cancer Res,2005,11(3):1021-1027.
[9]李严,程宏伟.BNIP3基因与人类肿瘤的关系[J].安徽医学,2010,31(3):295-297.
[10]李能连,张煦,樊平,等.BNIP3在胃癌中的表达及意义[J].兰州大学学报,2007,33(1):40-42.

