局灶性缺血预处理对大鼠脑梗死区周围Toll样受体4及核因子-κB表达的影响
胡晓松,唐 瑜,李 娟,刘馨莲,孙 静
临床上许多疾病均可导致脑缺血的发生,随着对脑缺血疾病研究的逐渐深入,脑缺血耐受 (brain ischemic tolerance,BIT)现象越来越受到人们的关注。目前认为给予1次或多次短暂、轻微 (亚致死量)的缺血缺氧刺激即脑缺血预处理(CIP),可作为一种损伤性应激原刺激而有效调动机体自身的内源性保护机制,从而诱导BIT的发生,增加机体对下一次严重损伤的抵抗能力,但其作用机制目前仍不明了[1-2]。
Toll样受体 (Toll-like receptors,TLRs)是一个介导天然固有免疫的古老家族,在感染性炎症中扮演着重要角色。近来研究发现TLR4介导的信号通路,在非病原性炎症中亦占有重要地位。本实验通过研究TLR4及其靶基因蛋白核蛋白印迹法因子-κB(NF-κB)在CIP后脑缺血梗死区周围的表达变化,旨在探讨该信号通路在BIT诱导机制中的可能作用。
1 材料与方法
1.1 实验动物及分组 健康7~8周的SD雄性大鼠,清洁级,体质量250~300 g,共45只。采用随机数字表法将大鼠分为3组,CIP组:给予CIP 20 min,3 d后给予大脑中动脉阻塞(MCAO)2 h,再灌注6 h、24 h、72 h;MCAO组:未行CIP,单纯暴露动脉处的解剖结构20 min(假手术),余同CIP组;Sham组:两次均为假手术,均暴露解剖结构,未进行缺血处理。每组各时间点5只。
1.2 动物模型的制备 参照并改良局灶-局灶性脑缺血预处理模型[3]制备方法,大鼠术前12 h禁食不禁水,以4%水合氯醛腹腔内注射麻醉 (7.5 ml/kg),置仰卧位,于颈部行长约25.0 mm常规纵行切口。暴露并钝性游离右侧颈总动脉(CCA)、颈内动脉 (ICA)及颈外动脉 (ECA),结扎ECA远侧端,动脉夹夹闭CCA近心端,在结扎线近端距分叉5.0 mm处剪一约0.2 mm小口。取浸于2.5×106U/L肝素钠的长6.0 cm、直径0.26 mm、头端圆钝的尼龙线从ECA残端插入,经CCA分叉部进入ICA(19.0±0.5)mm,直至感觉有阻力时,结扎ECA近心端。20 min后轻轻抽出栓线约10 mm形成第1次再灌注,固定尼龙线并全层缝合切口。3 d后再次麻醉大鼠,找到ECA结扎处,重新剪口插线阻断大脑中动脉(MCA),结扎ECA,并留置长约4.0 cm的尼龙线于体外,缝合皮肤。2 h后抽出栓线,形成第2次再灌注。
1.3 神经病学评分及MCAO模型成功的判断标准 参照Longa等[4]神经病学评分标准:0分:无神经功能缺损症状;1分:轻度局灶性神经功能缺损 (不能完全伸展右前肢);2分:中度神经功能缺损 (向右侧转圈);3分:重度神经功能缺损(向右侧倾倒);4分:不能自发行走,意识水平降低。MCAO模型成功标准:动物出现神经功能缺损,无烦躁不安、抬头狂体征,评分为1~3分。
1.4 取材制片 大鼠脑缺血2 h,于再灌注预定时间点麻醉后,用0.9%氯化钠溶液快速冲洗血管,迅速断头取脑,立即置于-20℃冰箱冷冻10 min,用脑切片器按2.0 mm厚度切片,选取距前囟点 (Bregma)0.6~1.4 mm的脑片行免疫组织化学染色。4%多聚甲醛固定12~24 h后行脱水、透明、石蜡包埋。切片厚度5 μm。其余脑片行0.1%四氮唑红 (TTC)染色。
1.5 脑梗死体积比测定 将脑片浸入37℃的TTC染色后[5],置于4%多聚甲醛中固定6 h。正常组织染成深红色,梗死灶呈苍白色。将固定的脑片按顺序排列。拍照脑片前后两面后输入计算机,根据所测各脑片厚度以及梗死面积 (用于免疫组织化学的脑片的梗死面积和脑片面积分别以紧邻其前后脑片的平均值近似计入)和脑片面积计算出梗死体积和前脑体积的近似值,得出TTC染色为苍白区 (梗死区)占前脑体积的百分比。
1.6 免疫组织化学染色 免疫组织化学染色采用即用型二步法,TLR4(1∶200,Abcam 公司) 及 NF - κB/P65(1∶500,Abcam公司),二步法试剂PV-6002由北京中杉金桥生物公司 (美国Zymed公司分装产品)提供。阴性对照用正常血清代替一抗。
1.7 蛋白印迹法 (Western blot)检测 Western blot测定TLR4及NF-κB表达,取保存于液氮中的缺血半影区脑组织100 mg,剪碎,Radio免疫沉淀反应分析 (RIPA)裂解液裂解后冰浴下玻璃匀浆器中匀浆,离心半径6.8 cm,12 000 r/min 4℃离心15min,取上清。Bradford法蛋白定量,每孔加样量30 μg,7.5%SDS-PAGE电泳;蛋白转膜至聚偏二氟乙烯膜(PVDF),5%牛血清清蛋白 (BSA)的吐温三羟甲基氨基甲烷缓冲液 (TBS/T)室温封闭1 h,加兔抗大鼠TLR4(1∶100)、兔抗大鼠 NF-κB(1∶200)和兔抗大鼠 β-actin抗体(1∶1 000),4℃反应过夜;取膜,TBS/T洗5 min×3次,加辣根过氧化物酶 (HRP)标记的羊抗兔IgG二抗孵育;电化学发光剂 (ECL)显影,图像使用Total Lab软件灰度扫描,计算目的蛋白 (TLR4及NF-κB)与内参蛋白β-actin吸光度的比值。以上实验重复3次,取均值。
1.8 图像分析及统计学方法 阳性表达为结构完整、定位明确的着色较深 (棕褐色)的细胞。切片在统一放大倍数 (40×10)下,随机选6个视野,输入Image pro-plus 6.0图像分析系统,记取平均阳性细胞数。计量资料以 (±s)表示,两组比较采用t检验,多组比较采用方差分析,两两比较采用q检验;以P<0.05为差异有统计学意义。
2 结果
2.1 脑梗死体积比 Sham组未见梗死灶。MCAO组脑梗死灶位于基底节区靠近纹状体外侧区域及额顶部外侧皮质。CIP组和MCAO组TTC染色均可见正常脑组织被染成红色,而梗死区域呈苍白色。梗死区与周围正常脑组织界限清晰。结果显示再灌注24 h、72 h时,CIP组脑梗死体积比与MCAO组比较,差异均有统计学意义 (P<0.05,见表1)。
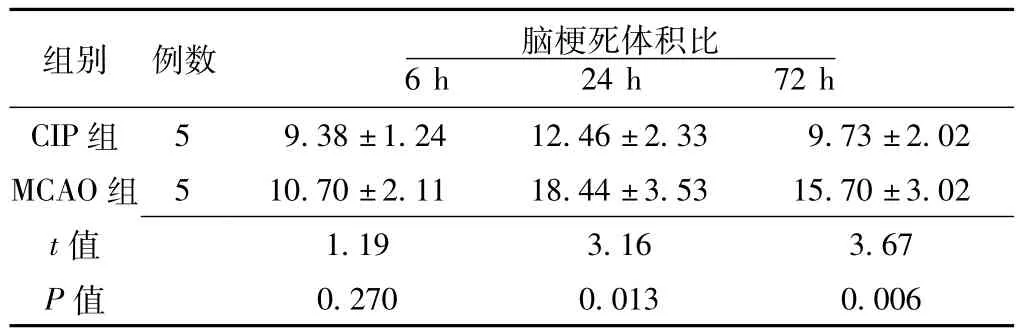
表1 CIP组与MCAO组脑缺血再灌注不同时间点脑梗死体积比比较(x ± s,%)Table 1 Comparison of brain infarct volume at different time after reperfusion between CIP group and MACAO group
2.2 免疫组化染色 TLR4、NF-κB阳性细胞主要表达于缺血侧胼胝体、纹状体、大脑皮质等处的神经胶质细胞及神经元。Sham组仅见微血管壁及脉络丛上皮、室管膜上皮等处的弱表达,TLR4阳性表达产物在细胞质。再灌注6 h起,MCAO组即见TLR4明显表达,并达高峰。TLR4胶质细胞样阳性细胞可见核肿胀及较短突起 (见图1);NF-κB阳性表达产物在细胞核或细胞质,表达高峰于再灌注24 h出现。3组不同再灌注时间点的TLR4及NF-κB阳性细胞数比较,差异均有统计学意义 (P<0.05);其中MCAO组及CIP组各再灌注时间点TLR4及NF-κB阳性细胞数与Sham组比较,差异均有统计学意义 (P<0.01);CIP组各再灌注时间点TLR4及NF-κB阳性细胞数与MCAO组比较,差异亦均有统计学意义 (P<0.01,见表2)。
2.3 Western blot检测结果 TLR4蛋白表达高峰出现于再灌注后6 h,而NF-κB则出现于再灌注后24 h(见图2)。CIP组各再灌注时间点TLR4及NF-κB蛋白表达的相对吸光度值与MCAO组比较,差异均有统计学意义 (P<0.01,见表3)。
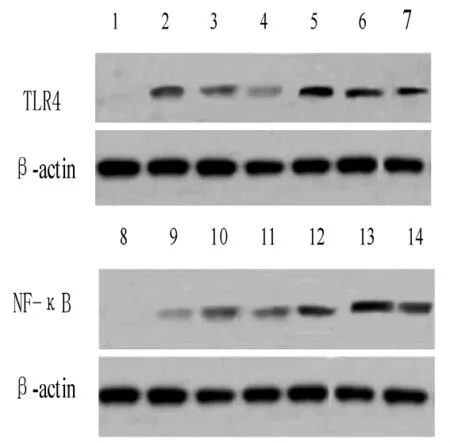
图2 不同再灌注时间点TLR4及NF-κB蛋白表达 (Western blot检测)Figure 2 Expressions of TLR4 and NF-κB protein detected by Western blot at different time after reperfusion
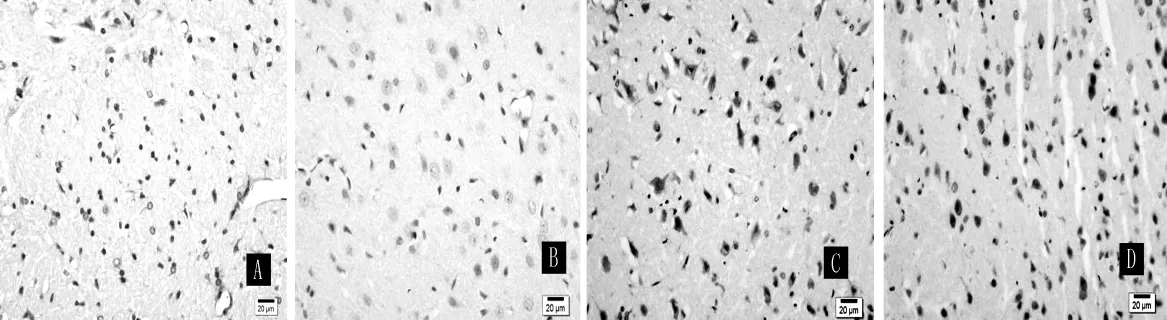
图1 缺血再灌注24 h时脑梗死区周围的TLR4及NF-κB表达情况 (×400)Figure 1 Expressions of TLR4 and NF-κB around infarct area at 24 h after cerebral ischemia-reperfusion
表2 3组大鼠不同再灌注时间点TLR4及NF-κB阳性细胞数比较 (±s)Table 2 Comparison of numbers of TLR4 and NF-κB positive cells at different time after reperfusion in three groups
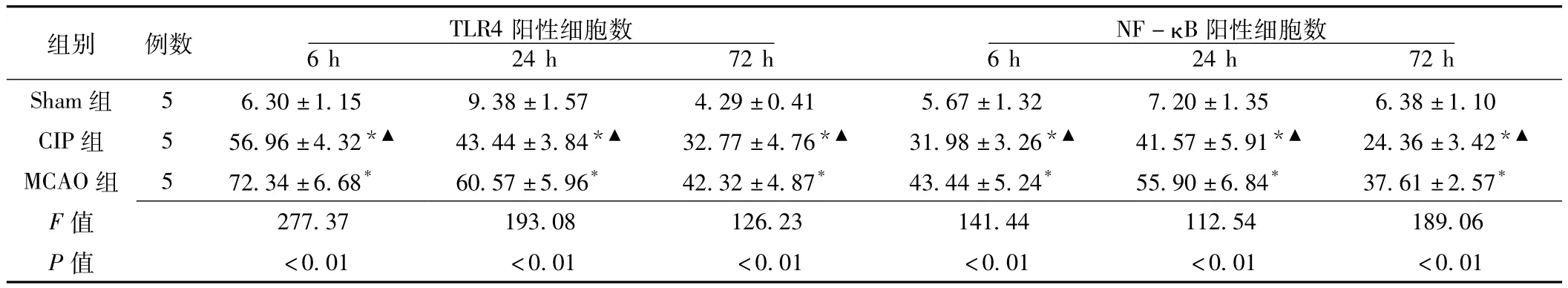
表2 3组大鼠不同再灌注时间点TLR4及NF-κB阳性细胞数比较 (±s)Table 2 Comparison of numbers of TLR4 and NF-κB positive cells at different time after reperfusion in three groups
注:与Sham组比较,*P<0.01;与MCAO组比较,▲P<0.01
组别 例数 TLR4阳性细胞数NF-κB阳性细胞数6 h 24 h 72 h Sham组 5 6.30±1.15 9.38±1.57 4.29±0.41 5.67±1.32 7.20±1.35 6.38±1.10 6 h 24 h 72 h CIP组 5 56.96±4.32*▲ 43.44±3.84*▲ 32.77±4.76*▲ 31.98±3.26*▲ 41.57±5.91*▲ 24.36±3.42*▲MCAO组 5 72.34±6.68* 60.57±5.96* 42.32±4.87* 43.44±5.24* 55.90±6.84* 37.61±2.57*F 277.37 193.08 126.23 141.44 112.54 189.06 P值值<0.01 <0.01 <0.01 <0.01 <0.01 <0.01
表3 CIP组与MCAO组不同再灌注时间点TLR4及NF-κB蛋白表达的相对吸光度值比较 (±s)Table 3 Comparison of relative absorbance values of TLR4 and NF-κB protein at different time after reperfusion between CIP group and MACAO group
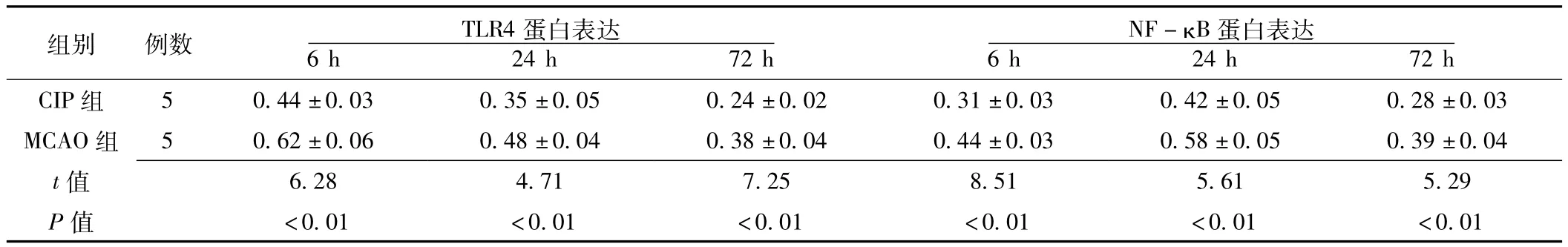
表3 CIP组与MCAO组不同再灌注时间点TLR4及NF-κB蛋白表达的相对吸光度值比较 (±s)Table 3 Comparison of relative absorbance values of TLR4 and NF-κB protein at different time after reperfusion between CIP group and MACAO group
组别 例数 TLR4蛋白表达NF-κB蛋白表达42±0.05 0.28±0.03 MCAO组 5 0.62±0.06 0.48±0.04 0.38±0.04 0.44±0.03 0.58±0.05 0.39±0.04 t 6 h 24 h 72 h CIP组 5 0.44±0.03 0.35±0.05 0.24±0.02 0.31±0.03 0.6 h 24 h 72 h 6.28 4.71 7.25 8.51 5.61 5.29 P值值<0.01 <0.01 <0.01 <0.01 <0.01 <0.01
3 讨论
BIT是机体对内外环境损伤刺激固有的应激和防御反应,也是迄今已知的内源性保护机制中作用最强大的,但其发生机制仍未阐明。近来,随着TLRs在炎症研究领域的不断深入,TLRs信号通路在BIT中的作用也逐渐得到重视。目前已分别在人类及小鼠中发现11种、13种TLRs[6],TLR4作为“门户”蛋白启动机体的炎症链式反应,在Ⅰ型跨膜信号转导受体家族TLRs中扮演着重要角色。TLR4通过与接头蛋白MyD88及白介素 (IL)相关激酶 (IRAKs)的结合,可促使NF-κB移位,启动与天然免疫及炎症相关基因的转录,从而激活TLR4-MyD88依赖性的信号传导通路[7]。
NF-κB是一种广泛存在于真核细胞中的转录因子,属于Rel蛋白家族,是多种损伤反应基因的多效调节因子。在静息细胞中,它常与其抑制性蛋白I-κB结合存在于细胞质内。各种刺激引起I-κB磷酸化并被降解,导致I-κB与NF-κB解聚,引起NF-κB被激活并发生核转位。活化的NF-κB通常以环状的p65/p50异二聚体的形式进入细胞核,结合至DNA上的相应位点,调控下游含有NF-κB结合序列的靶基因的转录表达[8-9],引起 IL-1、IL -6、IL -12、IL -8、肿瘤坏死因子α(TNF-α)及干扰素γ(IFN-γ)等细胞因子的释放,并调节谷氨酸盐受体,促进细胞凋亡、细胞内钙超载、血-脑脊液屏障破坏等脑缺血损伤过程[10-14]。
本研究表明CIP能够明显减轻缺血再灌注24 h及72 h的脑梗死体积,20 min CIP可诱导BIT的发生,从而发挥对第2次脑缺血再灌注损伤的内源性神经保护作用。然而,本实验也发现CIP并未导致再灌注6 h时的脑梗死体积比降低,我们推测这种迟滞现象可能与缺血半影区中星形胶质细胞的功能恢复、某些生成抗炎因子 (如IL-10等)的基因激活、局部血液循环的改善等均需一定的时程有关。
一般认为,非致死性的CIP刺激首先引起轻度的细胞和细胞外基质的损伤,释放少量内源性配体,轻度激活TLR4信号通路,导致少量炎性递质释放,诱发轻微炎症反应,同时上调抗炎因子、诱饵受体等的表达,抑制第2次严重脑缺血所诱发的强烈炎症反应[15]。在药物诱导BIT的研究中,有报道提示Oxymatrine等可通过下调TLR4、上调ERK信号通路发挥脑保护作用[16-17]。本实验免疫组织化学染色及Western bolt检测结果显示CIP组各时间点TLR4与NF-κB阳性细胞数及相对吸光度值均明显低于MCAO组同时间点相应各值,证实CIP可明显抑制TLRs炎症信号通路中的两种重要蛋白TLR4与NF-κB的激活,结果表明该信号通路在BIT的发生过程中扮演着重要作用。此外,本研究也发现随着脑缺血再灌注时间延长,TLR4蛋白与NF-κB的表达到达高峰的时间并不一致,TLR4在再灌注早期 (6 h)即达高峰,而NF-κB在再灌注后24 h才到达峰值,这可能主要与TLR4作为NF-κB的上游受体需先行激活有关。此外,是否存在其他炎性受体如TLR2、TLR9激活导致炎性因子NF-κB等大量表达的可能性,尚需进一步的研究。
1 Béjot Y,Aboa - Eboulé C,Marie C,et al.Neuroprotective effect of transient ischemic attack [J].Presse Med,2011,40(2):167 -172.
2 Prasad SS,Russell M,Nowakowska M,et al.Neuroprotection induced in vitro by ischemic preconditioning and postconditioning:modulation of apoptosis and PI3K - Akt pathways[J].J Mol Neurosci,2011,43(3):428-442.
3 郝玉曼,罗祖明,周东.局灶预缺血诱导脑缺血耐受的动物模型[J].中风与神经疾病杂志,2003,20(2):129-131.
4 Longa EZ,Weinstein PR,Calson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
5 Joshi CN,Jain SK,Murthy PS,et al.An optimized triphenyltetrazolium chloride method for identification of cerebral infarcts[J].Brain Res Brain Res Protoc,2004,13(1):11-17.
6 Arumugam TV,Okun E,Tang SC,et al.Toll-like receptors in ischemia-reperfusion injury[J].Shock,2009,32(1):4-16.
7 Hayden MS,Ghosh S.NF - κB in immunobiology [J].Cell Res,2011,21(2):223- 244.
8 Zheng C,Yin Q,Wu H,et al.Structural studies of NF-κB signaling[J].Cell Res,2011,21(1):183 -195.
9 Harari OA,Liao JK.NF-κB and innate immunity in ischemic stroke[J].Ann N Y Acad Sci,2010,1207:32 -40.
10 Bigdeli MR,Khoshbaten A.In vivo preconditioning with normobaric hyperoxia induces ischemic tolerance partly by triggering tumor necrosis factor-alpha converting enzyme/tumor necrosis factor-alpha/nuclear factor-kappaB [J].Neuroscience,2008,153(3):671 -678.
11 Wang T,Gu J,Wu PF,et al.Protection by tetrahydroxystilbene glucoside against cerebral ischemia:involvement of JNK,SIRT1,and NF-kappaB pathways and inhibition of intracellular ROS/RNS generation[J].Free Radic Biol Med,2009,47(3):229-240.
12 Schwaninger M,Inta I,Herrmann O.NF-kappaB signaling in cerebral ischemia[J].Biochem Soc Trans,2006,34(Pt 6):1291 -1294.
13 Bi X,Yan B,Fang S,et al.Quetiapine regulates neurogenesis in ischemic mice by inhibiting NF-kappaB p65/p50 expression[J].Neurol Res,2009,31(2):159-166.
14 Pradillo JM,Fernández - López D,García - Yébenes I,et al.Tolllike receptor 4 is involved in neuroprotection afforded by ischemic preconditioning[J].J Neurochem,2009,109(1):287-294.
15 Hickey E,Shi H,Van Arsdell G,et al.Lipopolysaccharide-induced preconditioning against ischemic injury is associated with changes in toll-like receptor 4 expression in the rat developing brain[J].Pediatr Res,2011,70(1):10-14.
16 Li M,Zang X,Cui L,et al.The neuroprotection of oxymatrine in cerebral ischemia/reperfusion is related to nuclear factor erythroid 2-related factor 2(nrf2) -mediated antioxidant response:role of nrf2 and hemeoxygenase- 1 expression [J].Biol Pharm Bull,2011,34(5):595-601.
17 Qiao H,Zhang X,Zhu C,et al.Luteolin downregulates TLR4,TLR5,NF-κB and p-p38MAPK expression,upregulates the p-ERK expression,and protects rat brains against focal ischemia [J].Brain Res,2012,1448:71-81.

