冠状动脉微栓塞后Toll样受体4的变化
常书福 马剑英 钱菊英 陈章炜 姚瑞明 葛均波
(复旦大学附属中山医院心内科,上海市心血管病研究所,上海 200032)
冠状动脉斑块破裂或血栓脱落等引起的冠状动脉微栓塞(coronary microembolization,CME)可导致心肌缺血、坏死,引起重度心律失常、心室收缩功能障碍[1]。本研究采用冠状动脉介入方法建立的猪CME模型,探讨CME后Toll样受体4(Toll-like receptor 4,TLR4)的变化情况。
1 资料与方法
1.1 实验动物 12周龄的健康小型家猪12头,体质量21~25 kg,实验组和对照组各6头。
1.2 微栓塞球制备 取直径42μm的微栓塞球10~15μL(Dyno公司,挪威),放入1.5 mL离心管中,管中再加入1 mL弱0.9%氯化钠液,显微镜下计数;然后取15万个微球放入60 mL离心管中,加入0.9%氯化钠液配成40~45 mL悬液。每次使用前剧烈震荡5s,将悬液抽入60 mL注射器内,然后用5 mL0.9%氯化钠液冲洗2次。
1.3 动物模型建立 肌内注射氯胺酮(5 mg/kg),以地西泮(10 mg/kg)和阿托品(0.08 mg/kg)诱导麻醉后,用3%戊巴比妥维持麻醉。建立耳静脉通道,滴注0.9%氯化钠液。分离右侧股动脉,置入7F动脉鞘,经鞘管首剂给予肝素200 U/kg,此后每1 h静脉注射肝素100 U/kg,维持肝素化。
用数字减影血管造影仪行冠状动脉造影,送入7F EBU3.5指引导管至左冠状动脉口,确定前降支位置及分布。送入微导管(3.0/2.8F)至前降支中段,经微导管将微栓塞球悬液注入前降支内,再用10 mL0.9%氯化钠液冲洗微导管并注入冠状动脉内,制成CME动脉模型(研究组)。对照组则在其前降支注入等量的0.9%氯化钠液。然后两组再次行冠状动脉造影。
1.4 样本采集和分析
1.4.1 样本采集 1周后静脉注射30%氯化钾30 mL,处死CME模型猪,取出心脏,平行于房室沟切块,前壁、后壁各取5块质量为50~100 mg的心肌组织,液氮冷冻后移入-70℃冰箱,用于RNA及蛋白分析。
1.4.2 蛋白质印迹(Western-blot) 取50~100 mg心肌组织,提取蛋白并用二可辛酸(bicinchonininc acid,BCA)法定量,聚丙烯酰胺凝胶电泳等。TLR4抗体购自Santa Cruz公司。
1.4.3 实时聚合酶链反应(real-time polymerase chain reaction) 取50~100 mg心肌组织,提取其RNA后进行逆转录;外源性TLR4、内参GAPDH均由上海生工公司合成,TLR4引物序列正义链及反义链分别为5′-CTCTGCCTTCACTACAGAGA-3′和5′-CTGAGTCGTCTCCAGAAGAT-3′,GAPDH引物序列正义链、反义链分别为5′-TCATCAGCAATGCCTCCTGTACCA-3′和 5′-TATTTGGCAGGTTTCTCCAGACGG-3′。 扩 增 方 案:94℃加热5 min;然后94℃加热30 s、55℃加热30 s、72℃加热30 s,循环进行40次;72℃延伸10 min。
1.5 统计学处理 采用SPSS 15.0软件进行统计分析。2组之间比较采用两独立样本的t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 心肌组织TLR4蛋白水平 猪心肌组织TLR4蛋白水平见图1。CME1周后实验组心肌组织前壁TLR4蛋白水平显著高于后壁(P<0.05)。而对照组前壁、后壁TLR4蛋白水平和CME组后壁相比,差异无统计学意义,见表1。
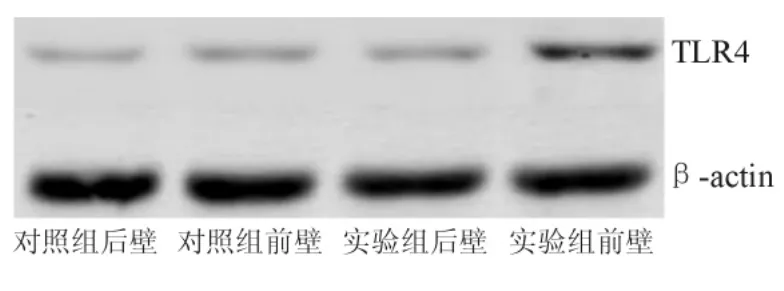
图1 猪心肌组织中TLR4蛋白水平
2.2 心肌组织TLR4 mRNA水平 猪心肌组织TLR4 mRNA水平见表1。CME1周后实验组心肌组织前壁TLR4 mRNA水平显著高于后壁(P<0.05);而对照组前壁、后壁TLR4 mRNA水平与CME组后壁相比,差异无统计学意义。
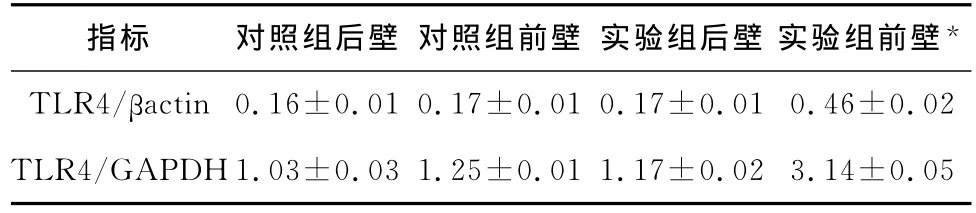
表1 猪心肌组织中TLR4蛋白水平
3 讨 论
CME后会引发局灶性心肌微梗死和一过性心肌收缩功能障碍,但1周左右可恢复[2-3]。由于冠状动脉微血管网丰富,多处心肌坏死可引起局部心肌收缩功能障碍,但这并不是导致心肌收缩功能减弱的主要原因[2]。目前认为,炎性反应是CME后心功能变化的主要发生机制[4]。
TLRs家族在病原体的识别和激活天然免疫方面发挥着非常重要的作用。激活的TLRs不仅可以诱导天然免疫应答,而且有利于特异性免疫反应发生。TLR4在体内分布广泛,分布于心肌中的TLR4与心血管疾病关系密切[5]。心力衰竭的病理机制复杂,炎性反应也参与了这一过程。在心力衰竭的动物模型和患者中,TLRs被激活,且其分布形态发生了变化。在正常大鼠和人心肌中,TLR4弥散分布,主要分布在心肌内;而在心力衰竭患者中,TLR4呈局灶性聚集分布[6]。
本研究发现,心肌TLR4表达在CME1周后显著升高,而后壁与对照组前后壁无显著差异,提示TLR4可能参与了CME后的炎性反应。
[1] Stenberg TA,Steigen T,Myrmel T.Microvascular occlusions and coronary microembolization[J].Scand Cardiovasc J,2011,45(5):258-260.
[2] Dorge H,Schulz R,Belosjorow S,et al.Coronary microembolization:the role of TNF-αin contractile dysfunction[J].J Mol Cell Cardiol,2002,34(1):51-62.
[3] Ma J,Qian J,Ge J,et al.Changes in left ventricular ejection fraction and coronary flow reserve after coronary microembolization[J].Arch Med Sci,2012,8(1):63-69.
[4] Heusch G,Kleinbongard P,Bose D,et al.Coronary microembolization from bedside to bench and back to bedside[J].Circulation,2009,120(18):1822-1836.
[5] Lee CC,Avalos AM,Ploegh HL.Accessory molecules for Toll-like receptors and their function[J].Nat Rev Immunol,2012,12(3):168-179.
[6] Frantz S,Kobzik L,Kim YD,et al.Toll4(TLR4)expression in cardiac myocytes in normal and failing myocardium[J].J Clin Invest,1999,104(3):271-280.

