雷帕霉素和紫杉醇对骨髓内皮祖细胞数量及功能的影响
朱琳琳 陈绍良 张娟 刘志忠
(南京医科大学附属南京第一医院心内科,江苏 南京 210006)
内皮祖细胞(endothelial progenitor cells,EPCs)是血管内皮的前体细胞,存在于成年机体的骨髓及外周血中,在成体血管新生中起重要作用。雷帕霉素是一种大环内酯类抗生素,具有抗真菌、免疫抑制以及抗肿瘤作用。紫杉醇是一种抗增殖药物,具有抗肿瘤作用。在冠状动脉介入治疗术中应用雷帕霉素或紫杉醇药物洗脱支架,可显著降低支架内再狭窄的发生率。本研究旨在探讨雷帕霉素和紫杉醇对体外培养的大鼠骨髓来源的EPCs的数量及其增殖能力、迁移能力和黏附能力的影响。
1 资料与方法
1.1 实验动物与主要试剂 体质量为100 g左右的雄性SD(Sprague Dawley)大鼠10只,由南京医科大学动物实验中心提供。异硫氰酸荧光素标记的单叶豆凝集素1(FITC-BS-1 lectin)、雷帕霉素和紫杉醇购自SIGMA公司;DiI标记的乙酰化低密度脂蛋白(DiI-acLDL)购自 Molecular Probes公司。细胞培养液为DMEM(购自GIBCO公司),含10%胎牛血清(购自Hyclone公司)。
1.2 EPCs的分离和培养 将SD大鼠断颈处死,置于70%乙醇中20~30 min,无菌条件下分离大鼠的股骨和胫骨,去除附着于骨的软组织和骨骺端。将分离的股骨和胫骨移入无菌平皿,用5 mL磷酸缓冲液(PBS)将骨髓冲出,用200目滤网过滤骨髓并以2000 r/min离心5 min。将沉淀细胞重悬于10 mL含10%胎牛血清的DMEM培养液中,以2×106/孔接种于明胶包被的24孔培养板上,置于细胞培养箱中培养。接种后4 d用PBS冲洗去掉未贴壁细胞,更换培养液培养至7 d,再次用PBS冲洗去掉未贴壁细胞,得到贴壁细胞供后续实验用。
1.3 细胞染色及鉴定 将贴壁细胞随机分为7组:A 组:雷 帕 霉 素 5.0μg/mL;B 组:雷 帕 霉 素1.0μg/mL;C组:雷帕霉素0.1μg/mL;D组:紫杉醇5.0μg/mL;E组:紫杉醇1.0μg/mL;F组:紫杉醇0.1μg/mL;G组:对照组,加入溶剂二甲基亚砜(DMSO)。各组细胞在含相应浓度药物的10%胎牛血清的DMEM培养液中培养24 h。对贴壁细胞进行 DiI-acLDL和 FITC-BS-1 Lectin双标记,将染色双阳性者认定为EPCs。具体方法:细胞与DiI-acLDL(2.4μg/mL)在37℃下孵育1 h,观察EPCs对DiI-acLDL的摄取。然后以2%多聚甲醛固定细胞10 min,固定后用PBS浸洗,将FITC-BS-1 Lectin(10μg/mL)加于上述标本中,在37℃下孵育1 h后用激光共聚焦显微镜鉴定,双染色阳性细胞为正在分化的EPCs。采用倒置荧光显微镜进行计数(计数10个随机选择的×200视野的EPCs)。
1.4 EPCs黏附能力的检测 用0.25%胰蛋白酶消化贴壁细胞,将其悬浮于500μL培养液中,计数。每组以相同数目EPCs接种在明胶包被的培养板上,37℃下培养30 min后,计数贴壁细胞。
1.5 EPCs迁移能力的检测 采用改良的Boyden小室法分析。用0.25%胰蛋白酶消化,搜集贴壁细胞,将其悬浮于500μL培养液中,计数。每组将相同数目的EPCs悬浮于50μL培养液注入上室,下室分别加入DMSO、不同浓度的雷帕霉素和紫杉醇以及25μL培养液,37℃下培养24 h,小心刮去滤膜上层的未移动细胞,用甲醇固定,Giemsa染色,随机选择3个显微镜视野(×200),计数迁移至下层的细胞。
1.6 EPCs增殖能力的检测 将等量的EPCs接种于明胶包被的96孔培养板上,每孔加入10μL MTT(5 g/L),培养4 h后,去除上清液,再加入DMSO(150μL/孔),用微振荡器振荡10 min,用酶标仪于波长490 nm处测OD值。
1.7 统计学处理 采用SPSS16.0软件包进行分析。数据用均数±标准差表示,多组间比较采用单因素方差分析与两两比较,P<0.05为差异有统计学意义。
2 结 果
2.1 EPC的鉴定 将大鼠骨髓中分离获得的细胞培养7 d后,形成了梭形的内皮样细胞。用DiI-ac LDL和FITC-BS-1 Lectin对细胞染色后,通过激光共聚焦显微镜鉴定,DiI-ac LDL和FITC-BS-1 Lectin双染色阳性细胞被认为是正在分化的EPCs,并在倒置荧光显微镜200倍下计数10个随机选择的视野中的EPCs。
2.2 不同浓度雷帕霉素和紫杉醇对EPCs数量的影响 雷帕霉素及紫杉醇各组与对照组相比,EPCs数量均较少,差异有统计学意义(P<0.01)。随着雷帕霉素、紫杉醇浓度的增加,EPCs的数量逐渐减少(P<0.05)。相同浓度的雷帕霉素和紫杉醇对EPCs的数量的影响无显著差异(图1和表1)。
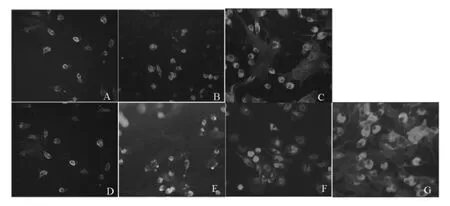
图1 各组在激光共聚焦显微镜下的正在分化的EPCs(×200)
2.3 不同浓度雷帕霉素和紫杉醇对EPCs黏附能力的影响 雷帕霉素和紫杉醇各组与对照组相比,EPCs的黏附能力低。随着雷帕霉素、紫杉醇浓度的增加,EPCs的黏附能力逐渐降低。相同浓度的雷帕霉素和紫杉醇对EPCs黏附能力无显著影响,见表1。
2.4 不同浓度雷帕霉素和紫杉醇对EPCs迁移能力的影响 雷帕霉素及紫杉醇各组与对照组相比,EPCs迁移能力降低。随着雷帕霉素、紫杉醇浓度的增加,EPCs的迁移能力逐渐降低。相同浓度的雷帕霉素和紫杉醇对EPCs迁移能力无显著影响,见表1。
2.5 不同浓度雷帕霉素和紫杉醇对EPCs增殖能力的影响 雷帕霉素及紫杉醇各浓度组与对照组相比,EPCs增殖能力降低。随着雷帕霉素、紫杉醇浓度的增加,EPCs的增殖能力逐渐降低。相同浓度的雷帕霉素和紫杉醇对EPCs增殖无显著影响,见表1。

表1 不同浓度雷帕霉素和紫杉醇对EPCs数量与功能的影响
3 讨 论
血管内皮损伤是冠状动脉斑块形成中的关键起始步骤,因此内皮损伤后的完全修复非常重要。内皮修复可以借助损伤周围成熟内皮细胞的迁移及增殖完成,但成熟内皮细胞是已分化细胞,其增殖能力有限。EPCs具有分化为成熟内皮细胞的能力,动物实验及临床研究表明[1-2],新生血管中25%的内皮细胞是由EPCs分化而来。EPCs在外伤愈合[3]、心肌梗死后修复[4]及移植血管内皮化[5]等过程中起促进作用。在球囊损伤血管模型中,EPCs能结合到血管损伤部位,促进血管再内皮化[6]。
在心血管病介入治疗中,药物洗脱支架(drug eluting stent,DES)已得到广泛应用,目前美国食品和药品监督管理局(FDA)批准的DES为紫杉醇洗脱支架和雷帕霉素洗脱支架。雷帕霉素是一种大环内酯类抗生素,具有抗血管形成、抗肿瘤生长的作用。其与细胞内雷帕霉素连接蛋白结合形成的复合物能抑制调节性激酶-雷帕霉素耙(target of rapamycin,TOR),抑制细胞转录过程,从而使细胞分裂受阻于G1期而不能进入S期。在增殖分化的EPCs中也存在调节性激酶TOR,因此雷帕霉素能抑制EPCs的增殖和分化。雷帕霉素可降低体外培养的人外周血来源的EPCs的数量,抑制其增殖、迁移、黏附和血管形成,并抑制内皮一氧化氮合成酶(eNOS)产生[7]。本实验结果显示,雷帕霉素可以降低体外培养的大鼠骨髓来源的EPCs的数量,并抑制其增殖、迁移、黏附的能力,且呈浓度依赖性。
紫杉醇是一种抗增殖药物,它可与微管蛋白结合,稳定微管结构,阻断细胞有丝分裂,从而抑制细胞的增殖。低剂量的紫杉醇可通过诱导p53/p21肿瘤抑制基因,影响细胞分裂的G0-G1及G1-S期;而高剂量紫杉醇则影响细胞分裂的G2-M期和M-G1期,可能会导致细胞坏死或凋亡。本实验结果显示,紫杉醇降低了体外培养的大鼠骨髓来源的EPCs的数量,并且可以抑制其增殖、迁移、黏附的能力,且呈浓度依赖性。
DES的应用显著降低了支架内再狭窄的发生率,但也导致了血管内皮化延迟以及支架内血栓发生率的增加。雷帕霉素和紫杉醇对EPCs的抑制作用可能是导致内皮化延迟的原因之一,因而用药物或细胞移植增加EPCs的数量并改善其功能可能会促进DES术后患者内皮的修复,降低支架内血栓发生率。体外实验[8]显示,恒磁场可促进EPCs的增殖和迁移,糖原合酶激酶-3β抑制剂加雷帕霉素包被支架可促进EPCs黏附,改善雷帕霉素导致的内皮化延迟。但目前促进内皮修复的办法尚不能达到理想的远期效果,需要继续探讨内皮修复的新措施。
[1] Murohara T,Tepper O,Silver M,et al.Determination of bone marrow-derived endothelial progenitor cell significance in angiogenic growth factor-induced neovascularization[J].Exp Hematol,2002,30(8):967-972.
[2] Suzuki T,Nishida M,Futami S,et al.Neoendothelialization after peripheral blood stem cell transplantation in humans.A case report of a Tokaimura nuclear accident victim[J].Cardiovasc Res,2003,58(2):487-492.
[3] Gill M,Dias S,Hattori K,et al.Vascular trsuma induces rapid but transient mobilizing of VEGFR2(+)CD133(+)endothelial precursor cells[J].Circ Res,2001,88(2):167-174.
[4] Shintani S,Murohara T,Ikeada H,et al.Mobiization of endothelial progenitor cells in patients with acute myocardial infarction[J].Circulation,2001,103(23):2776-2779.
[5] Bhattacharya V,McSweeney PA,Shi Q,et al.Enhanced endothelialization and microvessel formation in polyester grafts sedded with CD34(+)bone marrow cells[J].Blood,2000,95(2):581-585.
[6] Walter DH,Rittig K,Bahlmann FH,et al.Statin therapy accelerates reendothelialization:a novel effect involving mobilization and incorporation of bone marrow-derived endothelial progenitor cells[J].Circulation,2002,105(25):3017-3024.
[7] Chen TG,Chen JZ,Wang XX,et al.Effects of rapamycin on number activity and eNOS of endothelial progenitor cells from peripheral blood[J].Cell Prolif,2006,39(2):117-125.
[8] Ma XL,Hibbert B,Dhaliwal B,et al.Delayed re-endothelialization with rapamycin-coated stents is rescued by the addition of a glycogen synthase kinase-3βinhibitor[J].Cardiovasc Res,2010,86(2):338-345.
——雷帕霉素

