松弛素对肝纤维化大鼠的作用及对转化生长因子-β1的影响*
周玉平 涂国卿 胡俊义 徐泽宇
1.南昌市中西医结合医院消化内科 (江西南昌,330003) 2.江西中医药高等专科学校医疗系
松弛素 (relaxin,RLX)是迄今发现的最强的内源性抗纤维化物质之一,也是最具前景的内源性抗纤维化物质[1]。RLX是体内广泛分布的多功能活性多肽,早期研究发现,RLX能调节生殖系统功能和垂体激素分泌、促进大脑发育,维护心血管系统功能稳态。在肿瘤的发展和转移及心血管疾病发病中也具有重要的病理生理意义。近几年来,RLX强大的抗纤维化效应受人关注[2]。国外学者研究发现,RLX在肝硬化患者肝星状细胞 (HSC)中也有表达,并且对阻止肝纤维化有明显作用[3]。RLX抗肝纤维化的作用机制尚不清楚,本研究拟通过动物实验研究松弛素的抗肝纤维化作用,并初步探讨其机制。
1 材料与方法
1.1 材料 36只健康雄性Wistar大鼠,清洁级,体重 (120±20)g,由江西中医学院动物实验中心提供,实验动物合格证号:JZDW No2010-0011。四氯化碳为国产分析纯。橄榄油为山东鲁花集团有限公司生产。转化生长因子-β1(TGF-β1)ELISA试剂盒购自武汉博士德公司。rhRLX(重组人松驰素)为美国R&D公司产品。Diagnostics酶标仪为美国Sigma公司产品。
1.2 方法
1.2.1 动物分组和造模 大鼠先进行适应性饲养两天后,采用随机数字表法随机分为3组,即正常组、模型组、松弛素组,每组12只。除正常组外,模型组和松驰素组大鼠采用CCl4造模,将CCl4制成50%橄榄油剂,按每公斤体重1ml的剂量在每只大鼠腹腔注射,第1周3次,第2周开始每周2次,共6周。正常组大鼠腹腔注射相同体积生理盐水。各组大鼠均用普通饲料喂养,自由饮水。松弛素组大鼠在第6周,每天予重组人松弛素静脉注射,剂量为2μg/kg,共用1周。
1.2.2 标本采集 实验结束后,大鼠称重,戊巴比妥钠麻醉,打开腹腔,腹主动脉采血,离心分离血清后,-20℃保存备用。于肝左叶同一部位取肝组织标本约1×1×lcm3,固定于10%甲醛溶液。肝组织常规脱水,石蜡包埋,制作切片。另外留取500mg肝右叶组织,迅速置于预冷的生理盐水中洗去血液后,置冻存管于液氮中速冻,-70℃ 冰箱内保存备用。
1.2.3 病理和临床指标检测 HE染色制作病理切片观察大鼠肝组织损伤情况,并参照文献方法对肝脏病理学改变进行半定量评价:0级:无纤维化;Ⅰ级:汇管区纤维化,炎性细胞浸润,点、灶性坏死;Ⅱ级:纤维间隔形成,炎性细胞浸润轻度,灶性坏死;Ⅲ级:纤维间隔伴小叶结构改变 (假小叶),炎性细胞重度浸润,灶性坏死,桥接坏死;Ⅳ级:少数结节形成 (早期肝硬化),融合性坏死;依据各组大鼠肝纤维化的分级,按0、Ⅰ、Ⅱ、Ⅲ,Ⅳ级分别计1、2、3、4、5分的标准对大鼠肝纤维化进行评分[3]。采用全自动生化分析仪测定血清丙氨酸转氨酶 (ALT)、天门冬氨酸转氨酶 (AST)。采用放射免疫分析法检测血清透明质酸 (HA)、层黏蛋白(LN)、Ⅲ型前胶原 (PCⅢ)、Ⅳ型胶原 (CⅣ)。指标检测均由我校附属医院完成。
1.2.4 肝组织TGF-β1水平检测 取大鼠肝组织,经预冷的生理盐水洗涤后用眼科剪剪碎,加入4倍体积的裂解液,在匀浆管中小心匀浆,提取肝组织的总蛋白质,然后转入EP管,4℃冰箱静置30分钟,12 000r/min、4℃离心30分钟,取上清液。同组肝组织蛋白样品合并成一个混合样品,各混合蛋白样品按bradford法进行蛋白质定量。肝组织TGF-β1检测采用双抗体两步夹心ELISA法。操作按试剂盒说明书进行。
2 结果
2.1 各组大鼠肝脏病理情况 实验过程中模型组大鼠死亡2只,松弛素组大鼠死亡1只,死亡大鼠尸检腹腔内见弥漫性化脓性炎症,肝组织上附着大量白斑及胶原状物质,组织学观察见肝组织广泛大面积坏死伴中性粒细胞浸润。正常组大鼠肝组织HE染色见肝小叶结构完整,肝细胞无变性、坏死,汇管区无明显纤维组织增生及炎性细胞浸润。模型组大鼠肝组织HE染色见肝细胞排列紊乱,小叶内和小叶间有炎性细胞浸润,部分肝细胞变性、坏死,汇管区及肝小叶内可见大量的纤维组织增生,并形成假小叶。松弛素组大鼠肝组织HE染色见大部分肝小叶结构正常,肝细胞坏死程度、纤维增生程度较模型组轻。
2.2 各组大鼠肝纤维化分级、评分情况 见表1。
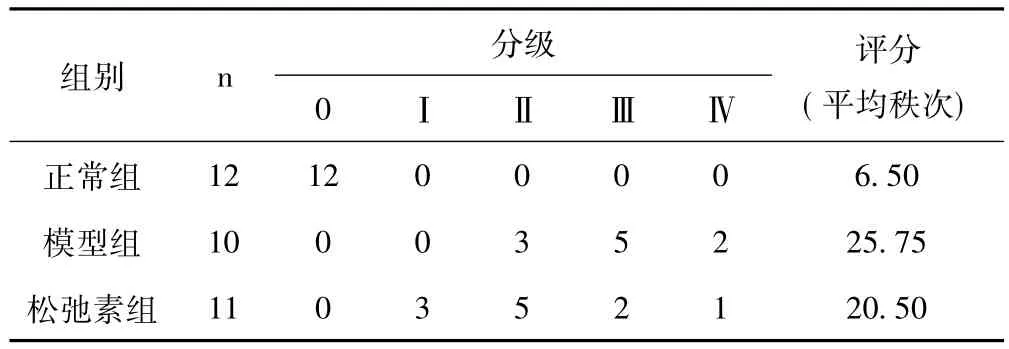
表1 各组大鼠肝纤维化分级、评分比较
经秩和检验统计分析,各组大鼠肝纤维化评分分值由高到低依次为模型组、松弛素组、正常组,各组间比较,P均<0.01。
2.3 各组大鼠肝功能及肝纤维化指标检测结果 见表2。
表2 各组大鼠肝功能和肝纤维化指标检测结果比较(±s)
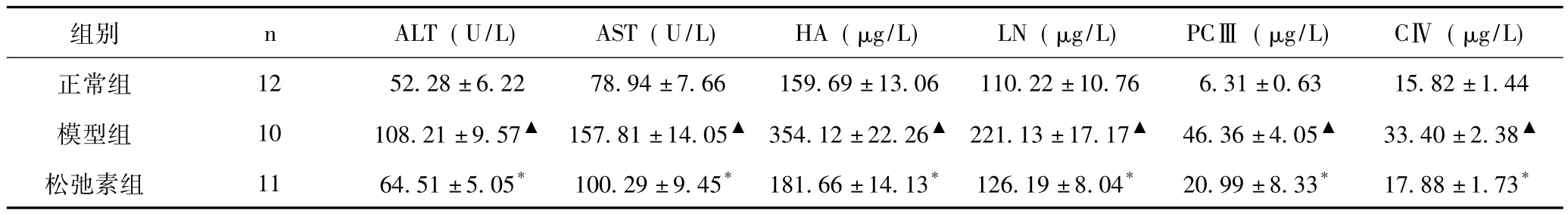
表2 各组大鼠肝功能和肝纤维化指标检测结果比较(±s)
与正常组比,▲P<0.01;与模型组比,*P<0.01
组别 n ALT(U/L) AST(U/L) HA(μg/L) LN(μg/L) PCⅢ (μg/L) CⅣ (μg/L)正常组 12 52.28 ±6.22 78.94 ±7.66 159.69 ±13.06 110.22 ±10.76 6.31 ±0.63 15.82 ±1.44模型组 10 108.21 ±9.57▲ 157.81 ±14.05▲ 354.12 ±22.26▲ 221.13 ±17.17▲ 46.36 ±4.05▲ 33.40 ±2.38▲松弛素组 11 64.51 ±5.05* 100.29 ±9.45* 181.66 ±14.13* 126.19 ±8.04* 20.99 ±8.33* 17.88 ±1.73*
2.4 各组大鼠肝组织TGF-β1检测情况 见表3。
表3 各组大鼠肝组织TGF-β1水平比较(±s)
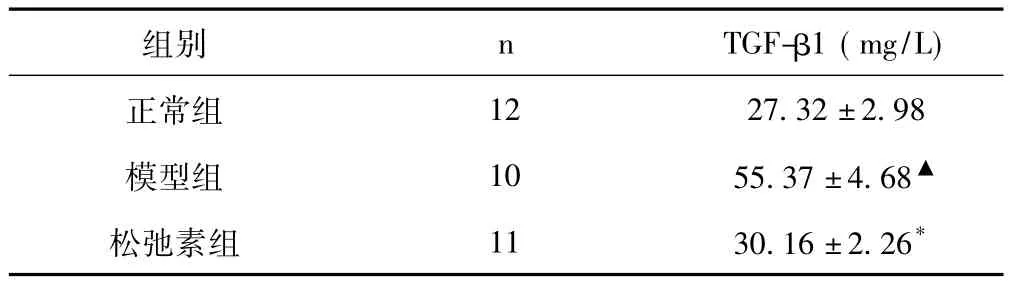
表3 各组大鼠肝组织TGF-β1水平比较(±s)
与正常组比,▲P<0.01;与模型组比,*P<0.01
组别 n TGF-β1(mg/L)正常组12 27.32 ±2.98模型组 10 55.37 ±4.68▲松弛素组 11 30.16 ±2.26*
3 讨论
肝纤维化 (hepatic fibrosis,HF)是致病因子引起肝脏炎症或损伤后组织修复过程中的代偿反应,是继发于各种肝脏损害后的组织修复过程,以细胞外基质 (ECM)在肝内过量沉积为病理特征[4]。目前研究认为HSC激活是肝纤维化的中心环节,激活的HSC是产生ECM并造成HF的主要细胞。尽管引起HF的原因多种多样,但不同原因引起的HF都有着共同的特点:当各种致病因子作用于肝脏,受损肝细胞通过产生并释放氧自由基、脂质过氧化物、蛋白酶、细胞因子和生长因子等,直接或间接地损害邻近的肝脏细胞[5],并引起肝Kupffer细胞、肝窦内皮细胞、血小板和肝细胞分泌更多种细胞因子,其中包括血小板衍化生长因子 (PDGF)、TGF-β、肿瘤坏死因子-α (TNF-α)、干扰素-γ (IFN-γ)、IGF(胰岛素样生长因子)、内皮素-1(ET-1)、连接蛋白和促有丝分裂原,与某些化学递质共同作用于静息状态的HSC,使其激活[6]。激活的HSC在接受旁分泌进行自身增殖的同时,自身也分泌多种细胞因子,主要有成纤维细胞生长因子 (FGF)、肝细胞生长因子 (HGF)、ET-1,使其进一步激活,以维持和扩展其激活状态。同时,激活的HSC在化学引诱物PDGF、单核细胞趋化因子-1(MCP-1)、IGF和ET-1的作用下定向迁移并聚集至肝损伤部位,并大量合成ECM。ECM主要包括:Ⅰ、Ⅱ、Ⅲ、Ⅳ型胶原,蛋白多糖,硫酸软骨素,硫酸皮肤素,透明质酸等。其中关键环节是在TGF-β等的影响下基质金属蛋白酶 (MMPs)的活性下降,组织金属蛋白酶抑制剂(TIMP)的活性增加,导致ECM的降解减少,使得ECM大量沉积,最终导致肝纤维化[7]。
RLX是1926年Hisaw从怀孕的猪黄体细胞中提取的妊娠相关激素,能松弛耻骨韧带、软化宫颈,促进分娩。RLX是胰岛素样生长因子超家族的一员,在人及其他一些高等灵长动物体内有3种类型,分别为 H1、H2、H3,其中 H2是组织储存及血液循环中存在的主要形式;在啮齿动物存在两种RLX类型,分别为 RLX-1(相当于 H2)和 RLX-3(相当于H3)。后来研究发现,在非妊娠期的妇女及男性体内多种组织都有RLX的表达,推测RLX不仅是一种生殖激素,可能还具有多种生物学效应。但直至2000年,人们利用同源分析的方法发现并克隆了孤儿受体 LGR7,随后证实 RLX为其内源性配体,这一发现使RLX的功能研究进入了一个崭新的阶段,就此2002年,Science杂志就曾发表社评文章,指出对RLX功能的重新认识有着深远的意义。
RLX是体内广泛分布的多功能活性多肽,不仅调节生殖系统功能,还参与神经垂体激素的分泌、大脑发育和心血管系统功能稳态等广泛生理过程,在肿瘤的发展和转移及其心血管疾病发病中也具有重要的病理生理意义。
最近研究发现,RLX在肝硬化患者HSC细胞中表达增多,并且对阻止肝纤维化有明显作用[3]。但是RLX的抗肝纤维化作用机制尚未深入探讨。本研究结果再次证实,松弛素能显著降低大鼠血清中ALT、AST水平 (P<0.01),改善肝功能;能显著降低血清中HA、LN、PCⅢ、CⅣ水平 (P<0.01),降低大鼠肝纤维化程度。这与上述研究结果是一致的。本研究还重点研究了松弛素对肝组织TGF-β1水平的影响,结果说明,松弛素能显著减少肝组织TGF-β1的表达,我们推测这可能是松弛素防治肝纤维化的重要机制。
[1]SAMUEL CS,HEWITSON TD,UNEMORI EN,et al.Drugs of the future:the hormone relaxin [J].Cell Mol Life Sci,2007,64(12):1539-1557.
[2]SAMUEL CS,LEKGABE ED,MOOKERJEE I.The effects of relaxin on extracellular matrix remodeling in health and fibrotic disease[J].Adv Exp Med Biol,2007,612:88-103.
[3]BENNETT RG,DALTON SR,MAHAN KJ,et al.Relaxin receptors in hepatic stellate cells and cirrhotic liver [J].Biochem Pharmacol,2007,73(7):1033-1040.
[4]BATALER R,BRENNER DA.Liver fibrosis[J].J Clin Invest,2005,115:209-218.
[5]SOKOL RJ.Liver cell injury and fibrosis [J].J Pediatr Gastroenterol Nutr,2002,35(1):7-10.
[6]陈海滨,吴蔚,李文珠,等.肝纤维化机制及最新治疗药物研究进展 [J].临床和实验医学杂志,2008,7(2):164-165.
[7]SHEK FW,BENYON RC.How can transforming growth factor beta be targeted usefully to combat liver fibrosis? [J].Eur J Gastroenterol Hepatol,2004,16(2):123-126.

