甘肃省马铃薯坏疽病病原鉴定
文朝慧, 何苏琴, 荆卓琼
(1.甘肃省出入境检验检疫局,兰州 730020;2.甘肃省农业科学院植物保护研究所,兰州 730070)
甘肃省马铃薯坏疽病病原鉴定
文朝慧1, 何苏琴2*, 荆卓琼2
(1.甘肃省出入境检验检疫局,兰州 730020;2.甘肃省农业科学院植物保护研究所,兰州 730070)
本文通过Koch’s法则以及形态学和分子生物学方法对甘肃省兰州市马铃薯坏疽病进行病原鉴定。从马铃薯坏疽病标样中分离得到5株形态特征一致的产生分生孢子器的腔孢纲真菌,其代表菌株GSAA-0232对马铃薯块茎具有强的致病性,用该菌接种马铃薯块茎,可引起与自然发病相同的坏疽病症状。该菌的培养物生成代谢物“E”(NaOH斑反应显示出特有的紫红色)。利用引物Phoma-2/Phoma-7可扩增出474bp的Phomafoveata特异条带。根据其形态特征、生物学特性、致病性及分子生物学鉴定结果 (GenBank登录号:JQ963624),将菌株GSAA-0232鉴定为Boeremiafoveata(Foister)Aveskamp,Gruyter &Verkley。这是Boeremiafoveata引起马铃薯坏疽病在我国的首次报道。
马铃薯; 坏疽病;Boeremiafoveata;Phomafoveata
随着产业结构的调整,马铃薯已成为甘肃省重要的经济作物,种植面积和总产量在国内都名列前
茅[1],2011年全省马铃薯播种面积达700 000hm2[2]。随着马铃薯集约化程度的提高,马铃薯贮藏期腐烂问题也日渐突出[3-4]。
2002、2009年,作者在兰州市榆中、皋兰出产的马铃薯薯块中发现了坏疽病病薯,并对病原菌进行了分离和鉴定,现将研究结果报告如下。
1 材料与方法
1.1 培养基及配方
PDA:马铃薯200g,葡萄糖15g,琼脂粉12g,自来水1 000mL。
OA:燕麦片20g,琼脂粉12g,自来水1 000mL。
MEA:麦芽浸粉40g,琼脂粉12g,自来水1 000mL。
1.2 病害症状描述
根据自然感病和人工接种发病薯块进行症状描述。
1.3 标样采集和病原分离
病薯标样采集自兰州榆中和皋兰菜农自产自销的商品薯,取病健交界处病组织做常规分离,挑取尖端菌丝进行纯化。
1.4 病菌致病性测定
用直径0.5cm打孔器在经75%乙醇表面消毒的健康马铃薯薯块上打一深0.5cm小孔,将在PDA平板上20℃培养4d的直径0.5cm病菌菌丝块接种于孔中,再将原薯块组织塞回并用透明胶带封口,置5℃和15℃培养,不接菌为对照,每处理5个马铃薯薯块。16d后切薯调查发病情况并对发病薯块进行病原菌再分离。
1.5 病原菌形态特征及生物学特性研究
切取直径5mm的菌丝圆片移植于PDA平板中央,分别于5、10、15、20、25、30、35℃下恒温培养,6d后测量菌落直径,观察记载病菌培养性状及形态特征。每处理重复3次;继续培养至20~40d,观察测量分生孢子器及器孢子的形态和大小。
取直径5mm的菌丝圆片移植于OA、MEA平板中央,20℃黑暗培养7d,测量菌落直径,描述菌落形态;然后将培养皿转放到13h近紫外灯+11h黑暗/d,20℃培养,以刺激菌落色素的产生和分生孢子器的生成,7d后再次描述菌落形态,并在菌落边缘滴加1mol/L NaOH 水溶液,观察色斑反应[5-6]。
1.6 PCR-RFLP
将待鉴分离物置PDA培养基、20℃、黑暗条件下培养5d,刮取菌落边缘新鲜菌丝,采用常规CTAB法提取基因组DNA为扩增模板,利用特异引物Phoma-2:5′-GGACCCCTGTACTGACGTC-3′和 Phoma-7:5′-AGC GGCTAGGATAGACAGGCG-3′,扩增病菌基因组DNA中的特异片段[7]。PCR反应体系总体25μL:10×Taqreaction buffer 2.5μL,1.5mmol/L MgCl22μL,dNTPs(2.5mmol/L)1μL,引物(20μmol/L)各0.5μL,Taq(5U/μL)0.2μL,DNA模板1μL,ddH2O补足25μL体积。反应程序为94℃预变性3min;94℃15s,62℃30s,72℃1min,30个循环;72℃延伸10min,4℃保存。1.0%的琼脂糖凝胶电泳检测PCR产物。预期产物经回收、连接转化和PCR鉴定后,纯化质粒送大连宝生物工程有限公司测序。测序结果与NCBI/GenBank数据库中的已有序列进行BLASTn比对,确定与试验菌株的相关性。
分别用限制性内切酶DdeⅠ和DpnⅡ酶切PCR反应产物,10μL体系:5μL PCR反应液,0.5μL限制性内切酶溶液,1μL缓冲液,ddH2O补足体积,37℃酶切3h。产物用2.0%琼脂糖凝胶电泳检测,鉴别PCR反应产物的DdeⅠ和DpnⅡ的酶切图谱。
2 结果与分析
2.1 病害症状
病薯外表可见不规则黑褐色稍凹陷斑块,切开病薯,薯内形成大的孔洞,腐烂组织呈淡褐色、深红褐色或深褐色,自然发病的病薯一般自脐点或有伤痕处形成侵染(图1a~c)。
2.2 病原分离结果
从典型坏疽病症状的马铃薯病薯上分离得到5株菌落形态一致的褐色、产生分生孢子器的腔孢纲真菌,将其中的代表菌株编号GSAA-0232。
2.3 病菌致病性测定结果
不同温度条件下病害症状及严重度不同:15℃下,病斑深红褐色,在薯内形成大的裂孔,表皮黑褐色,不规则,稍下陷,病斑长16~31mm(平均21.3mm),宽14~25mm(平均18.0mm),深22~29mm(平均25.3mm);5℃下,病斑淡红褐色至淡褐色,病组织糟松状,有时有小的开裂,表皮黑褐色,不规则,稍下陷,病斑长15~19mm(平均17.0mm),宽13~16mm(平均14.7mm),深10~14mm(平均12.0mm)。15℃下薯块受害较5℃下严重。对照未发病。
15℃回接发病的马铃薯块茎表现出与自然病薯相同的症状。从回接发病马铃薯块茎中可100%分离得到原接种病菌。
2.4 病原菌菌落形态和生物学特性
GSAA-0232在PDA平板上,20℃培养7d,菌落直径(69.7±0.5)mm,菌落灰褐色,边缘白色,菌落背面黄褐色;培养20d,菌落红褐色,表层的网状菌丝上散生大量黑色微粒状分生孢子器,菌落表面散布无色透明微小水珠,菌落背面可见大小不等的黑褐色斑块。
GSAA-0232在OA平板上,20℃培养7d,菌落直径(72.2±0.6)mm,菌落黄褐色,边缘整齐,几乎没有气生菌丝,菌落背面黄褐色;培养14d,菌落深豆沙色,气生菌丝薄而稀疏,边缘稍多;培养基内生大量深褐色斑块,菌落背面与正面色同。
GSAA-0232在MEA平板上,20℃培养7d,菌落直径(70.7±1.2)mm,菌落淡黄褐色,边缘整齐,气生菌丝薄毡状,菌落背面亮黄褐色;培养14d,菌落黄褐色,气生菌丝薄毡状,菌落表面散生暗褐色分生孢子器,菌落背面亮黄褐色,可见黄色粉粒状结晶。
NaOH斑反应显示出特有的紫红色,显示菌株GSAA-0232生成代谢物“E”(即可扩散的蒽醌色素,在酸性条件下蒽醌色素呈黄色,在碱性条件下呈红色)[5-6]。
GSAA-0232菌落形态及 NaOH斑反应见图1d~g。
菌丝的适宜生长温度为15~20℃;30℃和35℃下菌丝不生长,在30℃和35℃下培养5d后,将培养皿移至20℃,30℃下培养5d的接种体可恢复生长,35℃下培养5d的仅有1/3的接种体可恢复生长(图2)。
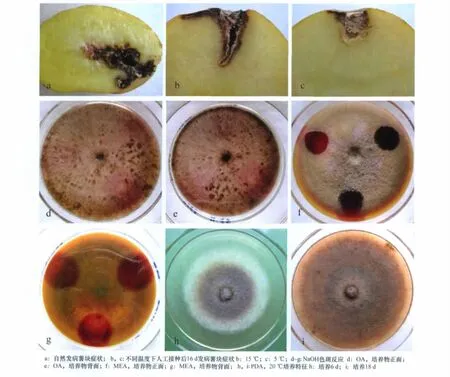
图1 马铃薯坏疽病症状、菌落形态及NaOH色斑反应
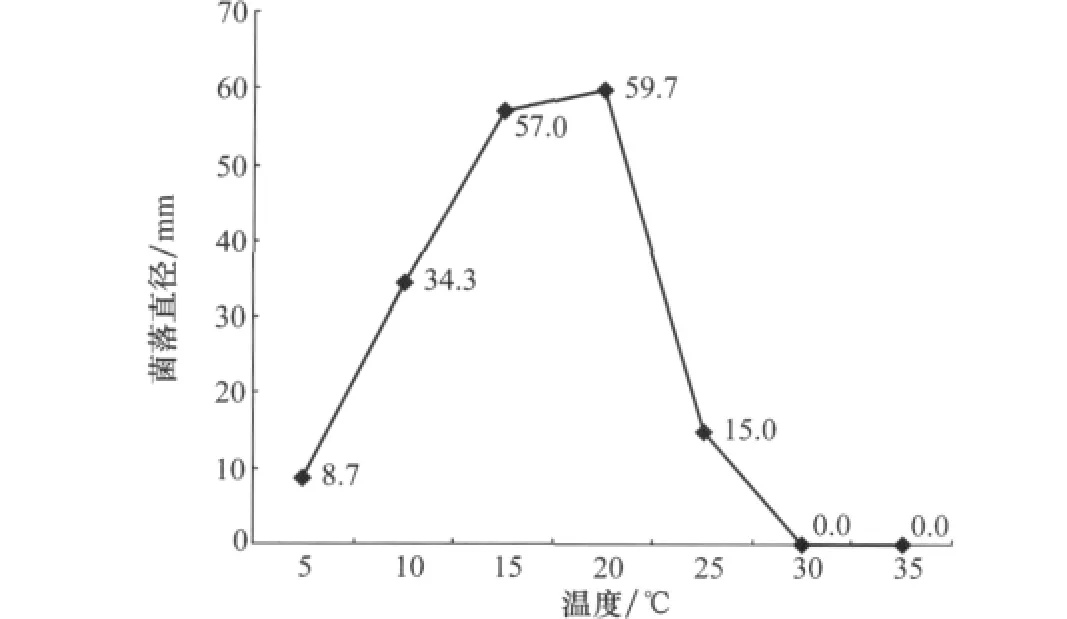
图2 温度对GSAA-0232菌丝生长的影响(PDA平板,培养6d)
GSAA-0232的显微形态特征:PDA平板20℃培养,菌丝无色至褐色,粗菌丝10.0~12.5μm;中等粗菌丝3.7~8.7μm;细菌丝1.3~2.5μm;分生孢子器坛形,散生或聚生于培养基表面及培养基内,深褐色,常被褐色网状菌丝包围,孔口不明显,直径89.1~198.0μm,平均139.8μm;高108.9~297.0μm,平均162.5μm;器孢子单孢,无色,壁薄,两端钝圆的短柱状、长椭圆形、香蕉形,甚至不规则形,孢子均匀或一端稍大,直或略弯,(3.0~7.5)μm×(2.0~3.0)μm,平均(5.3×2.4)μm。在 MEA 平板20℃培 养,器 孢 子 大 小 为 (4.0~7.5)μm× (1.2~2.5)μm,平均(5.4×1.8)μm(图3)。
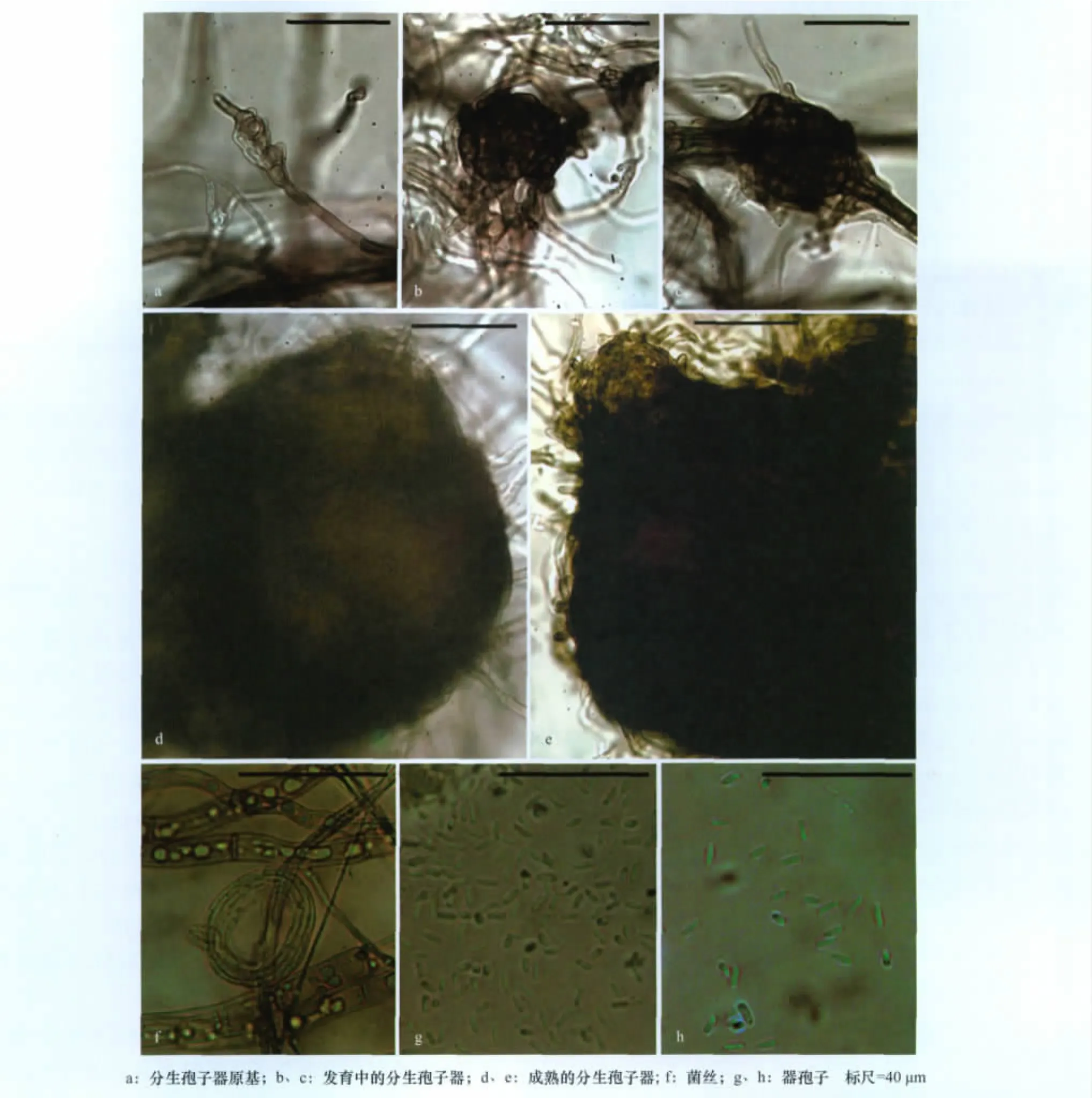
图3 GSAA-0232显微形态特征
2.5 PCR-RFLP结果
引物Phoma-2/Phoma-7在菌株 GSAA-0232中扩增出约474bp的Phomafoveata特异条带[7]。
测序后经BLAST比对表明,该序列(JQ963624)与Phomafoveata菌株79/139(AF079897.1)、ATCC 24771(AF079896.1)序列同源性为100%。
扩增产物经DdeⅠ酶切后产生256bp和118bp 2个条带,经DpnⅡ酶切后产生267bp和207bp 2个条带,与预期片段大小相符(图4)。
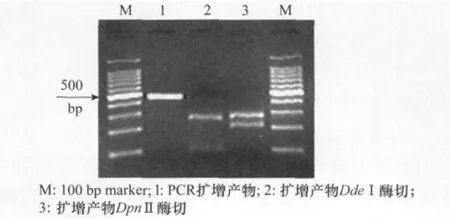
图4 PCR检测及酶切图谱
3 结论与讨论
从兰州马铃薯坏疽病病薯中分离得到菌落形态一致的产分生孢子器的腔孢纲真菌,其代表菌株GSAA-0232对马铃薯块茎具有强的致病性,培养物生成代谢物E(NaOH斑反应显示出特有的紫红色),利用引物 Phoma-2/Phoma-7可扩增出474bp的Boeremiafoveata(=Phomafoveata)特异条带。根据其形态特征、生物学特性、致病性及分子检测结果,将菌株GSAA-0232鉴定为Boeremiafoveata(Foister)Aveskamp,Gruyter & Verkley。
Boeremia属是Aveskamp等于2010年建立的新属[8-9]。Aveskamp 等 采 用 多 位 点 序 列 分 型 法(multilocus sequence type,MLST)对206个分类单元(其中159个分类单元已知与Phoma关系密切)的378个菌株的LSU、SSU、ITS、TUB基因进行了多重分析,依据系统发育分析结果并结合形态学,建立了新属BoeremiaAveskamp,Gruyter&Verkley,8个新种,2个新变种,61个新组合。马铃薯坏疽病病原被新组合为Boeremiafoveata,该菌隶属于子囊菌门(Ascomycota),盘菌亚门(Pezizomycotina),座囊菌纲(Dothideomycetes),格孢菌亚纲(Pleosporomycetidae),格孢腔菌目 (Pleosporales),Didymellaceae科,Boeremia属:
Boeremiafoveata(Foister) Aveskamp,Gruyter&Verkley 2010[Legitimate;MB515653]
Basionym :PhomafoveataFoister 1940 [Legitimate;MB289414]
Obligate synonym(s):
PhomafoveataFoister 1940 [Legitimate;MB289414]
Phomaexiguavar.foveata(Foister)Boerema 1967[Legitimate;MB350008]
Phomasolanicolavar.foveata(Foister)Malcolmson 1940[Legitimate;MB494129]
Phomasolanicolaf.foveata(Foister)Malcolmson 1958[Legitimate;MB350016]
Boeremiafoveata(=Phomafoveata)最早发现于苏格兰的马铃薯块茎[10],之后在秘鲁的阿尔蒂普拉诺高原地区的昆诺藜(Chenopodiumquinoa)上发现该菌,并认为南美高原可能是该菌的地理发源地[11]。
Boeremiafoveata引起的坏疽病是马铃薯贮藏期的重要病害,也是重要的检疫性病害,已发生于澳洲、欧洲、北美洲和南美洲,病菌在土壤中可存活多年[12-13]。病菌还可侵染马铃薯的茎,病茎较健康茎早衰[14]。
在苏格兰,引起马铃薯块茎坏疽病和干腐病的病原中,Boeremiafoveata引发病害的腐烂指数最高,其腐烂指数较Boeremiaexigua(=Phomaexigua)高出5倍,较Phomaeupyrena高出10倍[15]。在澳大利亚的塔斯马尼亚,马铃薯坏疽病病原中,Boeremiaexiguavar.exigua(=Phomaexiguavar.exigua)所占比率为90%,Boeremiafoveata所占比率为10%[16]。
Boeremiaexiguavar.exigua是多主寄生真菌,已报道从超过200个属的植物上分离到该菌,且无寄主专化现象[17]。在我国,梁力哲从辣椒种子上也分离到了该菌[18]。
由于Boeremiafoveata和Boeremiaexiguavar.exigua在形态特征上相似,而一些Boeremia foveata分离物又会丧失产生特征性蒽醌色素的能力[19],给种类鉴定带来了困难。随着现代生物技术的发展,一些分子检测鉴定技术被用于Boeremia foveata的辅助鉴定[20-21],其中 Macdonald等的方法具有较好的可重复性。本研究即采用Macdonald等的方法对病菌进行了分子生物学鉴定。
虽然马铃薯坏疽病具有较典型的病斑下陷、病健界限明显等特征性症状,但在实际操作中,坏疽病与镰刀菌引起的干腐病还是很容易混淆[22]。
本研究中,马铃薯坏疽病病薯率较低,3批次样本的病薯率均低于1%。
这是Phomafoveata引起马铃薯坏疽病在我国的首次报道。研究菌株保存于甘肃省农业科学院植物保护研究所病害研究室。
[1]隋启君,李先平,杨万林.中国马铃薯生产情况分析[J].西南农业学报,2008,21(4):1182-1188.
[2]吴晓燕.甘肃脱毒马铃薯种植面积超千万亩[EB/OL].(2011-09-05)[2002-04-25].http:∥ www.farmer.com.cn/news/nyxw/201108/t20110829_667043.htm.
[3]魏周全,宗世忠,张廷义.定西市马铃薯病害调查[J].中国马铃薯,2005,19(2):124-126.
[4]李金花,柴兆祥,王蒂,等.甘肃马铃薯贮藏期真菌性病害病原菌的分离鉴定[J].兰州大学学报(自然科学版),2007,43(2):39-42.
[5]Boerema G H,de Gruyter J,Noordeloos M E,et al.Phomaidentification manual:Differentiation of specific and infra-specific taxa in culture[M].Wallingford,U.K.CABI publishing,2004:1-470.
[6]国家质量监督检验检疫总局.SN/T1135.8-2009马铃薯坏疽病菌检疫鉴定方法[S].北京:中国标准出版社,2010.
[7]Macdonald J E,White G P,CotéM J.Differentiation ofPhomafoveatafromPh.exiguausing a RAPD generated PCRRFLP marker[J].European Journal of Plant Pathology,2000,106(1):67-75.
[8]Aveskamp M M,de Gruyter J,Woudenberg J H C,et al.Highlights of the Didymellaceae:A polyphasic approach to characterisePhomaand related pleosporalean genera[J].Studies in Mycology,2010,65:1-60.
[9]Boeremiafoveata[EB/OL].(2010-03-16)[2002-04-15].http:∥ www. mycobank. org/Biolomics. aspx? Table =Mycobank&Page=200&ViewMode=Basic.
[10]Foister,C E.Descriptions of new fungi causing economic diseases in Scotland[J].Transactions and Proceedings of the Botanical Society of Edinburgh,1940,33(1):65-68.
[11]OtazúV,Boerema G H,Mooi J C,et al.Possible geographical origin ofPhomaexiguavar.foveata,the principal causal organism of potato gangrene[J].Potato Research,1979,22(4):333-338.
[12]Rich A E.Potato diseases[M].New York:Academic Press,1983:1-238.
[13]张金兰,王仲符,曾庆财,等.马铃薯坏疽病[J].植物检疫,1993,7(2):123-125.
[14]Logan C.Potato stem infection byPhomasolanicolaPrill,and Delacr.f.foveata(Foister)Malcolmson[J].Plant Pathology,1967,16(2):64-67.
[15]Choiseul J,Allen L,Carnegie S F.Fungi causing dry tuber rots of seed potatoes in storage in Scotland[J].Potato Research,2006,49(4):241-253.
[16]Walker R R,Wade G C.Epidemiology of potato gangrene in Tasmania[J].Australian Journal of Botany,1976,24(3):337-347.
[17]Marcinkowska J,Roze-Kałuz.ny I,Kałuz.ny W.Pathogenicity of somePhomaexiguavar.exiguaisolates[J].Phytopathologia Polonica,2005,38:35-44.
[18]梁力哲.多变茎点菌的一个新变种[J].微生物学报,1991,31(2):160-162.
[19]Boerema G H.ThePhomaorganisms causing gangrene of potatoes[J].Netherlands Journal of Plant Pathology,1967,73:190-192.
[20]Aveskamp M M,de Gruyter J,Crous P W.Biology and recent developments in the systematics ofPhoma,a complex genus of major quarantine significance[J].Fungal Diversity,2008,31:1-18.
[21]A’Hara D,Mulholland V,Ventisei H M.Development of a multiplex real-time quantitative PCR assay to detectPhomapathogens of potato[C]∥Proceedings Crop Protection in Northern Britain 2012,Dundee,Scotland,2012:279-284.
[22]Definition of dry rot-List of diseases and pests[EB/OL].(2011-01-22)[2002-04-30].http:∥www.unece.org/fileadmin/DAM/trade/agr/meetings/ge.06/2010/2010_02E.p df.
Identification of the pathogen of potato tuber gangrene in Gansu Province
Wen Zhaohui1, He Suqin2, Jing Zhuoqiong2
(1.GansuEntry-ExitInspectionandQuarantineBureau,Lanzhou730020,China;2.InstituteofPlantProtection,GansuAcademyofAgricultural Sciences,Lanzhou730070,China)
The pathogen of potato tuber gangrene in Gansu Province was identified through Koch’s rule and morphological characteristics,and specific fragment DNA sequence by using the specific primers Phoma-2/Phoma-7.Totally 5 strains were isolated from the diseased potato tubers with typical gangrene symptoms in Lanzhou City of Gansu Province in 2002 and 2009,and the pathogenicity was confirmed by Koch’s rule.A474-bp DNA fragment was amplified from the strain GSAA-0232 by using the specific primers Phoma-2/Phoma-7.The fungus produced an yellowish-brown anthraquinone pigment in culture,showing purplish red colour as well as drop of NaOH.Based on morphological characteristics,biological features,pathogenicity and molecular specialities(GenBank accession:JQ963624),the pathogen was identified asBoeremiafoveata(Foister)Aveskamp,Gruyter &Verkley.This is the first report of potato gangrene caused byB.foveatain China.
potato; gangrene;Boeremiafoveata;Phomafoveata
S 435.32
A
10.3969/j.issn.0529-1542.2012.05.008
2012-05-01
2012-05-23
* 通信作者E-mail:gshesuqin@sina.com

