植物青枯菌Po82菌株Ⅵ型分泌系统中hcp基因的克隆及其功能研究
宋莎莎, 徐 进, 许景升, 陈匡宇, 张丽勍, 张 昊, 冯 洁
(中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193)
植物青枯菌Po82菌株Ⅵ型分泌系统中hcp基因的克隆及其功能研究
宋莎莎, 徐 进, 许景升, 陈匡宇, 张丽勍, 张 昊, 冯 洁*
(中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193)
Ⅵ型分泌系统(typeⅥsecretion system,T6SS)是新近报道的细菌蛋白分泌系统。基于植物青枯菌致病力分化菌株Po82的全基因组测序结果,发现其大质粒中存在T6SS的同源基因簇。本文通过基因敲除的方法构建了Po82菌株Ⅵ型分泌系统中的核心基因—hcp基因的缺失突变株,并比对了Po82野生型菌株、突变株及互补菌株在致病性、生长速率、运动性、生物膜形成等方面的变化。结果表明,hcp基因突变株较野生型菌株致病力显著减弱,病程延长;在生长速率、运动性及生物膜形成方面,突变株较野生型无明显差异。说明植物青枯菌Po82菌株T6SS中的hcp基因参与了细菌的致病过程。
植物青枯菌; Po82菌株;hcp基因; 突变; 致病性
植物细菌性青枯病(bacterial wilt of plants),是由茄科雷尔氏菌[Ralstoniasolanacearum(Smith)Yabuuchi et al.][1]引起的一种世界性重大植物病害。青枯菌寄主范围广泛,可侵染50多个科的450余种植物,包括许多单子叶植物和双子叶植物,一年生植物以及乔木和灌木[2]。青枯菌不同菌株在寄主范围、地理分布、致病性、流行学规律及生理生化特性方面均存在明显差异,无疑是一个复杂的种。
根据青枯菌的寄主范围可将其划分为5个不同的生理小种(race)[3-4],其中由青枯菌2号小种引起的香蕉细菌性枯萎病(moko disease)是香蕉生产上最具毁灭性的病害之一[5]。本实验室前期对Po82菌株的致病性生测结果表明:Po82能够侵染茄科植物的番茄、茄子及马铃薯,且兼具对香蕉的致病力,从而表明Po82致病进化地位极为独特[6]。因此,对植物青枯菌Po82菌株的致病相关基因进行研究具有重要的理论意义。
病原细菌通常利用泌出蛋白来介导与寄主植物的相互作用[7]。革兰氏阴性病原细菌可通过微小的装置将蛋白运送到胞外或直接运输到寄主细胞中,这些微小装置被称为分泌系统。迄今为止,发现在革兰氏阴性病原菌中至少存在6种不同类型的分泌系统(Ⅰ~Ⅵ型分泌系统)。其中,Ⅵ型分泌系统是近期报道的一种细菌蛋白分泌系统。该系统在细菌中以基因簇形式存在,通常编码12~25个蛋白,核心组分包括IcmF类蛋白、IcmH类蛋白、AAA+ATP酶、ClpV、未知脂蛋白以及泌出蛋白VgrG和 Hcp[8-10]。
根据植物青枯菌Po82菌株的全基因组序列信息,发现其大质粒上存在Ⅵ型分泌系统(typeⅥsecretion system,T6SS)的同源基因簇。本研究采用同源重组双交换法,构建了Po82菌株Ⅵ型分泌系统核心基因hcp的缺失突变株,并通过测定突变株致病性、运动性、生长速率和生物膜等相关基础生物学特性的变化,以期评价该基因在植物青枯菌致病过程中的作用。
1 材料与方法
1.1 菌株、质粒和引物
本试验所使用的菌株、质粒及引物序列见表1。青枯菌采用NA培养基,28℃条件下培养;大肠杆菌(Escherichiacoli)采用 LB[11]培养液,37℃下振荡培养。抗生素使用浓度:氨苄青霉素(Amp)100μg/mL;庆大霉素(Gm)30μg/mL;卡那霉素(Kan)30μg/mL。10%蔗糖NA培养基:NA培养基附加蔗糖存储液(50%蔗糖,115℃灭菌20min)至终浓度为10%。TZC培养基:NA培养基附加TZC存储液(1%红四氮唑,115℃灭菌7~8min)至终浓度50mg/L。
1.2 主要试剂
ExTaq酶、dNTP、EcoR Ⅰ、BamHⅠ、XbaⅠ、HindⅢ、T4DNA Ligase、和pMD19-T载体选自大连宝生物(TaKaRa)公司,2×TaqPlatinum PCR Master Mix、DL15000、100bp、500bp DNA ladder购自天根公司,质粒小提试剂盒、高纯度质粒大提试剂盒、大量DNA产物纯化试剂盒、琼脂糖凝胶回收试剂盒购自天根公司,氨苄青霉素(Amp)、卡那霉素(Kan),庆大霉素(Gm),IPTG,X-gal购自Sigma公司,蔗糖为上海生工公司产品,引物为上海生工公司合成。

表1 本研究所用菌株、质粒与引物的特性和来源1)
1.3 hcp基因缺失突变体的构建
1.3.1hcp基因左右臂的PCR扩增
根据hcp基因核苷酸序列设计引物,扩增hcp基因上下游约500bp的片段作为该基因的左臂和右臂,用于构建重组自杀质粒,将纯化后hcp基因左臂和右臂的PCR扩增产物分别连接至pMD19-T载体上,命名为pMD19-hcpZ和pMD19-hcpY,转化宿主菌DH5α后,酶切和测序鉴定。
1.3.2 庆大霉素基因的PCR扩增
根据质粒载体pBBR1MCS-5(GenBank登录号:U25061)中庆大霉素抗性基因的序列,设计引物扩增庆大霉素基因,庆大霉素基因gm长度为855bp,将纯化后的庆大霉素基因PCR扩增产物连接至pMD19-T载体上,作为重组突变体筛选标记基因。
1.4 hcp基因重组自杀质粒pK18-hcp-Gm的构建及突变株的筛选
将hcp基因的左右臂及gm基因分别连接至自杀载体pK18mobsacB上,构建自杀载体pK18-hcp-Gm。PCR产物回收、连接、转化、质粒提取及酶切参照文献指南[14],构建过程见图1。植物青枯菌Po82菌株感受态细胞的制备及电转化方法参照Ausubel等[15]和Lavie等[16]的方法并略有改动。电转结束后,28℃ 振荡复苏24h,然后依次进行如下三步筛选。(1)初筛:将转化后的菌液涂布于含庆大霉素的NA固体培养基平板上,28℃培养24~48h,至单个菌落形成,提取基因组 DNA,用hcpZF/hcpYR引物扩增鉴定。(2)复筛:挑取上步的单菌落接种于NA液体培养基中,培养过夜后梯度稀释并涂布于含有10%蔗糖和庆大霉素的NA固体平板上,28℃培养24~48h,至单个菌落形成,筛选双重组子。(3)第3次筛选:挑取上步的单菌落分别转移至含有庆大霉素、卡那霉素和10%蔗糖平板上进行筛选。最终,筛选出同时具有卡那霉素敏感(Kans)、蔗糖抗性(Sucr)和庆大霉素抗性(Gmr)的菌落,提取基因组,以hcpZF/hcpYR引物扩增鉴定。最终得到的hcp基因突变株,命名为Po82△hcp。
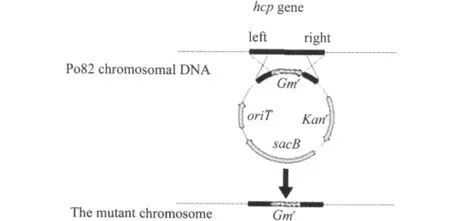
图1 重组质粒pk18-hcp-Gm的构建
1.5 Po82△hcp互补菌株的构建
根据青枯菌Po82菌株hcp基因的ORF序列设计引物745orfF/745orfR(表1),将PCR 扩增得到504bp的ORF片段连接于pMD19-T上,构建载体pMD19-hcpORF。将片段连至PML123载体,构建载体PML123-hcpORF,之后电转化转入突变株Po82△hcp中,经PCR、酶切及测序验证正确后,通过NA+Gm+Kan平板筛选转化子。经PCR和测序验证,将得到的互补菌株命名为Po82-hcpORF。最后,将互补载体PML123-hcpORF提取RNA做反转录,验证其在pML123载体上能否表达。
1.6 致病性测定
Po82野生型菌株和突变株Po82△hcp于TZC平板培养48h后,挑取毒性单菌落于NA平板上画线培养48h后,分别以蒸馏水配成3×107cfu/mL的菌悬液。参照He等[16]伤根接种法,接种番茄感病品种‘中蔬5号’。每菌株接种10株,重复3次。病情调查及统计方法参照Denny等[17]的方法。
1.7 运动性测定
制备3×108cfu/mL的细菌悬浮液,取5μL加到检测细菌运动的半固体培养基SMM[19]平板上,培养皿非倒置30℃培养。运动性细菌朝周围扩展形成一个明显的圆形斑[19-22]。
1.8 生物膜形成能力测定
生物被膜的测定方法参照O’Toole等[23]方法。每个处理重复3次。在菌液与空气交界处,细菌可以形成坚固的附着膜被结晶紫染色,呈现一个紫色环状带。
2 结果与分析
2.1 hcp基因突变株Po82△hcp的PCR、酶切、测序验证
首先,以植物青枯菌种特异性检测引物759/760,检测经3步筛选获得的菌株,均可扩增出大小约为280bp的条带,确定是植物青枯菌(图2)。其次,根据庆大霉素基因替换目的基因后PCR扩增后会产生片段差异,以745ZF/745YR引物分别扩增Po82野生型菌株和筛选到的突变株基因组DNA,PCR结果与之一致(图3)。再次,用EcoR I和HindⅢ双酶切载体pK18-hcp-Gm,经电泳检测与预期结果一致。最后,将筛选到的突变株进行PCR扩增,并将扩增产物测序,测序结果用DNAMAN进行比对,证实庆大基因替换了hcp基因,且hcp基因上下游序列未发生碱基突变,从而证明筛选到的菌株是植物青枯菌Po82菌株hcp基因的突变株。
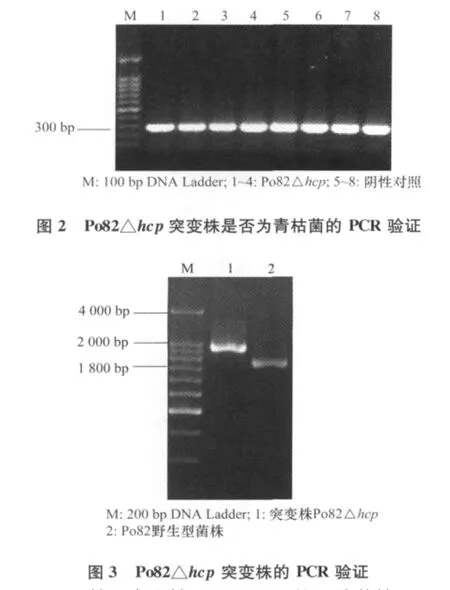
2.2 hcp基因突变株Po82△hcp的互补菌株Po82-hcpORF的验证
2.2.1 PCR、酶切、测序验证
根据植物青枯菌Po82菌株hcp基因的引物745orfF/745orfR(表1),PCR扩增hcp基因的ORF序列,得到约504bp的片段与预期结果一致。然后经过BamHⅠ、XbaⅠ双酶切得到504bp大小的片段。进一步测序,通过DNAMAN比对与目的片段一致。
2.2.2 反转录验证
提取RNA进行反转录,得到的cDNA进行PCR扩增,得到504bp大小的片段,证明其能够在pML123载体上表达。
2.3 hcp基因突变对植物青枯菌Po82菌株表型特征的影响
2.3.1 平板运动性试验
通过测量菌落直径,比较植物青枯菌Po82野生型菌株和hcp基因缺失突变株在低浓度琼脂平板(0.35%agar)上的运动能力,结果表明:突变株Po82△hcp较野生型菌株的运动性下降差异不显著(p<0.05)(图4、图5)。
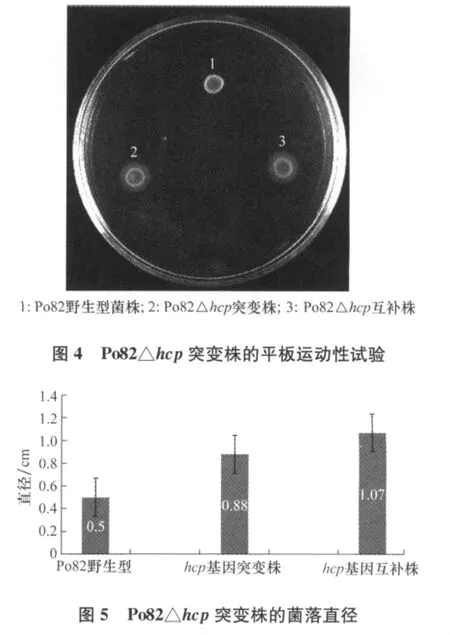
2.3.2 菌膜形成试验
3次重复试验的结果表明:Po82野生型菌株和hcp基因突变株在菌膜的形成能力上无显著性差异(图6)。
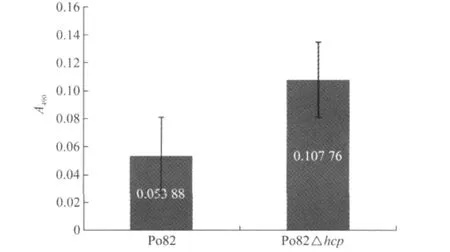
图6 Po82△hcp突变株的生物膜的A490测量
2.4 hcp基因突变对植物青枯菌Po82菌株致病性的影响
Po82野生型菌株在接种后第4天开始发病,hcp基因突变株在接种后第6天才出现明显萎蔫症状;接种后第15天,Po82野生型菌株的病情指数达到3.33,hcp基因突变株仅为1.18,两者差异显著(p<0.05)(图7)。表明hcp基因与青枯菌的致病力相关。
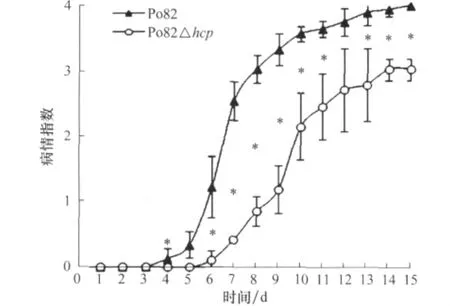
图7 hcp基因突变株致病力的测定
3 讨论
2006年,科学家报道了在霍乱弧菌(Vibrio choleraePacini,1854)和铜绿假单胞菌 [Pseudomonasaeruginosa(Schroeter)Migula]中存在一种新型分泌系统,并将其命名为Ⅵ型分泌系统[24-25]。在Ⅵ型分泌系统中通常存在一个基因簇,该基因簇通常编码12~25个蛋白[26]。Hcp(hemolysin coregulated protein)蛋白和 VgrG (valine-glycine repeat protein G)蛋白是目前已知的由T6SS进行分泌的蛋白质。尤其是Hcp蛋白,具有T6SS的细菌,在合适的条件下,均会泌出该蛋白。因此,Hcp蛋白已被作为一个鉴定T6SS功能的可靠指标。Hcp蛋白的晶体结构也已研究清楚,其在细菌胞内通常形成六聚体的环状结构,并通过层层叠加聚合成一个长100nm,直径4nm的管道[27]。这种管状结构构成了T6SS的分泌通道,分泌因子藉此泌出至外部环境或宿主细胞内。从而说明Hcp不仅是T6SS的分泌因子,而且参与T6SS的结构形成。
本研究围绕青枯菌Ⅵ型分泌系统与致病性的关系,通过基因敲除的方法破坏了青枯菌T6SS基因簇中的的核心基因hcp。致病性接种试验的结果显示,突变体较野生型菌株发病晚,且发病程度相对减弱,但致病性并未完全丧失。随后对与致病性密切相关的细菌运动性和生物膜形成,进行了相关试验研究。鞭毛为细菌提供了运动能力,借助鞭毛的泳动能力,细菌可以获得更多的营养和增殖空间,躲避有害因子,有利于其在外部环境中的生存[28]。相关研究已证实植物青枯病菌的运动性有助于其早期入侵寄主植物并定殖[29];Shalom 等的结果表明,hcp基因可能与运动性相关。菌膜是细菌在有机体或非有机体表面形成的一种富含多聚糖成分的生物活性膜。菌膜的形成可以使细菌能够在外界环境压力较大的情况下生存。例如,在铜绿假单胞菌中,菌膜还与细菌的毒力相关[30]。试验结果显示突变株的菌膜形成较野生型略有增加但不明显。综上所述,试验证实hcp基因突变株较野生型菌株致病力显著减弱,病程延长;在生长速率、运动性及生物膜形成方面,突变株较野生型无明显差异。植物青枯菌Po82菌株T6SS中的hcp基因参与了细菌的致病过程。
本实验室前期以青枯菌1号小种GMI1000菌株的Ⅵ型分泌系统核心基因vasK基因为研究对象,证明了突变株GMI1000-m的致病性较野生型GMI1000明显下降,从而表明vasK基因在青枯菌致病过程中具有重要作用[31]。基于实验室前期研究基础,本研究针对青枯菌2号小种致病力分化菌株Po82的Ⅵ型分泌系统中的另一核心基因hcp基因进行了相关研究,并阐明了hcp基因参与了青枯菌的致病过程,并在其中起重要作用。
[1]Yabuuchi E,Kosako Y,Yano I,et al.Transfer of twoBurkholderiaand anAlcaligenesspecies toRalstoniagen.nov.:Proposal ofRalstoniapickettii(Ralston,Palleroni and Doudoroff 1973)comb.nov,Ralstoniasolanacearum(Smith 1896)comb.nov.andRalstoniaeutropha(Davis 1969)comb.nov.[J].Microbiology and Immunology,1995,39:897-904.
[2]Wicker E,Grassart L,Coranson-Beaudu R,et al.Ralstonia solanacearumstrains from Martinique(French West Indies)exhibiting a new pathogenic potential[J].Applied and Environmental Microbiology,2007,71:6790-6801.
[3]Buddenhagen I,Sequeira L,Kelman A.Designation of races inPseudomonassolanacearum[J]. Phytopathology,1962,52:726.
[4]Pegg K G,Moffett M.Host range of the ginger strain ofPseudomonassolanacearumin Queensland[J].Australian Journal of Experimental Agriculture and Animal Husbandry,1971,11:696-698.
[5]徐进,陈林,许景升,等.香蕉细菌性枯萎病在中国的潜在适生区域[J].植物保护学报,2008,35(3):233-238.
[6]潘哲超.植物青枯菌遗传多样性及致病力分化研究[D].北京:中国农业科学院,2010.
[7]Mougous J D,Cuff M E,Raunser S,et al.A virulence locus ofPseudomonasaeruginosaencodes a protein secretion apparatus[J].Science,2006,312:1526-1530.
[8]Das S,Chaudhuri K.Identification of a unique IAHP(IcmF associated homologous proteins)cluster inVibriocholeraand other proteobacteria through in silico analysis[J].Silico Biology,2003,3:287-300.
[9]Shalom G,Shaw J G,Thomas M S.Invivoexpression technology identifies a typeⅥsecretion system locus inBurkholderiapseudomalleithat is induced upon invasion of macrophages[J].Microbiology,2007,153:2689-2699.
[10]Schell M A,Ulrich R L,Ribot W J,et al.TypeⅥsecretion is a major virulence determinant inBurkholderiamallei[J].Molecular Microbiology,2007,64:1466-1485.
[11]萨姆布鲁克J,拉塞尔D W.分子克隆实验指南[M].北京:科学出版社,2002:15-95.
[12]Kovach M E,Elzer P H,Hill D S,et al.Four new derivatives of the broad host range cloning vector pBBR1MCS,carrying different antibiotic-resistance cassettes[J].Gene,1995,166(1):175-176.
[13]Schafer A A,Tauch W J,Kalinowsski G,et al.Small mobilizable multi-purpose cloning vectors derived fromEscherichiacoliplasmids pK18and pK19:selection of defined deletions in the chromosome ofCorynrbacteriumglutamicum[J].Gene,1994,145:68-73.
[14]Schafer A A,Tauch W J,Kalinowsski G,et al.Small mobilizable multi-purpose cloning vectors derived fromEscherichiacoliplasmids pK18and pK19:selection of defined deletions in the chromosome ofCorynrbacteriumglutamicum[J].Gene,1994,145:68-73.
[15]Ausubel F M,Brent R,Kingston R E,et al.Short protocols in molecular biology[M].3rd ed.John Wiley and Sons,Chichester,1998.
[16]He L Y,Sequeira L,Kelman A.Characteristics of strains ofPseudomonassolanacearum[J].Plant Disease,1983,67:1357-1361.
[17]Denny T P,Carney B F,Schell M A.Inactivation of multiple virulence genes reduces the ability ofPseudomonassolanacearumto cause wilt symptoms[J].Molecular Plant-Microbe Interactions,1990:293-300.
[18]Boucher C A,Barberis P A,Trigaret P A,et al.Transponson mutagenesis ofPseudomonassolanacearum:isolation of Tn5-induced avirulent mutants[J].Journal of General Microbiology,1985,131:2449-2457.
[19]Adler J.Chemotaxis in bacteria[J].Science,1966,152:708-716.
[20]Adler J,Templeton B.The effect of environmental conditions on the motility ofEscherichiacoli[J].Journal of General Microbiology,1967,46,175-183.
[21]Kelman A,Hruschk J.The role of motility and aerotaxis in the selective increase of avirulent bacteria in still broth cultures ofPseudomonassolanacearum[J].Journal of General Microbiology,1973,76:177-188.
[22]方中达.植病研究方法[M].北京:农业出版社,1979.
[23]O’Toole G A,Kolter R.The initiation of biofilm formation inPseudomonasfluorescensWCS365proceeds via multiple,convergent signaling pathways:agenetic analysis[J].Molecular Microbiology,1998,28:449-461.
[24]Mougous J D,Cuff M E,Raunser S,et al.A virulence locus ofPseudomonasaeruginosaencodes a protein secretion apparatus[J].Science,2006,312:1526-1530.
[25]Pukatzki S,Ma A T,Sturtevant D,et al.Identification of a conserved bacterial protein secretion system inVibriocholeraeusing theDictyosteliumhost model system[J].Proceedings of the National Academy of Sciences of the United States of A-merica,2006,103:1528-33.
[26]Salanoubat M,Genin S,Artiguenave F,et al.Genome sequence of the plant pathogenRalstoniasolanacearum[J].Nature,2002,415(6871):497-502.
[27]Ballister E R,Lai A H,Zuckermann R N,et al.Invitroselfassembly of tailorable nanotubes from a simple protein building block[J].Proceeding of the National Academy of Sciences of the United States of American,2008,105:3733-3738.
[28]Yao J,Allen C.Chemotaxis is required for virulence and competitive fitness of the bacterial wilt pathogenRalstoniasolanacearum[J]. Journal of Bacteriology, 2006,188:3697-3708.
[29]Tans-Kersten J,Brown D,Allen C.Swimming motility,a virulence trait ofRalstoniasolanacearum,is regulated by FlhDC and the plant host environment[J].Molecular Plant-Microbe Interactions,2004,17:686-695.
[30]Hentzer M,Eberl L,Givskoe M.Transcriptome analysis ofPseudomonasaeruginosabiofilm development:anaerobic respiration and iron limitation[J].Biofilms,2005,2:37-61.
[31]张丽勍,许景升,徐进,等.植物青枯菌Ⅵ型分泌系统核心基因vasK突变株的构建及其致病性的测定[J].植物保护,2011,37(4):33-37.
Cloning and primary functional analysis ofhcpgene in T6SS cluster ofRalstoniasolanacearumPo82
Song Shasha, Xu Jin, Xu Jingsheng, Chen Kuangyu, Zhang Liqing, Zhang Hao, Feng Jie
(StateKeyLaboratoryforBiologyofPlantDiseasesandInsectPests,InstituteofPlantProtection,ChineseAcademyofAgriculturalSciences,Beijing100193,China)
The bacterium T6SS(typeⅥsecretion system)is a novel protein secretion pathway reported recently.On basis of the complete genome sequence ofRalstoniasolanacearumstrain Po82,a26.8 kb T6SS gene cluster was found in megaplasmid of Po82 strain.In order to elucidate the function of the gene cluster of typeⅥsecretion system,thehcpgene deletion mutant was constructed by homologous recombination.The mutants were then compared with the wild-type strains in pathogenicity,the ability of growth,the mobility and biofilm formation.Pathogenicity tests showed that the disease symptom caused by mutants was delayed when compared with the wild-type strains,and the pathogenicity of the mutants were weaker than that of the wild-type strains.As for the ability of growth,the mobility and biofilm formation,there were no significant differences between the mutants and the wild-type strains.All of the results suggested that thehcpgene of the typeⅥsecretion system in Po82 was possibly involved in pathogenicity of the bacteria.
Ralstoniasolanacearum; Po82 strain;hcpgene; mutant; pathogenicity
Q 753
A
10.3969/j.issn.0529-1542.2012.05.003
2011-12-02
2012-02-22
国家重点基础研究发展计划(“973”)项目(2009CB119200);国家高技术研究与发展计划(“863”)项目(2012AA101501);国家自然科学基金项目(31101409,31272008)
* 通信作者E-mail:jfeng@ippcaas.cn

