荧光原位杂交技术在多发性骨髓瘤中的应用
杨渝伟 薛冰蓉 陈小红 俸家富
四川省绵阳市中心医院检验科,四川绵阳 621000
多发性骨髓瘤(multiple myeloma,MM)是以骨髓中克隆性浆细胞恶性增殖和异常积累为特征的肿瘤,约占血液肿瘤的10%。染色体异常在该病中有极高的发生率且有独立的预后判断价值,但是传统细胞遗传学方法检测到染色体异常率只占初诊患者的1/3左右。荧光原位杂交(fluorescence in situ hybridization,FISH)技术能对间期细胞进行分析,克服传统方法的缺陷,大大提高核型异常检出率。本研究应用该技术检测39例MM初诊患者,现报道如下。
1 资料与方法
1.1 一般资料
2008年6 月~ 2009 年9月四川省绵阳市中心医院MM初诊患者39例,其中男24例,女15例,年龄36~80岁,中位年龄61.5岁。诊断标准依据中国多发性骨髓瘤工作组发布的《中国多发性骨髓瘤诊治指南》(2008版)[1]。ISS分期Ⅰ期9例,Ⅱ期17例,Ⅲ期13例;DS分期Ⅰ期7例,Ⅱ期15例,Ⅲ期17例;免疫球蛋白类型IgG型19例,IgA型10例,轻链型7例,不分泌型3例。对照组15例为非血液系统恶性疾病患者,其中男9例,女6例,年龄26~65岁,中位年龄57.5岁。
1.2 探针
多发性骨髓瘤FISH检测试剂盒购自北京金菩嘉生物有限公司,内含针对1q21区带的序列特异性探针1q21、针对13q14区带的序列特异性探针RBl(视网膜神经胶质瘤基因)和D13S319、针对14q32区带的序列特异性探针IGH和针对17p13区带的特异性探针p53。标记探针-20℃保存备用。
1.3 标本的处理
选取新鲜骨髓涂片(涂片均匀、勿厚)晾干后,56℃烤片10~20 min,100%甲醇浸泡5 min,100%乙酸浸泡30 min,室温2xSSC液洗片2次各5 min,56℃老化玻片30~60 min或室温下过夜老化玻片。老化好的玻片先后置37℃新鲜配制的RNase A溶液和盐酸胃酶溶液中分别孵育30 min和10 min,2xSSC溶液洗片2次各5 min,依次置于-20℃的70%乙醇、85%乙醇和100%乙醇中梯度脱水各2 min,晾干后加热至56℃,进行杂交试验。
1.4 原位杂交
在暗室按照检测试剂盒操作说明配制探针,73℃70%甲酰胺变性6 min,置45~50℃环境中备用。老化好的玻片置73℃70%甲酰胺中变性6 min,依次置于-20℃的70%乙醇、85%乙醇和100%乙醇中梯度脱水各3 min,晾干,置45~50℃烤片机上预热2~5 min,将10μL变性后的探针滴加于杂交区域,加盖盖玻片(避免产生气泡),42℃密封过夜。杂交后的玻片依次置于46℃50%(v/v)甲酰胺/2x SSC溶液和2x SSC溶液中洗涤,室温70%乙醇浸泡3 min。晾干后,DAPI复染15 min,封片。
1.5 结果观察
荧光显微镜下观察,通过Imstar FISH软件控制的CCD(ProgRes MFcool)摄取图像,每例分析100~200个间期细胞核。IGH探针正常显示2个红色和绿色融合的黄色荧光杂交信号,出现分离的红色或绿色荧光杂交信号为IGH重排;RBl、D13S319、p53和lq21探针正常均显示2个红色或绿色杂交信号,无或仅有1个杂交信号为该探针缺失,具有3个及以上杂交信号的则为该探针扩增。
1.6 结果判断
以15例非血液系统恶性疾病患者为对照组,计算各探针阳性细胞表达率的均值(x)和标准差(SD),并以x+3SD为阳性阈值。对于MM患者,其FISH检测的阳性细胞表达率大于阈值判定为阳性结果,小于阈值判定为阴性结果。
1.7 统计学处理
应用SPSS17.0统计软件对样本率进行x2检验和Spearman相关系数分析,P<0.05为差异有统计学意义。
2 结果
2.1 各探针阳性阈值的建立
对15例非血液系统恶性疾病患者的骨髓样本,每例分析100~200个间期核细胞,得到各探针阳性细胞表达率,计算均值(x)和标准差(SD),以x+3SD为阳性阈值。见表1。
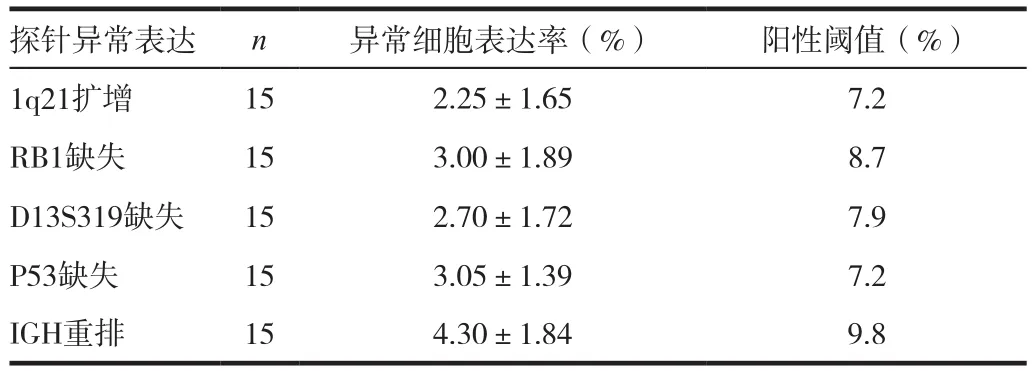
表1 各染色体探针杂交信号阳性阈值
2.2 39例MM患者探针异常表达分析
39例MM患者应用5种探针的检测情况如图1,A-C所示。各探针异常表达情况分析结果(表2)显示,1q21扩增、RB1缺失、D13S319缺失、p53缺失和IGH重排的检出例数(率)分别为 24例(61.5%)、15例(38.5%)、18例(46.2%)、8例(20.5%)和13例(33.3%)。总共31例(79.5%)存在染色体异常,23例(59.0%)存在至少两处染色体异常。Spearman相关性分析发现,lq21扩增与p53缺失呈显著性正相关(r=0.359,P=0.035);RB1和D13S319同时缺失15例,呈显著性正相关(r=0.854,P=0.000)。
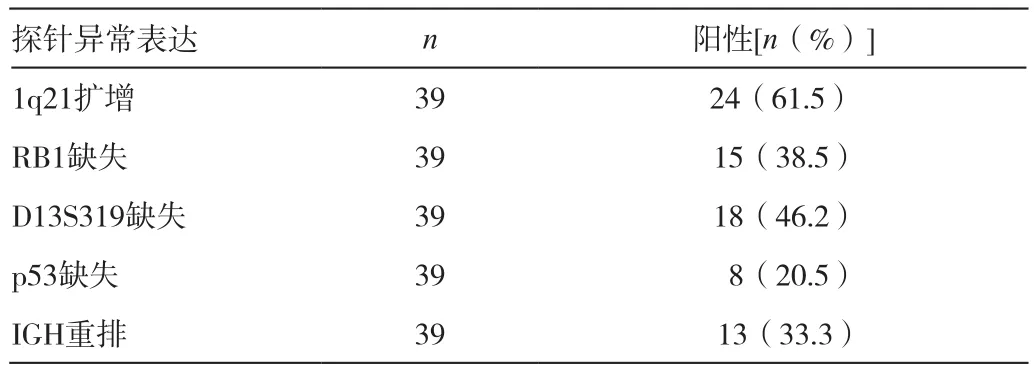
表2 39例MM患者5种探针异常表达情况分析
图1 5种探针的检测情况
2.3 染色体异常与分型、分期情况
染色体异常与分型、分期的情况见表3。结果显示:除IGH重排与DS分期之间(r=0.434,P=0.007)、p53缺失与IIS分期之间(r=-0.448,P=0.006)和D13S319缺失与免疫学分型之间(r=-0.335,P=0.040)呈显著相关性外,其余染色体异常与D-S分期、IIS分期和免疫学分型均无相关性。
3 讨论
早期对MM细胞的细胞遗传学和分子细胞遗传学研究表明,几乎所有的MM都存在克隆性染色体异常,且多为复杂核型异常,其中最为常见的是1、13、14和17号染色体结构或数目异常。本研究选用lq21、RBl、D13S319、p53和IGH共5种特异性探针检测异常表达率较高的1q2l扩增、13q14缺失、17p13缺失以及14q32易位。
研究结果显示,MM患者1q21扩增、RB1缺失、D13S319缺失、p53缺失和IGH重排的检出率分别为61.5%、38.5%、46.2%、20.5%和33.3%,其中发生率最高的是1q21扩增,其次是D13S319缺失。79.5%患者均存在染色体异常,其中复杂核型异常占59.0%。由于常规显带只有约1/3的患者检测结果为阳性[2],因此FISH技术相比传统检测方法,明显提高了核型异常的检出率,并证实MM的核型异常多为复杂核型异常。

表3 染色体核型异常与分型、分期之间关系[n(%)]
1q21区域存在与MM患者紧密相关的基因簇,其中包括IL-6受体基因,MM患者在受累的IL-6基因作用下,致使IL-6受体数目基因量效性增加,促进骨髓中浆细胞增殖分泌大量β2-MG,预后差、生存期短[3]。此外,CKSlB基因亦位于lq21区域,属于Cks/Sucl蛋白家族,能通过Skp2和p27K-依赖和非依赖机制促进MM瘤细胞的增殖,是MM预后不良因子[4-5]。研究显示1q21扩增的发生率为61.5%,高于国外研究结果,但与国内报道相符[6-7],说明中国人群MM患者lq21扩增比例较高。
RB1(13q14)和D13S319(13q14.3)是检测13q14缺失的两个主要部位。13q14缺失在MM发病机制中起重要作用,同时也是预示生存期短的重要指标,尤其是合并血清β2-MG升高者[8-9]。结果显示,13q14缺失的发生率为46.2%,但是13q14缺失与1q21扩增之间无相关性(r=0.309,P=0.098),与文献报道不符,有待于进一步扩大病例数来得出更精确的结论。
p53缺失并非MM特有的异常。研究结果显示,p53缺失在MM患者中的发生率为20.5%,在IIS分期中存在显著性差异(x2=7.169,P=0.021),且与IIS分期呈显著性负相关(r=-0.448,P=0.006),说明17p13缺失是疾病过程中较少的继发事件,且多发生在III期。Spearman相关性研究显示,p53缺失与lq21扩增呈显著正相关(r=0.359,P=0.035),结果支持近来国外研究报道:17p13缺失与1q21扩增共同参与激活血管新生级联反应,使骨髓微环境中的微循环血量增加,可能是导致MM发病的重要机制[10]。
14q32易位的发生率为33.3%,略低于相关的文献报道。14q32 易位机制较为复杂,包括 t(11;14)(q13;q32),t(4;14)(p16.3;q32.3),t(14;18)(q32.3;q21.3)等,主要涉及编码免疫球蛋白重链(IGH)的重链基因[11],FISH结果均表现为两个分离的红/绿杂交信号。大量实验证实存在t(11;14)患者预后稍好,伴有t(4;14)的患者预后较差。IGH探针虽然能够发现14q32易位,却不能表明与哪条染色体进行了易位重排,其预后价值有待进一步证实。对MM分期研究结果显示,IGH重排在疾病分期中有显著性差异,且与D-S分期呈显著性正相关(r=0.434,P=0.007)。在所研究的5种染色体探针中,D-S分期I期的MM患者有3/7例仅表达出IGH重排异常。这些结果均说明IGH重排是MM染色体异常的一个早期事件。
综合上述,lq21扩增、13q14缺失、p53缺失及IGH重排是MM常见的核型异常,前三者是MM发展及预后的不良因素。FISH技术是检测分子遗传学异常高度敏感的方法,应当作为评估MM常规检查。
[1]中国多发性骨髓瘤研究组.中国多发性骨髓瘤诊治指南[J].中华内科杂志,2008,47(10):869-872.
[2]罗绍凯,苏畅,王晓桃,等.102例多发性骨髓瘤临床资料分析[J].临床血液学杂志,2008,21(3):115-116.
[3]Shaughnessy J,Zhan F,Burington B,et a1.A validated gene expression model of hIGH-risk multiple myeloma is defined by disregulated expression of genes mapping chromosome 1[J].Blood,2007,109(6):2276-2284.
[4]Zhan F,Colla S,Wu X,et a1.CKSlB,overexpressed in aggressive disease,regulates multiple myeloma growth and survival through SKP2-and p27Kipl-dependent andindependent mechanisms[J].Blood,2007,109(11):4995-5001.
[5]Shaughnessy J.Amplification and overexpression of CKS1B at chromosome band lq21 is associated with reduced levels of p27 and an aggressive clinical course in multiple myeloma[J].Hematology,2005,10(suppl 1):117-126.
[6]Chng WJ,Van Wier SA,Ahmann GJ,et al. A validated FISH trisomy index demonstrates the hyperdiploid and nonhyperdiploid dichotomy in MGUS[J].Blood,2005,106(6):2156-2161.
[7]杨瑞芳,李春溟,陈丽娟,等.荧光原位杂交技术检测MM分子遗传学改变及其意义[J].中华医学遗传学杂志,2010,27(5):567-570.
[8]Saughnessy J,Tian E,Sawyer J,et a1.High incidence of chromosome 13 deletion in multiple myeloma detected by multiprobe interphase FISH[J].Blood,2000,96(4):1505.
[9]Facon T,Aver-Leiseau H,Guillerm G,et a1.Chromosome 13 abnormaliies identified by FISH analysis and serum β2-microglobulin produce a powerful myeloma staging system for patients receiving hIGH-dose therapy[J].Blood,2001,97(6):1561-1577.
[10]Jens H,Christian MZ,Andreas N,et a1.Gain of lq21 and distinct adverse cytogenetic abnormalities correlate with increased microcirculation in multiple myeloma[J].Int J Cancer,2008,122(12):2871-2875.
[11]王志敏,丛雅琴,马立宁,等.Cyr61和VEGF在慢性髓细胞白血病中的表达及相关性探讨[J].临床血液学杂志,2009,22(7):354-356.

