醛固酮与转化生长因子-β1在心肌纤维化中的作用机制
李林锋,王 洪,刘朝晖,罗 汛,洪 浪
(江西省人民医院心内科,南昌330006)
慢性心力衰竭是常见而严重的临床问题,是各种心脏疾病的最终转归。心肌病变是心力衰竭的基本病因,在各种原因造成的心肌病变中心肌纤维化起着十分重要的作用,因此进一步了解心肌纤维化的发病机制,并采取相应的干预治疗是延缓和防止心力衰竭发生、发展的关键。
近年来很多研究[1]表明,醛固酮具有显著的促心肌纤维化作用。但关于具体机制的研究并不多。转化生长因子-β1 (transforming growth factor-β1,TGF-β1)属TGF-β超家族,是一种多功能的细胞间信号蛋白,调节多种靶基因的表达,在细胞增殖、分化及细胞外基质合成中发挥重要作用。Smads蛋白是目前所知主要的TGF-β1受体胞内激活底物,介导TGF-β1信号的胞内转导。当TGF-β1通路被激活,受体激活型Smads与抑制型Smads之间的平衡被打破,就会导致心肌纤维化的发生[2-3]。
本研究旨在通过探讨醛固酮致心肌纤维化的过程中对TGF-β1/Smads信号通路的调节及对下游因子的影响,进一步阐明醛固酮致心肌纤维化的机制,从而为心肌纤维化的干预研究提供理论基础和作用靶点。
1 材料与方法
1.1 动物和试剂
出生3 d内的SD大鼠,雌雄不限,购于南昌大学动物中心;醛固酮、依普利酮购于Sigma公司;DMEM培养基、胰蛋白酶购于美国Gibco公司;胎牛血清购于奥地利PAA公司;波形蛋白单克隆抗体、纤维连接蛋白单克隆抗体、平滑肌肌动蛋白单克隆抗体为美国Santa Cruz公司产品;SABC试剂盒为武汉博士德公司产品;TGF-β1酶联免疫试剂盒购自Genzyme公司;PlusSYBRPrimeScriptRTPCR Kit购自大连宝生物公司。
1.2 方法
1.2.1 细胞培养及鉴定
采用胰酶消化法和贴壁差速分离法获取心肌成纤维细胞(CFs)。无菌条件下取出新生3 d内SD大鼠心室,立即置入40℃PBS液,漂洗,剪碎,加入胰酶,反复消化,收集上清液,离心5 min;弃上清,加入含10%新生牛血清的DMEM,5%CO2,37℃细胞培养箱中培养90 min;差速贴壁法分离CFs。待CFs生长接近融合时按1∶3比例传代。实验采用第2和第3代细胞。培养的细胞于倒置显微镜下观察形态,采用免疫组织化学SABC法鉴定,波形蛋白、纤维连接蛋白染色阳性、平滑肌肌动蛋白阴性鉴定为所需CFs,纯度为98%。
1.2.2 实验分组及细胞处理
ELISA检测培养液中TGF-β1时,予低浓度(1%胎牛血清)DMEM预适应24 h后,将获取的CFs随机分为5组,每组5只,培养液5mL。对照组:不予任何处理; 醛固酮组:1×10-7mol·L-1的醛固酮;醛固酮+依普利酮组:1×10-7mol·L-1的醛固酮+1×10-5mol·L-1的依普利酮(预处理 2 h);依普利酮组:1×10-5mol·L-1的依普利酮。培养72 h后,收集培养液,-20℃保存。SB43l542预处理组:RT-PCR检测Smad2、Ⅰ型胶原、Ⅲ型胶原表达时增加TGF-β1受体拮抗剂(SB431542)+醛固酮。
1.2.3 培养液中TGF-β1水平的测定
应用ELISA法检测各组TGF-β1水平,按试剂盒说明书步骤进行,酶联免疫检测仪测450 nm波长OD值。根据标准曲线,计算TGF-β1浓度。
1.2.4 RT-PCR检测Smad2、Ⅰ型胶原、Ⅲ型胶原的表达
取 1×106个细胞,加入 1 mL RNAiso,充分混匀,吹打数次。采用氯仿异丙醇法抽提细胞总RNA。按照PlusSYBRPrimeScriptRT-PCR Kit试剂说明书,反转录合成cDNA。Smad2上游引物:5′-ATGTCGTCCATCTTGCCATT-3′,下游引物:5′-GTCCCCAAATTTCAGAGCAA-3′;Ⅰ型胶原上游引物:5′-ACATGTTCAGCTTTGTGGACC-3′,下游引物:5′-TAGGCCATTGTGTATGCAGC-3′;Ⅲ型胶原上游引物:5′-TGGTAGAAAGGACACAGAGGC-3′,下游引物:5′-TCCAACTTCACCCTTAGCACC-3′;β-actin 上游引物 5’-GCATCCCCCAAAGTTCACAA-3’;下游引物 5’-AGGACTGGGCCATTCTCCTT-3’。依照说明书操作,采用ABI 7500 Fast Real-Time PCR System,反应条件如下:SYBR Premix Ex TaqTMII 10 μL,PCR Forward Primer 0.8 μL,PCR Reverse Primer 0.8 μL,ROX Reference Dye or Dye II 0.4 μL,RT 反应液 2μL,DEPC水6μL。95℃预变性30 s;95℃5 s,60 ℃ 34 s,40 个循环。
1.2.5 统计学方法
2 结果
2.1 ELISA检测各组CFs中TGF-β1水平
与对照组相比,依普利酮组处理不影响CFs的TGF-β1分泌,醛固酮刺激后,能显著促进CFs分泌TGF-β1,而依普利酮预处理后可以抑制醛固酮促CFs分泌 TGF-β1 的作用(图 1)。

图1 醛固酮对CFs分泌TGF-β1的影响(n=5)
2.2 RT-PCR
与对照组相比,醛固酮处理后,显著上调Smad2、Ⅰ型胶原、Ⅲ型胶原的表达,而依普利酮预处理后可以抑制醛固酮诱导的Ⅰ型胶原、Ⅲ型胶原表达。在SB43l542预处理组,其结果与依普利酮组相似,能显著抑制Ⅰ型胶原、Ⅲ型胶原表达(图2)。

图2 醛固酮对SmadmRNA表达的影响

图3 醛固酮对Ⅰ型胶原mRNA表达的影响
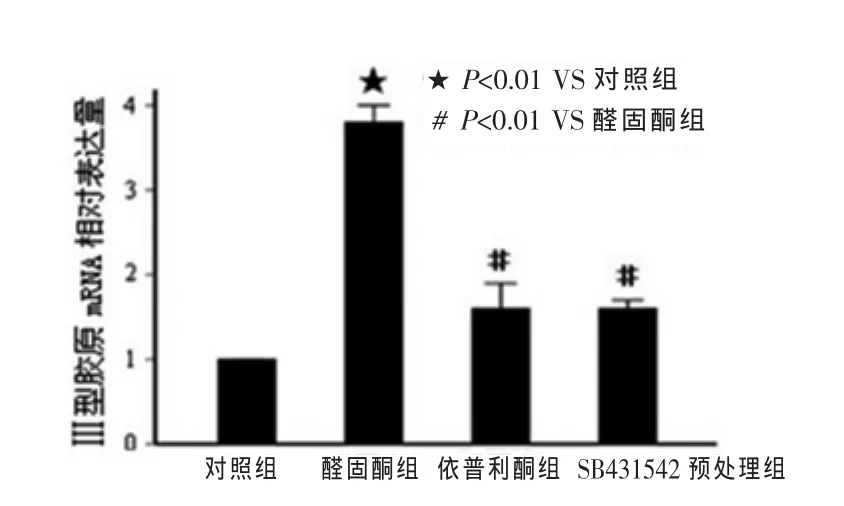
图4 醛固酮对Ⅲ型胶原mRNA表达的影响(n=5)
3 讨论
多年前,人们就已经发现,心脏局部具有合成醛固酮的能力[4],而且心脏中多种细胞存在醛固酮特异性受体[5],心脏的醛固酮是导致心肌纤维化形成和发展的一个重要因素[6],且不依赖于其调节体液以及电解质的作用,但其具体机制并不十分清楚。
CFs是心肌纤维化的主要效应细胞,CFs增殖、间质中胶原沉积增加、比例失调、排列紊乱是心肌纤维化的病理基础。心肌纤维化与CFs合成和分泌多种生物活性物质有关。其中TGF-β1被广泛关注,TGF-β1对成纤维细胞有强烈的趋化作用,促使成纤维细胞分泌大量的细胞外基质。研究表明,成纤维细胞在TGFβ1的作用下,先合成大量的纤维连接蛋白,随后Ⅰ、Ⅲ型胶原表达增多[7]。 Smads蛋白是TGF-β1信号通路重要的下游调节因子,TGF-β1首先与Ⅱ型受体结合,Ⅱ型受体与跨膜Ⅰ型受体相连并磷酸化后激活Smads蛋白,Smads蛋白具有特异的DNA结合活性,可以发挥转录因子的功能,调节相关的细胞因子基因表达(如血小板源性生长因子、成纤维细胞生长因子、肿瘤坏死因子等),导致纤维化[8]。 而下调或抑制 TGF-β1/Smads的表达能减少胶原合成,改善心肌纤维化[9]。因此,笔者推测醛固酮通过激活TGF-β1/Smads信号通路在促进心肌纤维化发生。
在本实验中,首先,笔者观察到醛固酮处理后,能显著增加TGF-β1水平,而依普利酮组后可以抑制醛固酮诱导的TGF-β1分泌,而单纯依普利酮对CFs分泌TGF-β1的作用无影响。其次,醛固酮组Smad2、Ⅰ型胶原和Ⅲ型胶原表达增加,而依普利酮预处理后可明显抑制其表达,更重要的是,TGFβ1受体抑制剂SB43l542也可以抑制Smad2、Ⅰ型胶原和Ⅲ型胶原表达。这表明醛固酮通过激活TGF-β1/Smads信号通路,增加Ⅰ型胶原和Ⅲ型胶原的表达,从而导致心肌纤维化。而依普利酮能抑制醛固酮激活TGF-β1/Smads信号通路,抑制心肌纤维化。
本实验结果提示醛固酮通过依普利酮调控成纤维细胞TGF-β1水平,TGF-β1作用其受体,激活细胞内信号传导因子Smad2,调控下游多种目的基因的表达,促使Ⅰ型胶原和Ⅲ型胶原的积聚,导致心肌纤维化。
[1] Guo P,Wu C,Masaki T,et al.Subdose of fasudil suppresses myocardial fibrosis in aldosterone-salt-treated uninephrectomized rats[J].Pharmazie,2011,66(9):716-719.
[2] Wang B,Omar A,Angelovska T,et al.Regulation of collagen synthesis by inhibitory Smad7 in cardiacmyofibroblasts[J].Am JPhysiol Heart Circ Physiol,2007,293(2):1282-1290.
[3]Laping N,Grygielko E,Mathur A,et al.Inhibition of transforming growth factor(TGF)β1-induced extracellular matrix with a novel inhibitor of the TGFβ1 type I receptor kinase activity:SB-431542[J].Mol Pharmacol,2002,62:58-64.
[4]Silvestre JS,Robert V,Heymes C,et al.Myocardial production of aldosterone and corticosterone in the rat.Physiological regulation[J].JBiolChem,1998,273:4883-4891.
[5]Lombes M,Alfaidy N,Eugene E,et al.Prerequisite for cardiac aldosterone action.Mineralocorticoid receptor and 11β-hydroxysteroid dehydrogenase in the human heart[J].Circulation,1995,92(2):175-182.
[6]Tsai C T,Tseng C D,Hwang JJ,et al.Tachycardia of atrial myocytes induces collagen expression in atrial fibroblasts through transforming growth factor β1[J].Cardiovasc Res,2011,89(4):805-815.
[7]Qi S,den Hartog G J,Bast A,et al.Superoxide radicals increase transforming growth factor-beta1 and collagen release from human lung fibroblasts via cellular influx through chloride channels [J].Toxicol Appl Pharmacol,2009,237(1):111-118.
[8]Ren M,Wang B,Zhang J,et al.Smad2 and Smad3 asmediators of the response of adventitial fibroblasts induced by transforminggrowth factorβ1[J].MolMed Report.2011,4(3):561-567.
[9]Peng H,Carretero O A,Brigstock D R,et al.Ac-SDKP reverses cardiac fibrosis in rats with renovascular hypertension[J].Hypertension,2003,42(6):1164-1170.

