EGF诱导肝癌细胞系HepG2增殖及其作用机制
陈少卿,汪小浪
(南昌大学第一附属医院肿瘤科,南昌 330006)
原发性肝癌是最常见的消化系统恶性肿瘤之一,严重威胁人民群众的生命及健康,全世界每年新发肝癌患者约60多万,居恶性肿瘤的第5位,东亚及环太平洋地区是肝癌高发地区,我国新发肝癌人数占全球人数一半以上;我国发病率高的原因在于我国乙肝患病人数多,丙型肝炎的发病率近年亦有明显的上升趋势,肝癌多在乙肝、丙肝等慢性肝炎后肝硬化的基础上产生;肝癌的治疗手段主要是手术切除、介入治疗、靶向治疗及中医治疗等方法,但由于原发性肝癌治疗的敏感性差,且大部分患者就诊时已经晚期,因此,预后非常差,1995年卫生部统计,我国肝癌年死亡率已达20.4/10万人,仅次于胃癌,居第2位[1-3]。因此,揭示肝癌细胞的发生、发展以及侵袭转移过程中异常信号的转导机制,可以为肝癌的临床治疗提供新的思路和理论依据。
表皮生长因子(EGF)是生长因子家族的主要成员之一,属于胞外信息物质,其作用方式是通过与靶细胞上特异性表皮生长因子受体(EGFR)结合,从而诱导受体自身磷酸化,活化的EGFR可激活众多的下游信号途径,从而产生相应的生物学效应[4]。EGFR又称C-erbB受体,基因位于7q11.13,具有酪氨酸蛋白激酶活性。EGFR结构可分为胞外区、跨膜区和胞内区3个部分[5],胞外区与配体结合而被激活,通过胞内侧激酶反应将胞外信号传至胞内,经下游信号传导途径影响细胞的增殖分化。本研究通过观察EGF对肝癌细胞系HepG2增殖的影响,初步探讨C-erbB2在其中的作用机制。
1 材料与方法
1.1 材料
人肝癌细胞株HepG2(上海鑫闵生物科技有限公司),EGF(Sigma),Trizol(Takara),Taq 酶(Promega),DEPC(博大泰克产品),Marker(Promega),OligdT(Promega),MMLV 逆转(Promega)。β-Actin 引物序列:上游 5’-GTGGGCCGCTCTAGGCA-3’,下游 5’-CTCTTT-GATGTCAGCACGA-3’,扩增片段长度243 bp(上海生物工程中心合成);C-erbB2引物序列:上游 5’-AGCTGCACTGTGGATGTCAG-3’,下游 5’-GAGCCTTCGGCACTGTCTAC-3’,扩增片段长度201 bp(上海生物工程中心合成)。
1.2 实验方法
1.2.1 细胞培养
细胞常规培养在含10%小牛血清的DMEM培养液中。取对数生长的肝癌细胞,胰酶消化接种后,在无血清DMEM培养液中,置于37℃、5%CO2的孵箱培养8 h,需药物处理的4组分别加入EGF至终浓度分别为 0.1、1、10、100 μg·L-1,对照组不加药,继续培养6 h。
1.2.2 MTT增殖指数
按每孔2×105个细胞接种于24孔板,分别以不同浓度的EGF加入DMEM培养基,培养48 h,加入5 g·L-1的MTT溶液20μL,继续培养2 h。弃上清,加入DMS0 200μL,摇晃 5 min,取 150μL加入 96孔板中。在酶标仪波长492 nm处测A值。设4个复孔。根据MTT结果、酶标法观测肝癌细胞株吸光度值。
1.2.3 RT-PCR检测
1)总RNA的提取:将培养的1×107肝癌细胞分为对照组、EGF组。加入0.5mL Trizol,剧烈震荡后加 0.1 mL氯仿,剧烈摇晃 15 s,以 10 000 g,4℃离心20min。转移水相,加预冷的异丙醇,放置10min,10 000 g,4℃离心20min,离心后在管底见RNA胶片状沉淀。经75%的乙醇洗脱后,RNA沉淀物在室温下自然干燥,用0.1%的DEPC水15μL溶解后56℃水浴10min。
2)逆转录:提取的总 RNA 加入 3 μL Olig(dT),70℃孵育5min后置于冰上5min。依次加M-MLV逆转录酶 1μL、M-MLV Buffer 5 μL、Rnase inhibitor 1μL、Dntp 1.5μL,DEPC水加至 25μL,37℃水浴 60 min,合成 c-DNA。
3)PCR:反应体系为 c-DNA 5 μL、上下游引物(目的引物和 β-Actin)各 1 μL、dNTP 1.5 μL、10×Buffer 5 μL、25 mmol MgCl21 μL、Taq 酶 0.5 μL,加DEPC水至50μL。简单离心后上覆石蜡油50μL。94℃预变性 5min后,PCR 程序为:94℃ 60 s,56℃55 s,72℃60 s,35个循环。最后一个循环延伸5min结束。
4)琼脂糖凝胶电泳:将PCR扩增产物和Marker在2%的琼脂糖凝胶中电泳30min(电压为100 V),最后在自动凝胶成像系统下观察、照相并分析。
1.3 判断标准
利用自动凝胶成像系统,C-erbB2 mRNA的表达水平用相对量表示,即C-erbB2 mRNA条带密度扫描数值除以本组内对照β-Actin的扫描数值求得一个相对比值。
1.4 统计学方法
2 结果
2.1 EGF对肝癌细胞系HepG2增殖作用的影响
10μg·L-1EGF组的吸光度 A值比对照组高22.2%(P<0.05),比 0.1 μg·L-1EGF 组高 20.5%(P<0.05),比 1 μg·L-1EGF 组高 13.0%(P<0.05),和 100 μg·L-1EGF组的吸光度A值相比差异无统计学意义(P>0.05)。见图1。结果提示,EGF可促进肝癌细胞系HepG2的增殖,并与其剂量有关。
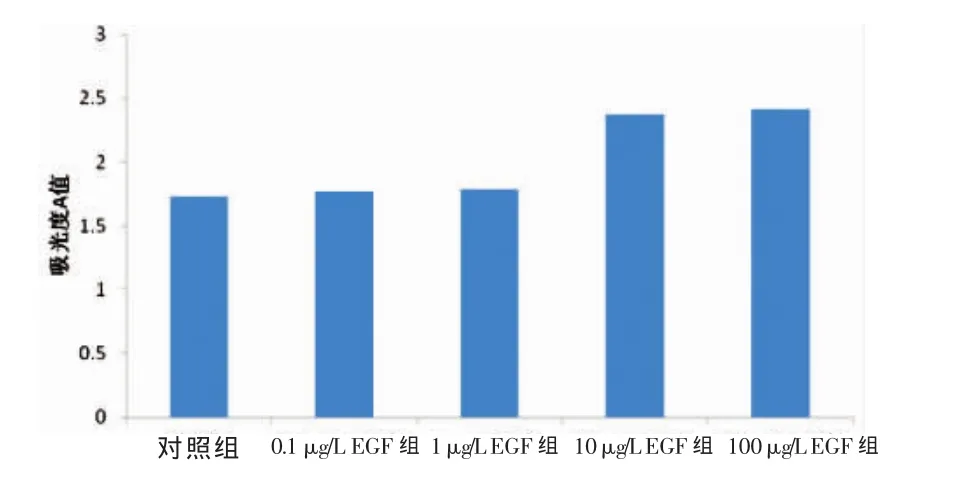
图1 各组吸光度A值比较
2.2 C-erbB2 m RNA在EGF诱导肝癌细胞系HepG2增殖中的表达变化
选取10μg·L-1为EGF的最佳作用浓度,将细胞株分成2组,分别为对照组和EGF组。利用RTPCR技术测定各组C-erbB2mRNA的表达情况。结果显示在Marker为297、210 bp的电泳条带之间,可见扩增片段长度为243 bp的β-actin的电泳条带。在210 bp的Marker电泳条带附近,对照组、EGF组均可见扩增长度为201 bp的电泳条带。而且EGF组的条带明显亮于对照组 (图2)。分别用各组C-erbB2 mRNA条带光密度值除以本组内对照β-Actin的光密度值发现,EGF组、对照组的比值分别为1.14、0.39(图 3),与对照组相比,差异具有统计学意义(P<0.05)。提示,EGF可以增强C-erbB2mRNA的表达。
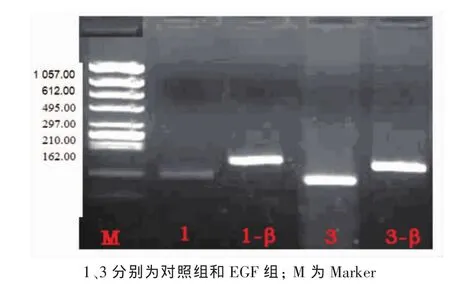
图2 2组C-erbB2mRNA的表达
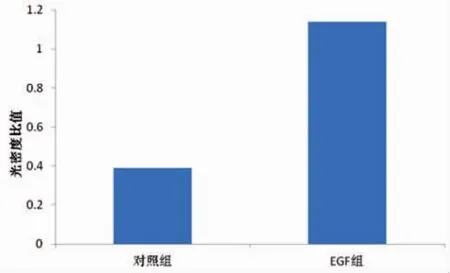
图3 2组C-erbB2mRNA光密度比值分析
3 讨论
EGF是Cohen于1962年首次从成年雄鼠的颌下腺分离提纯的一种单链多肽[6]。它是一种强有力的细胞分裂促进因子,能促进体内多种细胞的分裂和增殖。一般认为其作用于细胞膜EGFR,激活氨酸蛋白激酶,在细胞内信使三磷酸肌醇(IP3)或Ca2+等的参与下,作用于与细胞生长、增殖有关的蛋白质或因子,从而调控细胞核内基因的转录。EGFR家族由4个成员C-erbB1、C-erbB2、C-erbB3及 C-erbB4组成,是受体型的酪氨酸蛋白激酶(receptor tyrosine protein kinase,RPTK)。EGF对人正常肝细胞的增殖有明显的作用,其主要是通过调节EGFR的数量和代谢等环节刺激DNA的合成,从而刺激肝细胞的增殖[7]。但对肝癌细胞的作用目前研究尚不一致。有人认为EGF对癌细胞的生长起促进作用,它可以使正常细胞恶变[6],在卵巢癌及乳腺癌中,C-erbB2 的高表达,并与肿瘤的恶性程度和预后相关[8-9]。但也有人认为EGF对肿瘤的生长起抑制作用,体外撤去长期作用的EGF,可使正常的细胞恶变,说明EGF可维持细胞的正常性状[10]。可见,EGF对肝癌细胞的作用尚不明确,其中的作用机理亦未明了。
本文研究发现,EGF能呈剂量依赖方式诱导肝癌细胞系HepG2的增殖,和戚之琳等[11]报道的一致,10μg·L-1EGF可显著增强肝癌细胞系HepG2 C-erbB2mRNA的表达,其机制可能与上调原癌基因C-erbB2的表达有关。曲娴等[12-13]报道EGF与其受体结合后,能刺激肿瘤细胞增殖,促进肿瘤细胞转移。所以EGFR信号途径与肿瘤增殖、转移、化疗耐药和抗凋亡作用之间存在着一定的联系。分析原因,可能是C-erbB2胞外段结合EGF后,引发变构形成二聚体,激活RPTK,引起胞内段酪氨酸自身磷酸化。后者催化多种底物酪氨酸残基磷酸化,从而启动、催化与肝癌细胞生长、增殖有关的生化过程[14]。戚之琳等[11]在实验中观察到EGF能够促进肝癌细胞的增殖和体外迁移能力,而MAPK信号通路抑制剂PD98059对肝癌细胞的增殖和迁移能力则具有抑制作用,RT-PCR结果表明EGF促进细胞增殖的机制可能是上调了肝癌细胞中Survivin基因的表达水平。戚之琳等[11]认为EGF还可能通过MAPK信号通路促进肝癌细胞的增殖及迁移侵袭,Survivin基因表达的改变可能是通过MAPK信号转导途径而实现的,EGF/MAPK信号通路可以作为肝癌细胞增殖和转移的治疗靶点,为临床肝癌的治疗提供了新的思路。然而,EGF调控肝癌细胞株增殖的其他信号通路有待于进一步研究。
[1]周宁新.肝胆胰脾外科实践[M].北京:科学技术出版社,2005:71-78.
[2]张启,钱礼.腹部外科学[M].北京:人民卫生出版社,2006:556-557.
[3]夏穗生.现代腹部外科学[M].2版.武汉:湖北科学技术出版社,2007:424.
[4]乐志培.表皮生长因子受体功能与转化蛋白的关系[J].生物化学通讯,1989,2(1):9-12.
[5]Jorissen R N,Walker F,Pouldt N,et al.Epidermal growth factor receptor mechanisms of activation and signaling[J].Exp Cell Res,2003,284(1):31-53.
[6]Murata H,Kawano S,Tsuji S,et al.Cyclooxygenase-2 overexpression enhances lymphatic invasion and metastasis in human gastric carcinoma [J].Am JGastRoenterol,1999,94(2):451-455.
[7]Ohno R,Yoshinaga K,Fujita T,etal.Depth of invasion parallels increased Cyclooxygenase-2 level in patients with gastric carcinoma[J].Cancer,2001,91(10):1876-1881.
[8]鲁艳明,王亚军.EGFR和C-erbB2蛋白在卵巢浆液性肿瘤组织中的表达及其临床意义[J].中国医科大学学报,2004,33(2):147-150.
[9]Tsujii M,Dubois R N.Alterations in cellular adhesion and apoptosis in epithelial cells overexpressing prostaglandin endoperoxide synthase [J] Cell,1995,83(2):493-501.
[10]Maeda K,Kang S M,Onoda N,et al.Epidemal growth factor expression in preoperative biopsy specimens correlates with disease recurrence in patients with early gastric carcinoma [J].Cancer,1999,86(4):566-571.
[11]戚之琳,毕富勇.EGF调控HepG2细胞增殖和迁移的分子机制[J].皖南医学院学报,2009,28(4):248-250.
[12]曲娴,陈杰.表皮生长因子受体反义寡核苷酸抑制人结肠癌细胞的增值[J].世界华人消化杂志,2006,14(35):3414-3416.
[13]张晓晶,王更生,刘云鹏.EGFR信号通路调控结肠癌Caco2细胞侵袭转移的分子机制[J].第三军医大学学报,2006,28(14):1479-1482.
[14]Wiley L M,Adamson E D.Epidermal growth factor receptor function in early mammaliam development[J].Biol Essays,1995,17(10):839-846.

