虎尾兰的组织培养技术研究
黄凤兰,李 静,张 茜,张 群,赵玲玲,聂民利
(1.东北林业大学生命科学学院,哈尔滨 150040;2.内蒙古民族大学生命科学学院,内蒙古 通辽 028000)
虎尾兰(Sansevieria trifasciatavar.harnii)又称虎皮兰、千岁兰,是龙舌兰科虎尾兰属,多年生常绿肉质草本植物[1],原产非洲西部,具有较强的耐寒性,且极少发生病虫害,养护较为容易[2]。同时还有净化空气的功效,是优良的室内环保植物,被人们称为“天然的清道夫”[3-5]。虎尾兰的常规繁殖是用扦插或分株方法[6],但是扦插和分株法繁殖率低,时间较长,而且不易获得大量的植株,且会出现品种退化现象,金边虎尾兰金边性状易消失,影响观赏质量[7]。而采用组织培养育苗方法具有繁殖系数高、保持原品种特性、避免种性分离、种苗不带病毒、生长一致等优点,从而使种苗生产达到规模化、标准化和工厂化的目标。本试验以短叶虎尾兰为研究对象进行组织培养试验,以叶片为外植体,诱导其再生植株,摸索虎尾兰在不同的组织培养阶段所需的培养条件,从而为短叶虎尾兰的组织培养体系的建立奠定技术基础。
1 材料与方法
1.1 材料
选用生长健壮的短叶虎尾兰叶片为试材(见图1),2009~2010年期间在内蒙古民族大学生命科学学院组培室内进行。
1.2 培养基及培养条件
基本培养基为MS培养基[8-10],加入不同的植物生长调节物质,在培养基中添加蔗糖30 g·L-1,琼脂7 g·L-1,pH 5.6~5.8,室内培养温度(25±2)℃,每天光照12 h,光强1 500 lx。

图1 短叶虎尾兰Fig.1 Short leaf orchid
1.3 方法
1.3.1 材料的消毒处理及升汞灭菌时间的筛选
剪取幼嫩的叶片,用流水冲洗30 min以上,再用75%的酒精处理30 s,在0.1%的HgCl2中灭菌,时间设定3、5和8 min共3个梯度,然后用无菌水涮洗8~10次,接种到MS培养基中培养。观察污染情况,计算污染率。污染率(%)=污染的外植体个数(个)/接种的外植体个数(个)×100%。
1.3.2 愈伤组织诱导阶段植物生长调节物质(PGR)最佳浓度配比的筛选
将消毒处理过的外植体分别接种到MS+6-BA(1、2、3 mg·L-1)+NAA(0.3、0.5、0.8 mg·L-1)+2,4-D(0.3、0.5、0.8 mg·L-1)共28个处理组合的培养基中(见表1),25 d后统计各处理组合萌动的外植体数和诱导出的愈伤外植体数,计算萌动率(%)=萌动的外植体个数(个)/接种的外植体个数(个)×100%和愈伤诱导率(%)=长愈伤的外植体数(个)/接种的外植体数(个)×100%,根据结果进行下一步试验,计算平均相对生长速率(%)=30 d增重量(g)/原有重量(g)×100%[11]。
1.3.3 愈伤组织分化阶段PGR最佳浓度配比的筛选
将胚状体分别接种到MS+6-BA(1、2、3、4 mg·L-1)+NAA(0.3、0.5、0.8、1.0 mg·L-1)共 16 个处理组合的培养基中(见表2),接种40 d后开始统计每个处理外植体长芽的个数,计算分化率。分化率(%)=芽的个数(个)/接种的胚状体数(个)×100%,筛选出芽诱导阶段的最佳PGR配比。

表1 愈伤组织诱导阶段的PGR浓度配比Table 1 Ratio of PGR concentration at callus induction phase
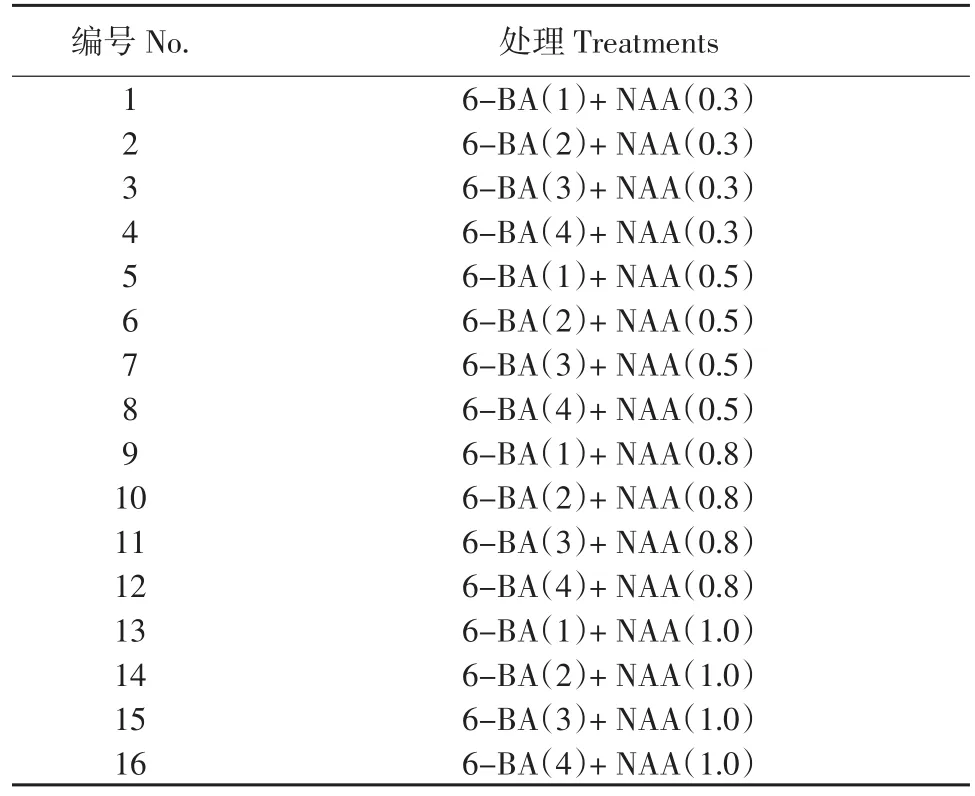
表2 芽诱导阶段的PGR浓度配比Table 2 Ratio of PGR concentration at bud induction phase
1.3.4 生根阶段NAA最佳浓度的筛选
目前净水器产业虽然已经比较成熟,但产品依旧存在很多难点需要攻克。例如净水器净化速度慢、净化效果无法确认、废水比太高、噪音大等等问题。尽善尽美无论任何事物都无法做到,但两全其美的净水器却是能够实现的。
将芽分别接种到MS+NAA(0.0、0.1、0.3、0.5、0.8、1.0 mg·L-1)共6个处理的培养基中,每个处理接种1瓶,3个芽,接种37 d后统计生根情况,筛选出根诱导阶段的最佳NAA浓度。
1.3.5 炼苗、移栽
待培养苗的根长到3~5 cm时即可炼苗、移栽。炼苗时需要去除封口膜,在培养基表面加上薄薄的一层自来水,至于散射光下3~5 d。移栽后,最初10~15 d要通过喷雾或罩上透明的塑料以保持很高的湿度(90%~100%),在塑料罩上打些小孔,以利于气体交换。在保湿数天后,可把植株搬入温室,但仍须遮阴数日,4~6周后即可让小苗在正常的温室或田间条件下生长[12]。
2 结果与分析
2.1 外植体最佳升汞消毒时间的筛选结果
将外植体分别用0.1%的升汞处理3、5和8 min,15 d后统计外植体的污染率,统计结果见表3。由表3可以看出,升汞消毒3 min接种的外植体没有污染,升汞消毒5 min和升汞消毒8 min接种的外植体污染率也很低,但是考虑到升汞对外植体有毒害,所以选择升汞的消毒时间为3 min。

图2 刚接种后的虎尾兰叶片的生长状态Fig.2 Growth state of orchid blade inoculated justly
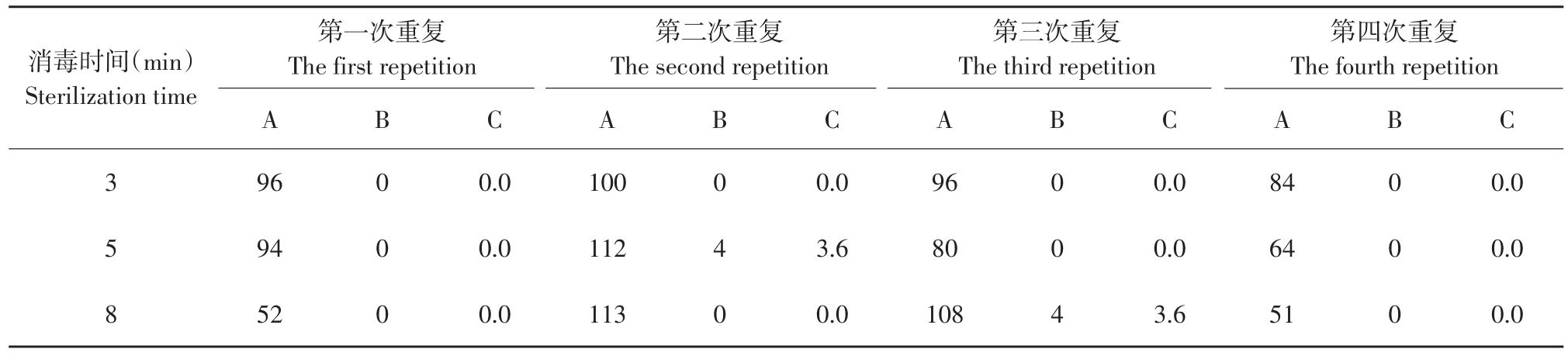
表3 不同消毒时间对外植体生长状况的影响Table 3 Effect of different sterilization time on explants growth state
2.2 愈伤组织诱导阶段生长调节物质(PGR)最佳浓度配比的筛选
将叶片接种到MS培养基中,1~15号处理在10月12日接种,接种54 d后观察生长状态并统计,统计结果见表4。由表4可知,5、9、13号处理与其他处理相比较萌动率和愈伤诱导率均比较高。
选择生长状态好且状态一致的愈伤组织材料分别接种到5、9、13、16、22、23号处理中,接种时间为1月14日,于接种后30 d观察统计,计算其平均生长速率,统计结果见表6。由表6可以看出,5号处理与其他处理相比较,平均相对生长速率增加最多,达到42.3%,因此5号PGR浓度(1 mg·L-16-BA+0.5 mg·L-1NAA+0.5 mg·L-12,4-D)最适合诱导愈伤组织(见图3)。
2.3 愈伤组织分化阶段PGR最佳浓度配比的筛选结果
将状态一致的胚性愈伤组织在1月14日分别接种到1~16号处理中,接种后60 d观察胚性愈伤组织的生芽状况并统计,统计结果见表7。由表7可以看出,9号处理的芽分化率最高,达到233%。由此可知,9号处理PGR的配比浓度(1 mg·L-16-BA+0.8 mg·L-1NAA)适宜诱导芽的生成(见图4)。
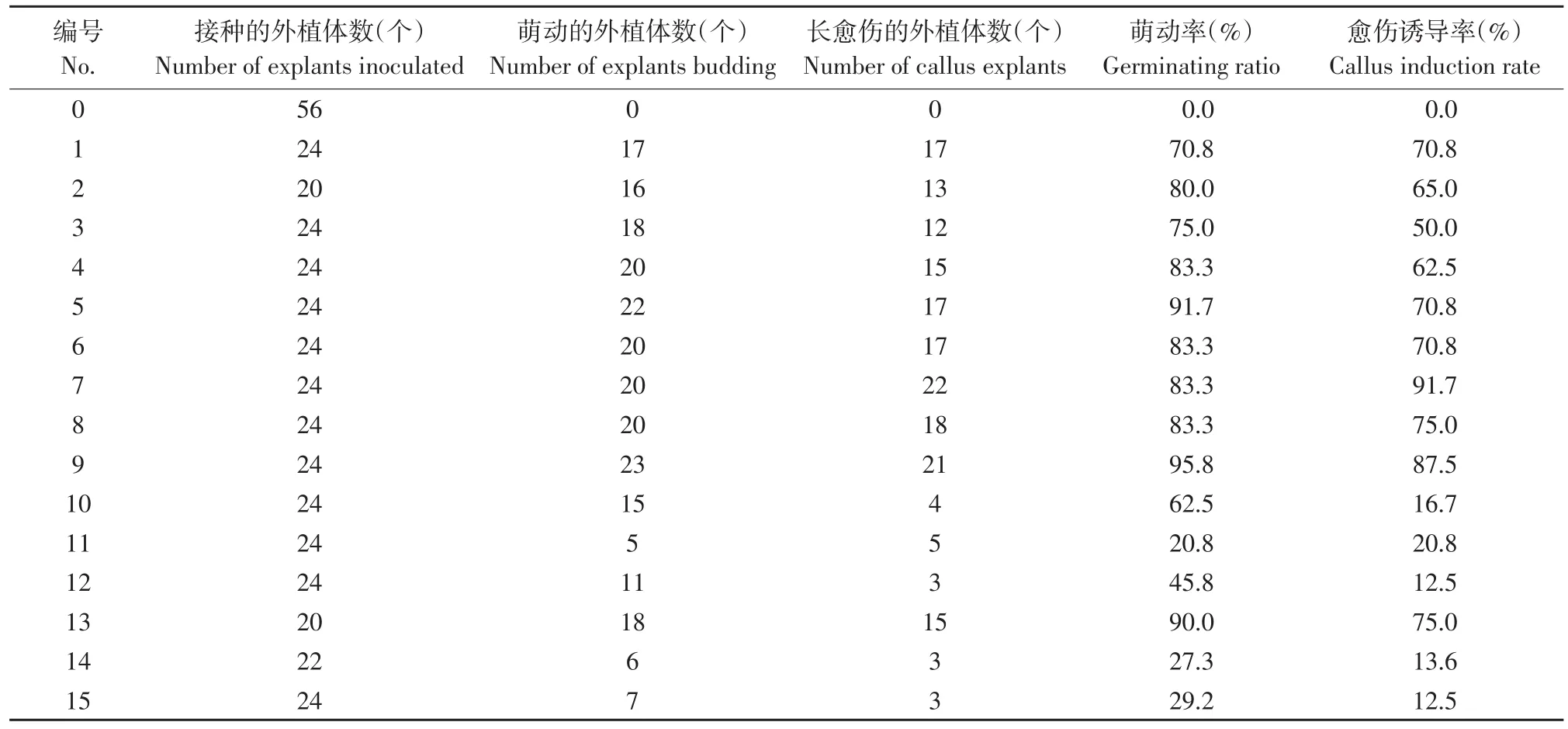
表4 愈伤诱导阶段接种54 d后不同PGR浓度外植体的生长状况Table 4 Growth state of explants of different PGR concentrations in callus induction stages after 54 d inoculation

表5 愈伤诱导阶段接种40 d后不同PGR浓度外植体的生长状况Table 5 Growth state of explants of different PGR concentrations in callus induction of stages after 40 d inoculation
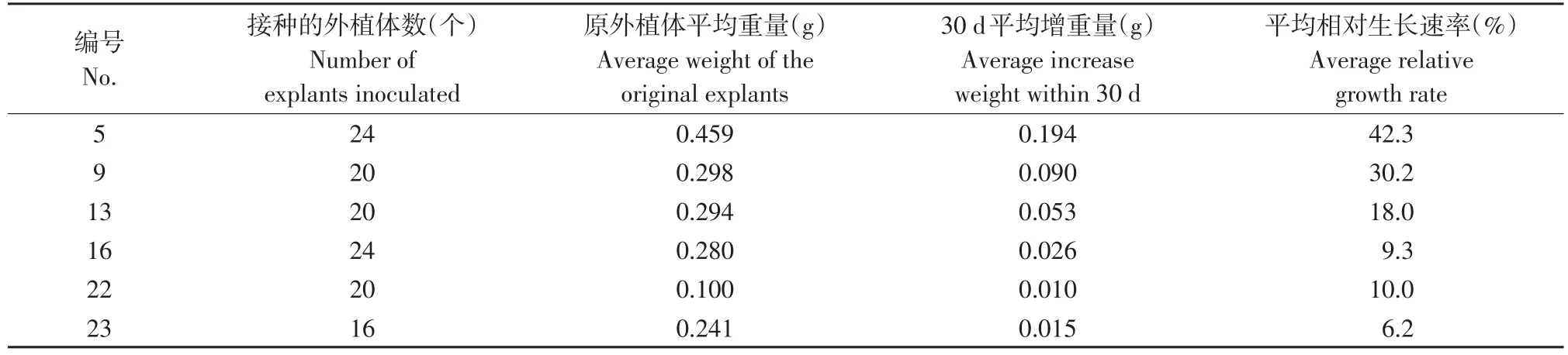
表6 愈伤组织诱导阶段外植体的增重状况Table 6 Weight status of explants in callus induction stage

图3 长胚性愈伤的外植体Fig.3 Explants of embryogenic callus

图4 长芽的胚状体Fig.4 Embryoids growing buds
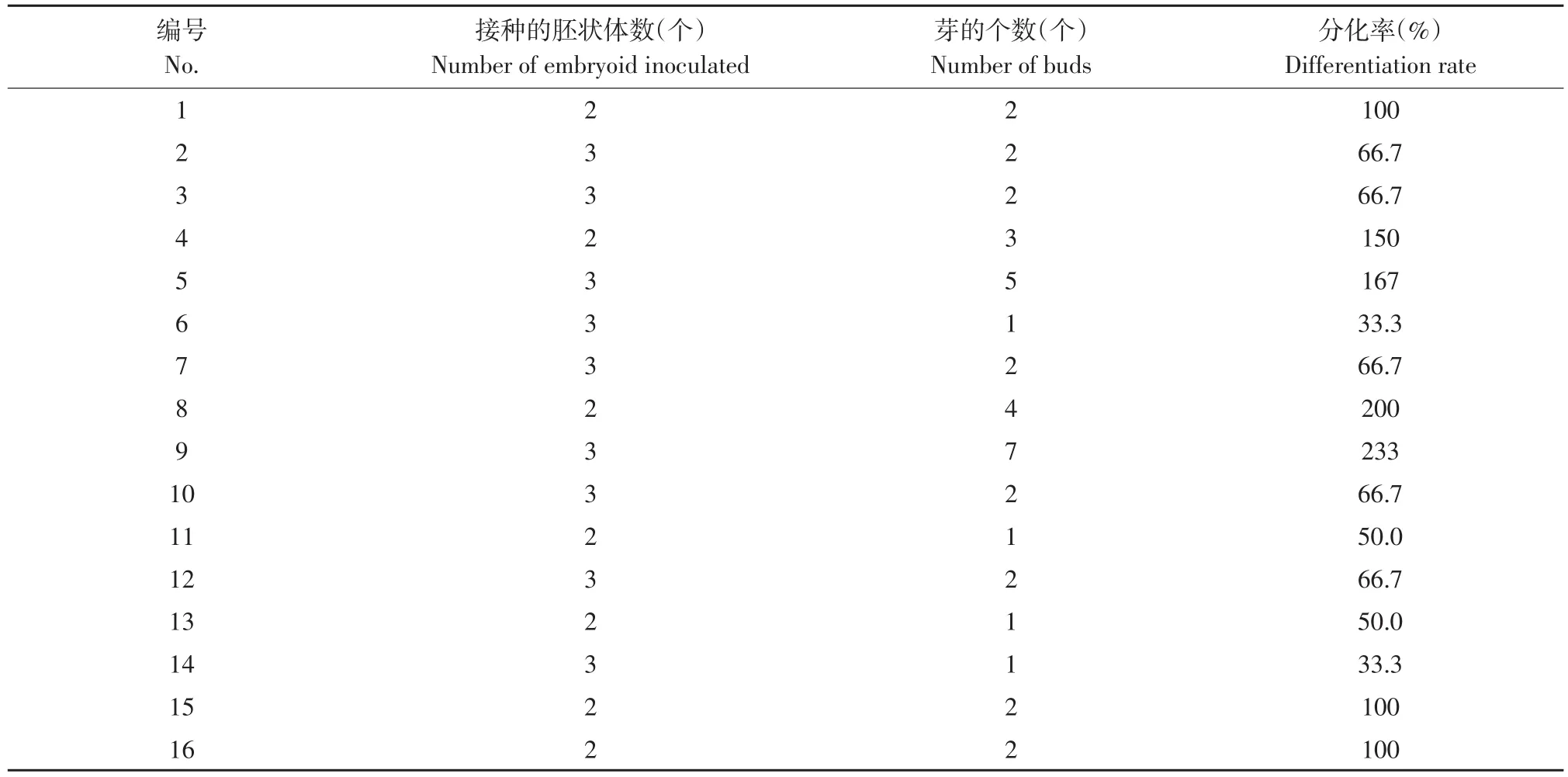
表7 愈伤组织分化阶段胚状体的生长状况Table 7 Growth state of embryoid in callus induction stage
2.4 生根阶段NAA的最佳浓度的筛选结果
将幼苗转移到不同NAA浓度的MS生根培养基中,2月27日接种,在接种38 d后观察芽的生根情况并统计,结果见表8。由表8可知,1号处理的生根率最高达到100%,而且根的状态很好,因此1号处理的NAA浓度(0.1 mg·L-1)适宜诱导根的生成(见图5)。

表8 生根阶段根的生长状况Table 8 Growth state of roots in rooting stage

图5 生根的芽Fig.5 Buds grow root
3 讨 论
3.1 叶片的选择时期
试验选材应选择生长一段时间的嫩叶片。在试验过程中,选取的材料有新生长出来的幼嫩叶片,生长一段时间的嫩叶片和老叶片,观察时发现,老化的叶片,虽然未受到升汞的伤害但是愈伤诱导率非常低。刚生长出来的嫩叶片,容易受到升汞的伤害导致死亡而不能萌动产生愈伤组织。
3.2 组织培养苗的退化
虎尾兰的品种有很多,繁殖的方法有扦插和分株法,但是金边和银边虎尾兰要保持其优良品种特性,避免出现返祖现象,只能用分株法,这就使其繁殖速率大大的降低,不能满足市场的需求,而利用组织培养方法快繁虎尾兰植株,既能提高植株繁殖速率,又能保持原品种的特性。
3.3 升汞的消毒时间
升汞虽然是剧毒物质,但是对外植体有很好的消毒效果,一般在组织培养时都会选择升汞对外植体进行消毒。消毒时间的长短随植物的不同而有差异,本试验对虎尾兰叶片的消毒时间进行了摸索,以保证既能达到很好的消毒效果,又不会对外植体造成伤害,本试验得出的结果是0.1%升汞消毒时间为3 min。但是1987年娄渊祥等以虎皮兰叶片为外植体快繁虎皮兰,其0.1%的HgCl2的消毒时间为8 min[9],为了避免外植体造成伤害,消毒时间越短越好,所以既然消毒3 min的效果也很好,最好选择3 min。
3.4 IBA对生根的影响
IBA也同NAA一样可诱导芽快速的生根,本试验没有对其进行研究,对于IBA的浓度对生根率的影响有待于进一步的研究。
4 结 论
虎尾兰叶片表面用0.1%升汞消毒3 min,污染率低,褐化/死亡率低,成活率高,效果最好。愈伤组织诱导培养基以MS+1 mg·L-16-BA+0.5 mg·L-1NAA+0.5 mg·L-12,4-D最有利于愈伤组织的生成。诱导芽的培养基以MS+1 mg·L-16-BA+0.8 mg·L-1NAA为最佳,不仅生成的芽多,而且健壮。生根培养基以MS+0.1 mg·L-1NAA最有利于根的生成,根的生长速度快,质量好。
[1] 李泽鸿,张璐,刘文涛,等.虎皮兰中4种重金属元素的含量测定[J].北方园艺,2010(1):153-154.
[2] 周宇,闫国华,张开春,等.虎尾兰叶片切段扦插育苗技术[J].中国花卉园艺,2006(4):25-26.
[3] 林丽仙,谢志南,苏明华,等.虎尾兰吸收甲醛及其保护酶活性的初步研究[J].福建农业学报,2009,24(3):258-261.
[4] 李庆军.观赏植物吸收居室甲醛能力的比较[D].哈尔滨:东北林业大学,2006:22.
[5] 吴华芬.健康花卉—虎尾兰室内养护技术和应用[J].现代园艺,2009(9):23-24.
[6] 刘英文,付世猛.虎尾兰养护管理要点[J].河北农业科技,2008(17):33.
[7] 谢怡青,温清英.金边虎尾兰的组织培养和快速繁殖[J].农业科技通讯,2007(6):56.
[8] 李勇,杨建芬,张朝成.狐尾龙舌兰的组织培养和快速繁殖[J].植物生理学通讯,2003(10):474.
[9] 洪向平,陈玉生,黄麒参.剑麻的组织培养快繁技术[J].广西热带农业,2007(5):29.
[10] 张翠玲,文慧婷.龙血树组织培养和快速繁殖[J].云南农业科技,2006(3):27-28.
[11] 王忠.植物生理学[M].北京:中国农业出版社,2005:336.
[12] 李浚明.植物组织培养教程[M].北京:中国农业大学出版社,2002:267-268.

