RT-PCR法克隆广谱抗病基因TGA2及其植物表达载体构建
刘永光,刘克锋,孙向阳
(1.北京林业大学水保学院,北京 100083;2.北京农学院城乡发展学院,北京 102206)
系统获得性抗性(Systematic acquired resistance,SAR)是植物抵御病原菌侵染的最有效手段[1],我们可以利用SAR信号传导途径中的关键功能基因来启动植物自然防御系统,达到广谱抗病的目的。NPR1基因在植物的SAR发生中起着重要的作用,通过NPR1基因的过量表达可以诱导植物SAR的起始,使植物产生对多种病原菌的广谱抗病性[2]。TGA2转录因子能直接和NPR1及其他多个病程相关基因启动子结合,从而启动SAR下游抗病基因的表达,增强病程相关蛋白的表达水平,特异的诱导植物产生SAR,从而启动植物的广谱抗病[3-4]。
TGA转录因子因为其序列中含有TGACG/as-1元件而得名。近年来,因其能够识别和结合植物的SAR反应的相关基因,促使SAR相关反应的启动,关于该转录因子家族的研究逐步深入,在模式植物拟南芥中,TGA家族现在共分离出六个成员,TGA1到TGA6,主要与植物的抗逆性和衰老等生理过程有关[5-6]。病原菌、伤害和植物激素类物质等多种外界因素均能诱导TGA基因的表达[7]。TGA转录因子可以和植物的广谱抗病基因NPR1的锚定重复序列相互作用。转录因子TGA2还能直接和NPR1下游的PR1基因启动子感应SA的调节元件结合[8]。
转录因子TGA2还能直接和NPR1下游的PR1基因启动子感应SA的调节元件结合[9]。TGA转录因子对植物抗病过程调节的原理总结如下[8-9]:
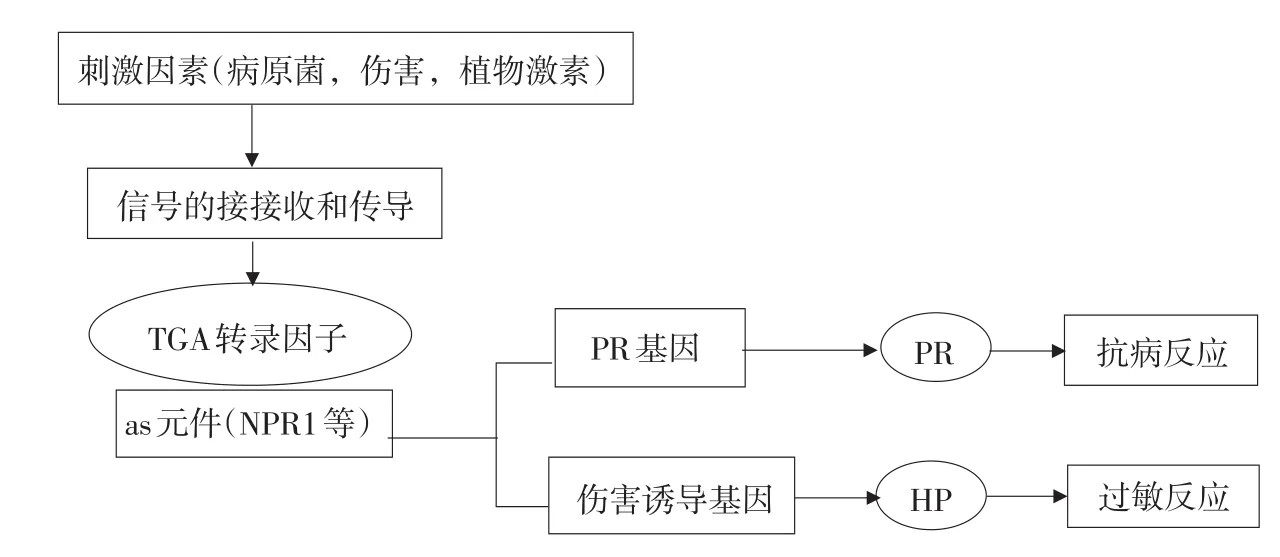
图1 TGA转录因子对植物抗病基因的调节Fig.1 Regulation pattern of TGA factors on plant disease-resistance gene
在水稻中发现,TGA2转录因子可以与PR1基因上有的启动子区域结合,将诱导信号转变成细胞反应,从而启动SAR[10]。在拟南芥中发现,TGA2、TGA5、TGA6对植物系统获得性抗病性的启动非常重要[11]。当对这三个基因分别进行敲除的时候,拟南芥中可以诱导SAR的启动,增强抗病性;全部进行敲除的情况下,不能够启动SAR和增强抗病性。这说明这三个转录因子的功能存在重叠[12]。在烟草中也发现,过量表达TGA2转录因子可以有效的增加PR相关基因的表达,增强植物的抗病性;而烟草TGA2失活突变体在SA处理后,不能够诱导SAR的启动,说明TGA2转录因子在SAR中起正调控作用[13]。与此同时,在转基因拟南芥和烟草中,通过过量表达TGA转录因子或者将其基因沉默和敲除,发现TGA2和TGA5也存在一定的负调控作用[14];研究还发现,TGA转录因子家族中TGA2、TGA3和NPR1基因的锚定结合力最强,TGA5、TGA6相对较弱[15];TGA2可以在植物的所有组织中表达,TGA1和TGA3主要在植物的由内组织和合根中表达[16]。
总之,TGA2转录因子能直接和多个病程相关基因启动子结合感应SA的调节元件结合,能够增强病程相关蛋白的表达水平,特异的诱导植物产生系统获得抗病性,从而达到广谱抗病的目的[17]。
本文采用RT-PCR的方法从拟南芥基因组中克隆TGA2转录因子,并将其构建入植物表达载体中,期望通过转化诱导目标植物的SAR反应的启动,相当于使目标植物体内保持一种高抗病的免疫水平,从而达到广谱抗病的目的,得到广谱抗病植株。
1 材料与方法
1.1 材料
植物材料为本实验室所保存的拟南芥,反转录由TaKaRa公司的BcaBESTTM RNA PCR KitVer.1.1反转录试剂盒完成,限制性内切酶购自大连TaKaRa有限公司,T载体为购自Promega公司的pGEM-T Vector;引物由上海Sangon公司合成,测序由上海Sangon公司完成,T4DNA连接酶购自NEB公司,大肠杆菌菌株为DH5α。
1.2 方法
1.2.1 引物设计
根据GenBank上所提供的TGA2基因的全序列,设计一对引物。上游引物:5'T↓CTTAGACA TATGGCTGATACCAGTCCGAG 3';下游引物:5'CC C↓GGGTCACTCTCTGGGTCGA 3'。在上下游引物的5'端分别加上了XbaⅠ和SmaⅠ酶切位点。
1.2.2 拟南芥基因组RNA的提取
采用Invitrigen公司的Trizol Reagent提取拟南芥总RNA,方法参考《分子克隆实验指南》[18]和《现代分子生物学实验手册》[19]改良。
1.2.3 RT-PCR扩增
以水代替植物RNA作为负对照,拟南芥总RNA为模板,选用TaKaRa公司的BcaBESTTM RNA PCR KitVer.1.1反转录试剂盒,进行mRNA的反转录反应以合成cDNA,再以cDNA为模板进行PCR扩增出目的基因。
PCR扩增的反应条件为:94℃3 min;94℃30 s,53 ℃ 45 s,72 ℃ 1 min 15 s(34个循环);72℃10 min,4℃短期保存。
1.2.4TGA2基因的切胶回收及与T载体的连接
将目的条带在紫外透射仪下切下,采用TaKaRa的胶回收试剂盒,按照操作步骤进行胶回收,然后与pGEM-T载体连接。利用PCR产物在3'末端自动加A及pGEM-T载体上多克隆位点处突出T的特点,在10 μL连接体系中加入以下成分:PCR回收产物3 μL,pGEM-T vector 1 μL,2×buffer 5 μL,T4DNA连接酶1 μL,总反应体系为10 μL,4℃连接过夜。
1.2.5TGA2基因的测序
将连接好的载体转化大肠杆菌DH5α感受态细胞,在含有X-gal和IPTG的LB+Amp选择抗性平板上筛选白色菌落。对重组子进行PCR鉴定和酶切鉴定,选择鉴定结果正确的送上海生工公司测序。
1.2.6TGA2基因表达载体的构建
将TGA2基因与pGEM-T载体连接所得到的载体命名为pGEM-TGA2。将pGEM-TGA2载体和p35STnos载体分别进行SmaⅠ/XbaⅠ双酶切,回收含有TGA2的片断和p35STnos载体片断,用T4DNA连接酶连接得到目的载体p35ST-TGA2。
2 结果与分析
2.1 所提取的拟南芥RNA
从图2中可以看出,通过TRIzol Reagent法所提取的拟南芥,28S、18S、5S三条带都有,说明RNA的完整性比较好;28S亮度虽然没有达到18S亮度的2倍,但5S条带并没有明显变亮,说明RNA提取过程中没有发生降解,可作为模板用于扩增TGA2基因。
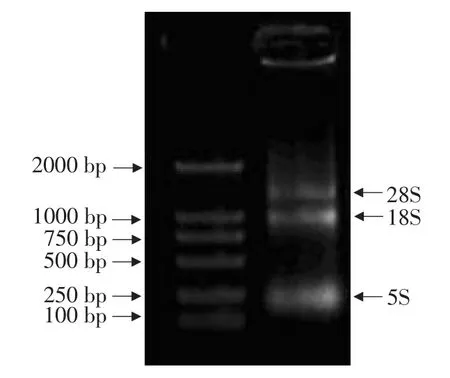
图2 所提取的拟南芥RNAFig.2 RNA of Arabidopsis thaliana
2.2 TGA2基因的RT-PCR扩增
测序结果显示所克隆基因全长993 bp,用DNAman软件对测序结果和NCBI上所公布的序列进行比对可知:所克隆基因与NCBI上所公布的序列99.80%同源。所克隆基因在317和500 bp处出现了两个碱基的置换。对序列进行翻译后发现,这两个置换并没有导致TGA2基因氨基酸序列的改变,属于正常的密码子的第三位碱基的摆动。所克隆基因含有TGA2转录因子的起始密码子ATG和终止密码子TGA,是完整的TGA2基因(见图3)。

图3 所克隆TGA2序列与NCBI上所公布序列的比对Fig.3 Blast between the amplification of TGA2 and the original sequence of NCBI
2.3 TGA2植物表达载体的构建
以EcoRⅠ/SacⅠ对pBI121酶切,回收T-nos片段,插入用同样双酶切的pCAMBIA3300中构建中间载体p3300-Tnos;以HindⅢ/XbaⅠ酶切p3301-BI121,回收CaMV35S片段,插入用同样酶切的p3300-Tnos中构建中间载体p3300-35ST;质粒pT-TGA2用XbaⅠ/SmaⅠ限制性内切酶进行双酶切,回收含有TGA2基因的1.0 kb的目标片段,插入以同样酶切处理的p3300-35ST中,筛选阳性克隆即得植物表达载体p35ST-TGA2(见图4)。
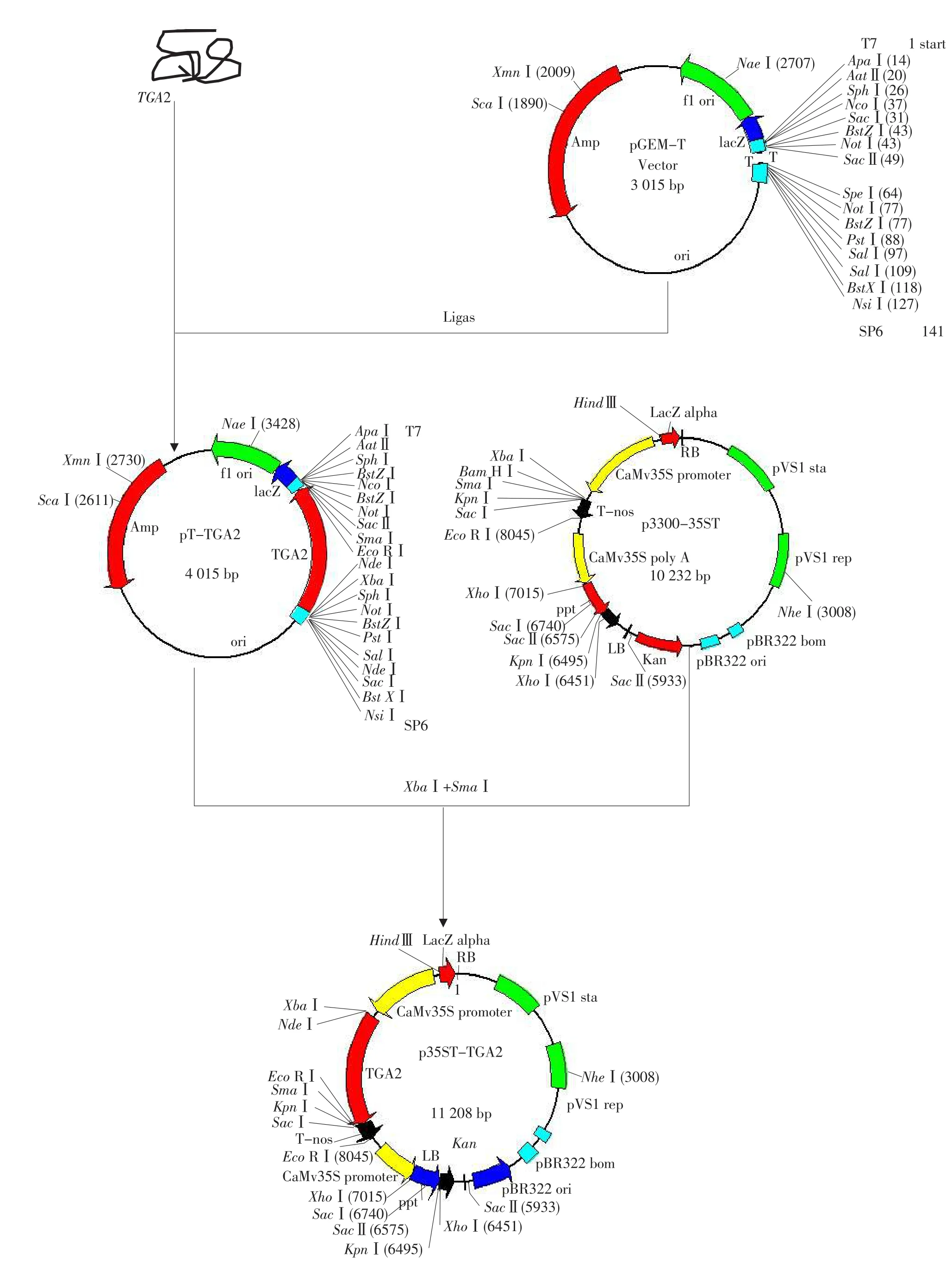
图4 p35ST-TGA2植物表达载体构建过程Fig.4 Construction of p35ST-TGA2 plant expression vector
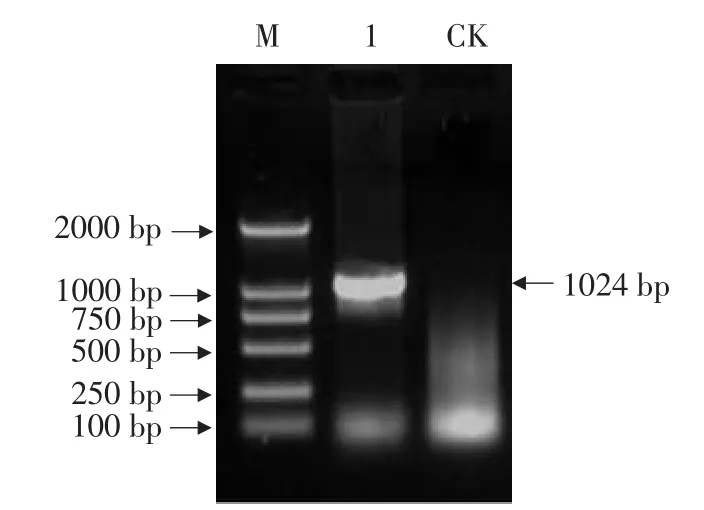
图5 TGA2基因的反转录PCR扩增Fig.5 RT-PCR amplification results of TGA2 gene
2.4 TGA2基因植物表达载体的PCR及酶切检测
TGA2基因植物表达载体的PCR及酶切检测具体结果见图5、6。
由图5可以看出,以p35ST-TGA2质粒为模板进行PCR扩增,得到TGA2目的条带。
由图6可以看出,将所构建的p35ST-TGA2载体用XbaⅠ单酶切,得到一条带,而且大小正确。
将载体和基因内部都含有的HindⅢ单酶切,得到两条带,大小正确;将载体用XbaⅠ/SmaⅠ双酶切,得到两条带,大小正确。
以上检测证明,所得到的目的载体构建正确。
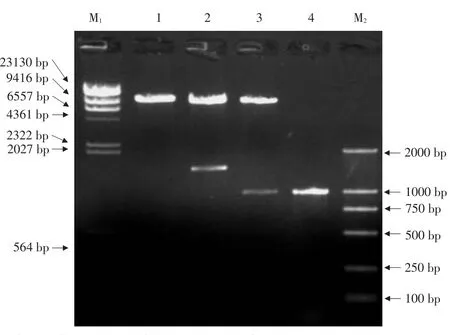
图6 载体酶切鉴定Fig.6 Enzyme digestion results of plant expression vector p35ST-TGA2.Ⅵ
3 讨论
植物抗病育种中缺乏可以直接利用的抗源,常规育种很难得到抗病品种。利用基因工程技术为植物抗病育种提供了新的途径,但在以往的工作中,大部分的研究者将注意力集中于那些有直接抗菌活性的物质,例如几丁质酶和β-1,3-葡聚糖酶,它们尽管在体外有抑菌活性,并且也获得了一些转基因抗病性提高的植株,但是很难达到高抗水平。
一个转录因子可以调控多个与同类性状有关的基因的表达,在提高作物对环境胁迫抗性的分子育种中,与导入或者改良个别功能基因来提高某种抗性的传统方法相比,从改良或者增强一个关键的转录因子的调控能力着手,也许是提高作物抗逆性的更为有效的方法和途径,增强一个转录因子的作用,就可以通过它促使多个基因发挥作用,从而是植株性状获得综合改良的效果[20]。
对于广谱抗病基因工程,尽管没有明确的概念提出,但是目前越来越多的研究者注意到改造植物本身的防御水平和对病原菌的敏感程度可以达到提高植物抗病性的目的[21]。生产上向作物直接喷施水杨酸来防治病害就是一个明证。利用基因工程技术改造植物SAR发生进程也取得了许多有益的进展,例如,过量表达NPR1基因的拟南芥和转基因高含量SA的烟草都表现出了不同程度的广谱抗病结果[22]。东北农业大学车代弟教授将NPR1基因成功转入唐菖蒲和百合中,并获得转基因植株,但后续的转基因植株的田间试验未见报道[23-24]。
与此同时,国内很多科研工作者注意到TGA转录因子家族在SAR中所起到的重要作用,多篇文献综述都予以大量关注,相信国内的植物广谱抗病育种将会逐步开展该基因的转化和应用工作。
4 结论
本文在国内首次将克隆到的拟南芥TGA2转录因子构建植物表达载体,以期转入植物获得广谱抗病植株。
*孙向阳为本文的同等贡献者。
[1] Oliver M J,Wood A J.Desiccation tolerance of mosses,in stress-inducible processes in higher eukaryotic cells[M].New York:Plenum Publishing Corp,1997:1-26.
[2] Zhang H Z,Cai X Z.Nonexpressor of pathogenesis related genes 1(NPRl):A key node of plant disease resistance signaling[J].Journal Biotechnology,2005,21(4):511-515.
[3] Cao H,Bowling S A,Gordon A S,et al.Characterization of anArabidopsis thalianasismutant that is non responsive to inducers of systemic acquired resistance[J].Plant Cell,1994(6):1583-1592.
[4] Cao H,Glazebrook J,Clarke J D,et al.TheArabidopsis NPR1 gene that controls systemic acquired resistance encodes a novel protein containing ankyrin repeats[J].Cell,1997,88:57-63.
[5] Dong X.Generation of broad-spectrum disease resistance by over expression of an essential regulatory gene in systemic acquired resistance[J].Pro Nat Acad Sci USA,1998,95:6531-6536.
[6] Eulgem T,Somssich I E.Networks of WRKY transcription factors in defense signaling[J].Plant Biol,2007,10:366-371.
[7] Zhou J M,Trifa Y,Silva H,et al.NPR1 differentially interacts with members of the TGA/OBF family of transcription factors that bind an element of thePR-1 gene required for induction by salicylic acid[J].Mol Plant Microbe Interact,2000,13:191-202.
[8] Yu D Q,Chen C H,Chen Z X,et al.Evidence for an important role of WRKY DNA binding proteins in the regulation ofNPR1 gene expression[J].Plant Cell,2001,13:1527-1540.
[9] Zhang Y,Cheng Y T,Negative regulation of defense responses in Arabidopsis by two NPR1 paralogs[J]Plant J,2006,48:647-656.
[10] Cao H,Li X,Dong X.Generation of broad-spec-trum disease resistance by overexpression of an essential regulatory gene in systemic acquired resistance[J].Proc Natl Acad Sci USA,2004,95:6531-6536.
[11] Xu X,Chen C,Physical and functional interactions between pathogen-inducedArabidopsisWRKY18,WRKY40,and WRKY60 transcription factors[J].Plant Cell,2006,18:1310-1326.
[12] Sebastian.TheArabidopsisPR-1 promoter contains multiple integration stes for the coactivator NPR1 and the repressor SNI1[J].Plant Physiology,2010,15(44):5-18.
[13] Blanco F,Salinas P.Early genomic responses to salicylic acid inArabidopsis[J].Plant Mol Biol,2009,70:79-102.
[14] Boyle P,Le Su E.The BTB/POZ domain of theArabidopsisdisease resistance protein NPR1 interacts with the repression domain of TGA2 to negate its function[J]Plant Cell,2009,21:3700-3713.
[15] Durrant W,Wang S,Dong X.Rabidopsis SNI1 and RAD51D regulate both gene transcription and DNA recombination during the defenseresponse[J].ProcNatlAcadSciUSA,2007,104:4223-4227.
[16] Despres C,DeLong C,Glaze S R,et al.TheArabidopsisNPR1/NIM1 protein enhances the DNA binding activity of a subgroup of the TGA family of bZIP transcription factors[J].The Plant Cell,2005(12):279-290.
[17] Tada Y,Spoel S H.Plant immunity requires conformational changes of NPR1 via S-nitrosylation and thioredoxins[J].Science,2008,321:952-956.
[18] 莎姆布鲁克J.分子克隆实验指南[M].黄培堂,译.北京:科学出版社,2005.
[19] 张维铭.现代分子生物学实验手册[M].北京:科学出版社,2007.
[20] Ekengren S K,Liu Y,Schiff M,et al.Two MAPK cascades,NPRI,and TGA transcription factors play a role in Pto-mediated disease resistance in tomato[J].Plant,2003,36:905-917.
[21] Kesarwani M,Yoo J,Dong X,Genetic interactions of TGA transcription factors in the regulation of pathogenesis-related genes and disease resistance inArabidopsis[J].Plant Physio,2007,144:336-346.
[22] Yoo S D,Cho Y H,Sheen J.Arabidopsismesophyll protoplasts:A versatile cell system for transient gene expression analysis[J].Nat Protoc,2006(2):1565-1572.
[23] 刘永光,车代弟,王金刚,等.RT-PCR法克隆拟南芥中NPR1基因及其植物表达载体的构建[J].东北农业大学学报,2007,38(4):491-494.
[24] 王凯,车代弟,王金刚,等.百合遗传转化体系的建立[J].东北农业大学学报,2008,39(5):39-43.

