矮化黄瓜膨胀素Cs-EXPA1基因的表达差异研究
王多佳,李凤兰,任明玄,胡宝忠
(东北农业大学生命科学学院,哈尔滨 150030)
黄瓜(CucumissativusL.)为葫芦科(Cucurbitaceae)甜瓜属(Cucumis)一年生草本攀援植物,是重要的蔬菜作物,栽培广,面积大,在蔬菜供应和国民经济中均占有重要地位[1]。我国是世界上黄瓜生产面积最大、总产量最高的国家。我国广泛栽培的黄瓜品种多为蔓生品种,由于植株高大,需要人为搭架,造成大量的人力、物力的浪费,严重地影响了我国黄瓜产业的发展。矮生性状是高等作物理想株型性状的一个重要方面,矮化(杆)品种抗倒伏能力强,适宜高度密植,群体光能利用率高[2-3]。本文中所用矮化黄瓜D0462,其表型为植株矮小(只有30 cm高),节间缩短,几乎不分枝,呈现出直立、紧凑的株型。
膨胀素(Expansin)是植物细胞壁松弛蛋白,主要参与细胞的生长、伸长和一系列细胞壁的修饰过程。它能缓释细胞壁结构网中的张力,使细胞壁变得松弛,因此多被译为膨胀素[4]。Cs-EXPA1基因是最早在黄瓜下胚轴中被发现的膨胀素基因,在对膨胀素近十年的研究中发现,它参与了许多植物生长发育过程的调控,比如细胞生长、叶原基的产生、花粉管渗入、果实成熟、细胞壁降解、种子的生长和萌发等,而且它还对淹水、光处理、旱胁迫等产生反应[5-8]。但与矮化的关系尚未见报道,因此开展黄瓜矮化突变体膨胀素基因的分离克隆研究,这将对于探讨植物的矮化机理具有重要作用。
本研究克隆了黄瓜下胚轴、根、子叶组织中的膨胀素基因Cs-EXPA1,研究了它在黄瓜生长苗期不同部位的表达量差异,通过与正常株高的对照组的表达量比较,探讨了膨胀素基因在矮化黄瓜生长发育中的作用,为利用基因工程技术改变膨胀素在矮化植株中的表达以便增加作物产量提供有效途径。
1 材料与方法
1.1 材料
矮化黄瓜D0462,对照材料为长蔓正常株高品种129,均由东北农业大学园艺学院黄瓜课题组提供。在培养箱中28℃光培养16 h,25℃暗培养8 h,分别于破土后16、24、40、48、64、72、88、96 h取D0462和129的下胚轴、根和子叶作为试材。
1.2 RNA的提取、cDNA的合成及黄瓜Cs-EXPA1基因的克隆
用Trizol法(Invitrogen公司)提取RNA,用TaKaRa公司的PrimeScriptTMRT-PCR Kit反转录试剂盒说明书合成cDNA第一链,根据Cs-EXPA1序列(GenBank登录号U30382.1),设计合成一对引物,上游R1:5'TTCGCTAATCTCCCCTTTCTTCC 3', 下 游 R2: 5'GTCGTTCGCGTTTTGTTGTTGTT 3'。以第1链cDNA为模板进行扩增,反应条件为94℃5 min;94℃30 s;57℃30 s;72℃30 s;共35个循环,最后72℃延伸10 min。反应产物从1%琼脂糖凝胶上回收后,克隆入pMD-18T载体(TaKaRa),转化大肠杆菌DH5α,提取质粒鉴定后由南京博仕公司测序。
1.3 Cs-EXPA1基因在苗期不同组织中的Realtime PCR表达分析
TaqMan探针法测定Cs-EXPA1基因的不同时空表达情况,利用Primer Express 2.0设计荧光定量探针引物。在检测探针所在靶序列的两端设计普通引物,扩增200~500 bp片段作为阳性克隆基因。引物序列为上游:5'TACTTCAACCTCGTTTTGATCACA 3';下游:5'CGAGACCCCTTTATCGACACA 3';探针:FAM-TGGCGCAGGCGACGTCCA-BHQ1。以黄瓜β-actin为内参,上游:5'GTGTGAGTCACACTG TTCCCATC 3';下游:5'AGCAAGGTCCAAACGG AGAA 3';内参探针:FAM-AGGGTTACGCCCTCC CTCATGCC-BHQ1。由南京博仕公司合成。预变性95℃30 s,PCR反应40个循环,95℃5 s,60℃34 s。Real-time PCR用ABI7500荧光定量PCR仪,按照试验手册进行。试验结束后确认实时PCR的扩增曲线,设3次重复,根据2-ΔΔct法测定基因的相对定量。
2 结果与分析
2.1 Cs-EXPA1基因的克隆
采用Trizol试剂盒(Invitrogen)提取苗期黄瓜D0462和129的下胚轴、根、子叶的总RNA,取1 μg总RNA作为反转录的模板,反转录体积10 μL,分别取2 μL做模板,以R1、R2为引物扩增目的基因,按照扩增条件,35个循环,1%琼脂糖凝胶电泳,如图1所示。将目的片段胶回收,并与pMD-18T(TaKaRa)载体连接,转化,挑取白斑,经测序比对结果见图2。

图1 Cs-EXPA1基因PCR扩增结果Fig.1 PCR amplification result of Cs-EXPA1
2.2 Cs-EXPA1基因在苗期不同组织中的Realtime PCR表达分析
Cs-EXPA1基因在黄瓜矮化突变体D0462和正常品种129下胚轴中的变化趋势相似,如图3所示,在96 h内的生长时期中都有表达量的峰值,D0462在64 h处达到峰值,几乎是平均水平的70倍,随后急剧下降,品种129则在72 h处达到峰值,表达量是平均水平的15倍左右。在其他的测试时间内,D0462的表达量都略高于129。
从图4中我们可以看出,品种129子叶中Cs-EXPA1的表达量要远大于D0462,矮化突变体的子叶中Cs-EXPA1的表达基本保持在低水平上,但是品种129中子叶的Cs-EXPA1基因从24 h后逐渐增加,到64 h后达到峰值,随即降低,到96 h时与D0462的表达量基本持平。说明在24~72 h之内是正常黄瓜子叶膨胀素基因Cs-EXPA1大量表达的重要时期。
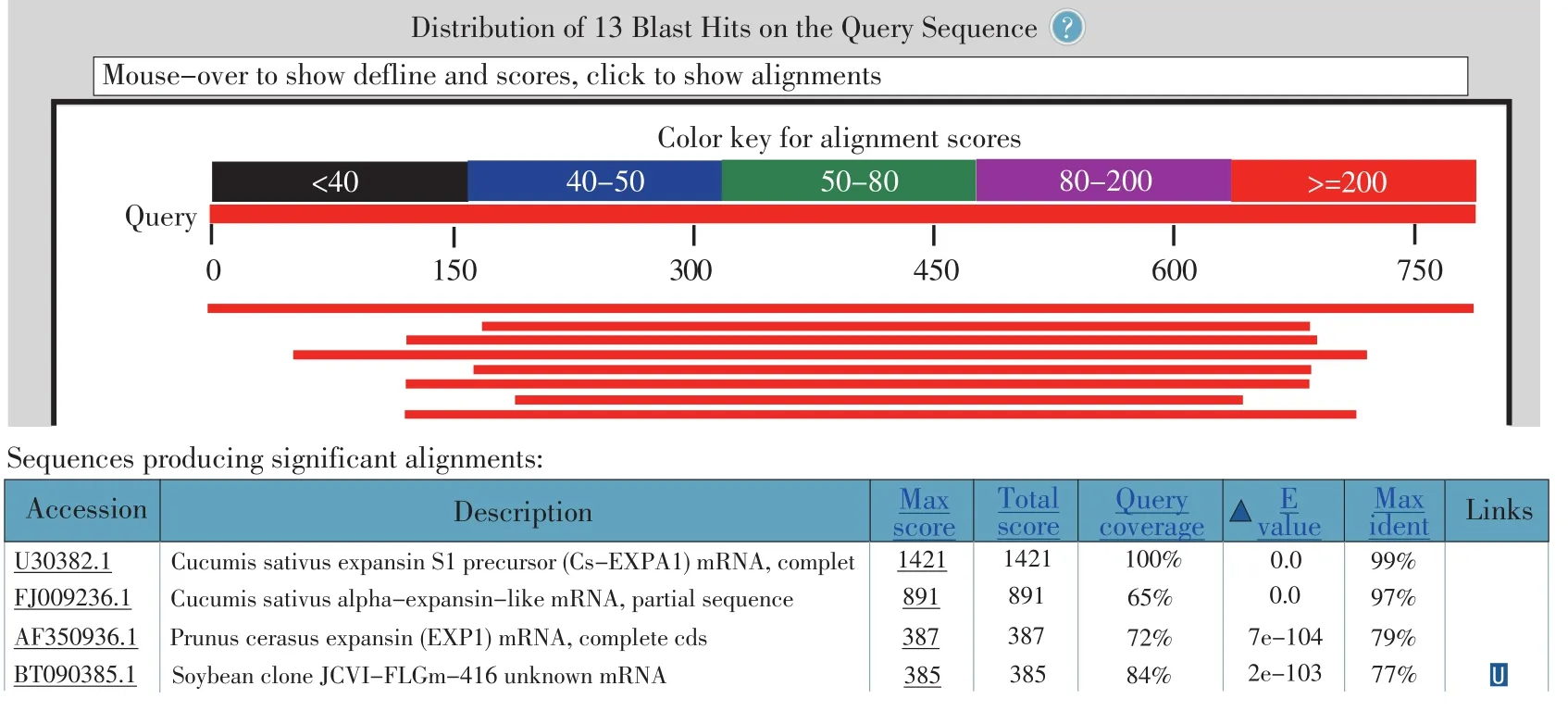
图2 Cs-EXPA1基因在NCBI上的比对结果Fig.2 Blast result of Cs-EXPA1 in NCBI website
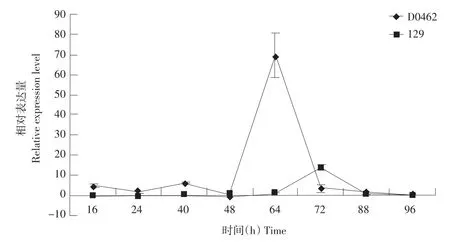
图3 Cs-EXPA1基因在黄瓜下胚轴中的表达Fig.3 Expression of Cs-EXPA1 gene in hypocotyl of cucumber

图4 Cs-EXPA1基因在黄瓜子叶中的表达Fig.4 Expression of Cs-EXPA1 gene in cotyledon of cucumber
从图5中我们可以看出,根中Cs-EXPA1基因的表达相对于下胚轴和子叶来说表达量很少,对于D0462,其根中Cs-EXPA1的表达基本没有显著的增长或者降低,基本保持在相当少的水平上,只在24和88 h时略微增长,而正常品种129根中Cs-EXPA1则在96 h处显著增加,达到平均水平的10倍左右。这也说明此时129根中膨胀素基因的开始大量表达并对根细胞起作用。
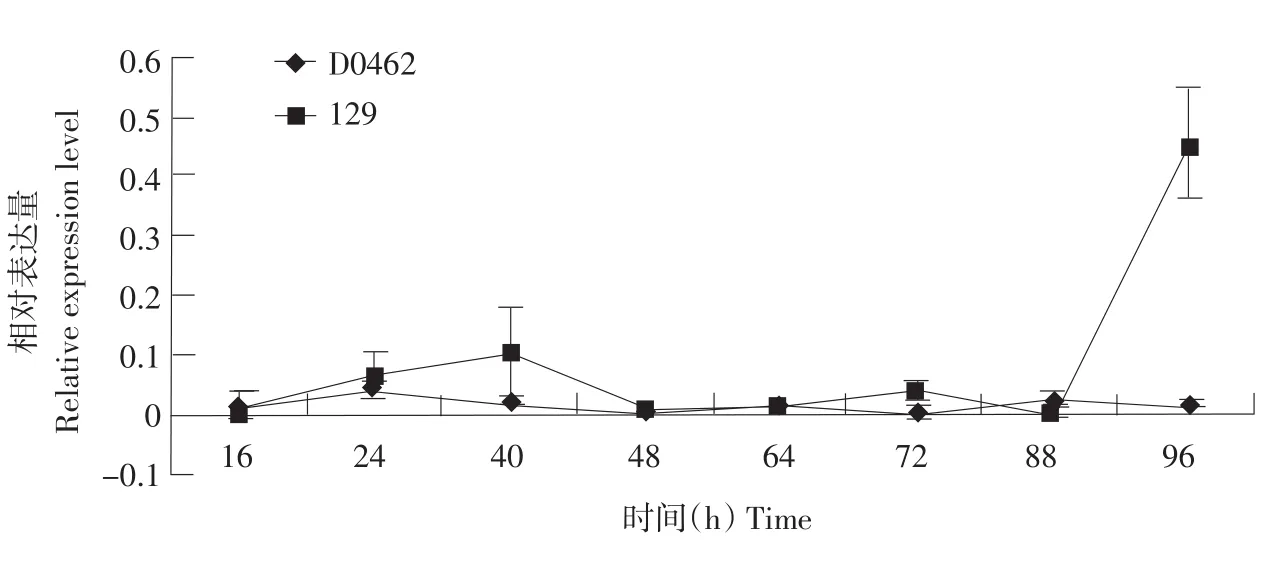
图5 Cs-EXPA1基因在黄瓜根中的表达Fig.5 Expression of Cs-EXPA1 gene in roots of cucumber
3 讨论与结论
膨胀素是近年来发现的迄今唯一能诱导热钝化的离体细胞壁伸展的细胞壁特异性蛋白质。在控制植物细胞生长方面,能调节细胞壁的膨胀,可以通过生长素调控,引起pH下降,激活膨胀素及相关水解酶,引起木葡聚糖或(1,3),(1,4)-β-D-葡聚糖(MLG)等半纤维素的降解,打断半纤维素与纤维素微纤丝之间的氢键,改变细胞壁的承重网络,从而加速生长[9-10]。此外,膨胀素对植物发育也起一定的调控作用,但只在正确的位置和时间内刺激细胞生长,是细胞壁中的一种发育决定成分。
本研究获得的Cs-EXPA1是最早在黄瓜下胚轴中发现的膨胀素蛋白基因之一,从本试验中可以确定该基因在子叶与根中都有表达,并且通过Real-time PCR定量分析得出Cs-EXPA1基因在不同的部位的表达量不同,膨胀素Cs-EXPA1基因在下胚轴中的表达量最高,在子叶中次之,在根中的表达量最低。并且Cs-EXPA1基因的表达具有时空特异性,随时间的变化,在不同组织部位或同一组织不同发育时期的表达活性各不相同,这与前人得到的结果一致[11-13]。
同时,矮化黄瓜与正常长蔓品种相比膨胀素Cs-EXPA1基因的表达量也有明显差异,在矮化黄瓜D0462的子叶和根中Cs-EXPA1的表达量要小于正常的黄瓜品种129,并且随时间变化不大,但在下胚轴中64 h的表达量却远大于品种129。据报道,黄瓜植株株高是由单基因体系和多基因体系共同决定的[14],所以,在矮化黄瓜中膨胀素Cs-EXPA1单个基因的表达量不能决定植株的矮化。
膨胀素活性也是重要的因素,Cosgrove等在研究燕麦胚芽鞘时发现,对黑暗培养4 d的燕麦胚芽鞘照白光处理,8~10 h之后,生长陡然停止,外源生长素也不能诱导生长恢复[15],同时,细胞壁中的广泛生长因子膨胀素的活性没有下降,只是量上有稍微的降低,随着照光的持续,生长才逐渐恢复[16]。推测光照对膨胀素活性的调控有很大的影响。
目前,蔬菜作物上矮化基因的研究尚处于起步阶段,不同株型的矮生类型如何利用也有待深入研究,另外,利用分子生物学技术进行矮化机理的研究也比较薄弱,同时膨胀素如何促使植物细胞壁松弛与伸长的具体机制尚不清楚,这都有待进一步研究。
[1] 张鹏,秦智伟,王丽丽,等.黄瓜果实弯曲形状的QTL定位[J].东北农业大学学报,2010,41(11):60-64.
[2] 王多佳,黄莎莎,李凤兰,等.黄瓜矮化突变体膨胀素Cs-EXPA2基因的克隆与表达分析[J].中国蔬菜,2011,V1(2):44-47.
[3] 孟婧,李凤兰,胡宝忠,等.矮化黄瓜幼苗对外源GA处理的生理反应[J].东北农业大学学报,2009,40(11):60-64.
[4] Cosgrove D J.How do plant cell wall extend?[J].Plant Physiol,1993,102:1-6.
[5] Mc Queen-Mason S J,Cosgrove D J.Disruption of hydrogen bonding between plant cell wall polymers by proteions that induce wall extension[J].Proc Natl Acad Sci USA,1994,91:6574-6578.
[6] 马俊莲,张子德,Powel A T,等.膨胀素在果实完熟中的作用[J].园艺学报,2003,30(4):492-495.
[7] Le T N,Mc Queen-Mason S J.Desiccation-tolerant plants in dry environments[J].Review Environment Science and Biotechnology,2006(5):269-279.
[8] Sun Y D,Zhang X G,Luo W R,et al.Clone and analysis of expansin gene of cucumber fruit[J].Acta Bot Boreal-Occident Sin,2008,28(2):233-236.
[9] 陈爱国,陈进红.Expansin的研究进展[J].植物学通报,2003,20(6):752-758.
[10] Huang J,Takano T,Akita S.Expressing of alpha-expansin genes in young seedings of rice(Oryza sativaL.)[J].Planta,2000,211:467-473.
[11] Mc Queen-Mason S J,Daniel M,Durachko,et al.Two endogenous proteins that induce cell wall expansion in plants[J].The Plant Cell,1992(4):1425-1433.
[12] 荆赞革,柳李旺.萝卜扩展蛋白基因RsEXPB1克隆与表达特征分析[J].分子植物育种,2009,7(4):801-805.
[13] 宋平,周燮.深水稻节间伸长生长的机制[J].植物学通报,2000,17(1):46-51.
[14] 孙小镭,邬树桐,宋绪峨.中国矮生刺黄瓜品系特性研究初报[J].园艺学报,1990,17(1):59-64.
[15] Cosgrove D J.Enzymes and other agents that enhance cell wall extensibility[J].Annu Rev Plant Physiol Plant Biol,1999,50:391-417.
[16] Cosgrove D J.New genes and new biological roles for expansins[J].Current Opinionin Plant Biology,2000(3):73-78.

